2011 год № 3
Теоретическая и экспериментальная медицина
2Институт охраны материнства и детства СО РАМН, 680022, ул. Воронежская, 49, кор. 1, г. Хабаровск
Резюме:
Ключевые слова:
Mother and Child Care Institute of Siberian Branch of Russian Academy for Medical sciences, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Головной мозг является одним из органов-мишеней половых стероидных гормонов. Рецепторы к этим гормонам выявлены в таких его отделах, как гипоталамус, гиппокамп [12], неокортекс [8, 12, 16]. При этом в головном мозге концентрации половых гормонов превышают таковые в крови [7]. Гонадэктомия самцов, циклические изменения концентрации в крови половых стероидов у самок крыс отражаются на содержании стероидных гормонов в разных отделах мозга, а также на поведении животных [10]. Одним из эффектов половых стероидов также является их влияние на свободнорадикальное окисление (СРО), интенсивность процессов которого неодинакова в разных возрастных группах [1].
Существенные отклонения концентрации и соотношения андрогенов и эстрогенов как у мужчин, так и у женщин являются не только медицинской, но и социальной проблемой. Дефицит тестостерона у мужчин сопровождается снижением физической и интеллектуальной активности, раздражительностью, повышенной утомляемостью [6, 14]. Климактерический и предменструальный синдромы у женщин включает в себя ухудшение памяти, снижение способности концентрировать внимание, повышенную эмоциональность и депрессию [13].
В то же время известно, что мозг способен выполнять свои функции, несмотря на высокую вариабельность концентрации половых стероидов в организме, которые имеются в норме (в периоде роста и полового созревания, в течение менструального цикла, в процессе старения) и усиливаются при патологических процессах [8].
Это дает возможность предположить, что в мозге имеются механизмы, в определенной мере "нейтрализующие" последствия значительных колебаний концентраций действующих на него стероидов. Можно предположить, что один из таких механизмов обусловлен способностью нейронов и глиоцитов синтезировать стероидные гормоны - нейростероиды [15, 17]. Их синтез показан в различных отделах мозга, в том числе в нейронах гиппокампа и неокортекса, клетках Пуркинье коры мозжечка [17].
Настоящее исследование является фрагментом работы, посвященной изучению влияния различной концентрации половых гормонов в крови на показатели развития головного мозга в разные периоды онтогенеза [3]. В связи с вышеизложенным, целью настоящей работы явилось изучение последствий дефицита половых гормонов на морфометрические, био- и гистохимические показатели развития головного мозга молодых половозрелых крыс.
Материалы и методы |
 |
 |
Исследование проведено на белых половозрелых беспородных крысах из 4 пометов, которые были разделены на две группы - опытную и контрольную. Подопытную группу составили животные, которых в 60-дневном возрасте подвергли под эфирным наркозом двусторонней гонадэктомии (9 самцов и 8 самок). Контрольные крысы были подвергнуты "ложной" операции (7 самцов и 7 самок). Животные обеих групп содержались одновременно в условиях одного вивария, корм и воду получали ad libittun и в 60-дневном возрасте практически не отличались по массе тела. Показатели их поведения в 80-дневном возрасте исследовали в приподнятом крестообразном лабиринте (ПКЛ), как описано в [2].
Забой животных производили декапитацией в утренние часы на 90 дн. жизни. Извлекали головной мозг, определяли его массу, левое полушарие фиксировали в жидкости Карнуа, из переднетеменной (ПТД) и собственно теменной (СТД) долей [11] после заливки в парафин готовили срезы толщиной 7 мкм. Препараты окрашивали галлоцианином по Эйнарсону [4] на нуклеиновые кислоты.
Морфометрический анализ, определение концентрации РНК в цитоплазме клеток и численной плотности нейронов проводили, как описано ранее [2, 3]. Кроме того, исследовали активность 3β-гидроксистероиддегидрогеназы (ГСДГ) в головном мозге крыс препубертатного возраста (42-дневных), подвергнутых в 30-дневном возрасте гонадэктомии или "ложной" операции (контроль).
Гонадэктомированные (6 самцов, 4 самки) и контрольные (6 самцов, 5 самок) животные принадлежали одним и тем же пометам и в 30-дневном возрасте практически не различались по массе тела. При забое животных извлекали головной мозг, из полушария выделяли собственно теменную долю (СТД), из нее готовили криостатные срезы (толщиной 40 мкм), на них наносили инкубационный раствор для выявления ГСДГ, приготовленный по [5]. Интенсивность реакции измеряли на препаратах, заключенных в глицерин-желатину, на аппарате "Мекос" (λ=550 нм) в нейронах слоя V СТД и поля СА I гиппокампа. В каждом случае измерения проводили не менее чем в 10 нейронах каждой локализации.
В коре лобной доли правого полушария активность процессов СРО исследовали методом хемилюминесценции (ХМЛ), как описано в [9]. Иммуноферментным методом в сыворотке крови крыс определяли концентрации прогестерона (у самок) и тестостерона (у самцов) [3]. Статистическую обработку количественных данных проводили с помощью пакета программ Statistica 6.0.
Результаты и обсуждение |
 |
 |
Масса тела животных, подвергнутых в 2-месячном возрасте гонадэктомии, в 3-месячном возрасте не имела межгрупповых отличий у животных обоего пола. Гонадэктомия не отразилась и на массе их головного мозга (табл. 1), что совпадает с результатами, которые получены нами ранее при кастрации неполовозрелых животных [3]. Концентрация тестостерона в крови кастрированных самцов равнялась 2,75±0,35 нмоль/л (у контрольных - 17,2±2,6 нмоль/л, р<0,05). Концентрации прогестерона в крови экспериментальных самок составила 1,06±0,2 против 15,5±4,3 нмоль/л в контроле (р<0,05; табл. 2). Морфометрический анализ показал, что у подопытных самцов толщина неокортекса ПТД (1755±17 мкм) была достоверно увеличена в сравнении с контролем (1615±49 мкм). У самок межгрупповые показатели были сходной направленности, но статистически недостоверными. Толщина коры СТД как у самцов, так и у самок не имела статистически значимых межгрупповых различий (табл. 1). Численная плотность нейронов в мозге у самцов в слое II ПТД достоверно превышала контрольные показатели на 34%, в слое V ПТД - на 25%. У самок экспериментальной группы число нейронов в стандартном поле зрения в слоях II и V ПТД также достоверно возросло (на 16 и 11% соответственно, р<0,05) по сравнению с контрольной группой. В слое II СТД количество нейронов в стандартном поле зрения у самцов крыс имело значение 21,8±0,66, что на 24% было выше, чем в контроле, - 17,5±1 (р<0,05). Численная плотность нейронов гиппокампа у экспериментальных самцов составила 25,6±0,7 против 21,9±0,5 в контроле (р<0,05). У самок достоверных межгрупповых отличий по данным показателям не обнаружено (табл. 1).
| Показатель | Самцы | Самки | ||
|---|---|---|---|---|
| опыт (n=9) | контроль (n=7) | опыт (n=8) | контроль (n=7) | |
| Масса абс., мг: - мозга | 1777±34 | 1760±34 | 1682±17 | 1678±15 |
| Толщина, мкм: - ПТД | 1755±17* | 1615±49 | 1718±24 | 1674±33 |
| - СТД | 1162±34 | 1133±17 | 1214±54 | 1210±29 |
| Число нейронов в стандартном поле зрения ПТД: - слой II | 20,4±0,87* | 15,2±0,6 | 18,3±0,7* | 15,7±0,9 |
| - слой V | 10,5±0,32* | 8,4±0,32 | 8,9±0,2* | 8±0,2 |
| СТД: - слой II | 21,8±0,66* | 17,5±1 | 18,9±0.5 | 17,5±0,7 |
| - слой V | 10,8±0,38 | 9,2±0,23 | 9.7±0,2 | 9±0,4 |
| Гиппокамп | 25,6±0,7* | 21,9±0,5 | 24,5±0,7 | 23±0,7 |
| Площадь сечения, мкм2 ПТД Слой II: - ядрышек | 3,1±0,14 | 2,7±0,07 | 2,6±0,07 | 2,6±0,09 |
| - ядер | 53±1,7 | 49±1,9 | 51±1 | 54±1,2 |
| - цитоплазмы | 50±2,5 | 46±3,6 | 49±2,2 | 50±2,2 |
| Слой V: - ядрышек | 7,3±0,27* | 6±0,3 | 6,3±0,2 | 6,3±0,2 |
| - ядер | 107±2,1 | 102±3,7 | 101±3,4 | 104±3,3 |
| - цитоплазмы | 161±7,7 | 143±7 | 144±4,5 | 144±6 |
| СТД Слой II: - ядрышек | 2,9±0,2 | 2,9±0,11 | 2,7±0,05 | 2,6±0,14 |
| - ядер | 55±1,5* | 50±1,3 | 51±1,5 | 53±1,5 |
| - цитоплазмы | 53±2,6* | 45±1,4 | 48±2,7 | 46±1 |
| Слой V: - ядрышек | 6,3±0,23 | 6±0,3 | 5,6±0,3 | 5,3±0,2 |
| - ядер | 89±3,5 | 93±2.7 | 90±4 | 88±2,3 |
| - цитоплазмы | 129±14 | 123±4,5 | 116±7,3 | 106±4,4 |
| Гиппокамп: - ядрышек | 3,6±0,2 | 3,6±0,13 | 3,5±0,08 | 3,3±0,16 |
| - ядер | 71±1,6 | 72±1,6 | 67±1,4 | 67±1,4 |
| - цитоплазмы | 51±1,2 | 49±0,9 | 48±1,5 | 47±1,6 |
Примечание. * - различия с контролем статистически достоверны (р<0,05).
В слое V неокортекса ПТД размеры ядрышек, в слое II СТД площадь сечения ядер и цитоплазмы нейронов подопытных самцов превышали аналогичные показатели в контроле (р<0,05). У самок размерные характеристики исследованных нейронов неокортекса и гиппокампа не имели статистически значимых межгрупповых отличий (табл. 1). Гистохимический анализ продемонстрировал, что у гонадэктомированных самцов концентрация РНК в цитоплазме нейронов слоя II СТД на 12,5% выше, чем у контрольных животных (р<0,05). У подопытных самок, напротив, выявлялось ее снижение в цитоплазме нейронов слоя V неокортекса СТД, по сравнению с контролем, на 14% (р<0,05).
Изучение данных ХМЛ показало однонаправленные изменения характеристик СРО у животных обоего пола - у крыс подопытных групп его показатели достоверно возросли. У самцов интенсивность процессов СРО (Ssp) достоверно увеличилась на 46%, у самок - на 41%. Концентрация гидроперекисей липидов (h) и скорость образования перекисных радикалов (Sind-1) статистически значимо превысили данные показатели в контроле у самцов на 38 и 32%, у самок - на 59 и 35% соответственно.
Амплитуда Н возросла на 43% у самцов и на 72% у самок. Величина Sind-2, характеризующая антиоксидантную антирадикальную защиту, было достоверно выше у животных экспериментальных групп по сравнению с контрольными: у самцов - на 45%, у самок - на 25% (табл. 2).
| Показатель | Самцы | Самки | ||
|---|---|---|---|---|
| опыт (n=9) | контроль (n=7) | опыт (n=8) | контроль (n=7) | |
| Концентрация РНК, усл.ед. ПТД Слой II: - цитоплазмы | 0,61±0.02 | 0,58±0,03 | 0,58±0,02 | 0,59±0,02 |
| Слой V: - цитоплазмы | 0,57±0,024 | 0,57±0,04 | 0,6±0,02 | 0,59±0,015 |
| СТД Слой II: - цитоплазмы | 0,63±0,02* | 0,56±0,02 | 0,58±0,016 | 0,6±0,02 |
| Слой V: - цитоплазмы | 0,59±0,02 | 0,56±0,03 | 0,54±0,02* | 0,63±0,02 |
| Гиппокапм: - цитоплазмы | 0,71±0,02 | 0,63±0,04 | 0,64±0,02 | 0,7±0,03 |
| Хемилюминесценция, усл. ед.: - Ssp | 0,19±0,012* | 0,13±0,004 | 0,17±0,004* | 0,12±0,004 |
| - h | 1,33±0,06* | 0,96±0,05 | 1,39±0,04* | 0,87±0,015 |
| - Sind-1 | 1,68±0,09* | 1,27±0,05 | 1,45±0,043* | 1,07±0,04 |
| - H | 2,64±0,23* | 1,84±0,07 | 3,1±0,18* | 1,8±0,023 |
| - Sind-2 | 5,1±0,33* | 3,5±0,11 | 3,5±0,24* | 2,8±0,053 |
| Концентрация: - тестостерона, нмоль/л | 2,75±0,35* | 17,2±2,6 | - | - |
| - прогестерона, нмоль/л | - | - | 1,06±0,2* | 15,5±4,3 |
Примечание. * - различия с контролем статистически достоверны (р<0,05).
Таким образом, у самцов и самок крыс наблюдалось усиление интенсивности процессов СРО, снижение устойчивости к перекисному окислению и ослабление антиоксидантной антирадикальной защиты. Анализ результатов характеристик поведения крыс в ПКЛ выявил достоверное 8-кратное увеличение времени бездействия у гонадэктомированных самцов в сравнении с контрольной группой (91,9±12,4 против 11,3±8,5 с).
Число свешиваний у них было в 4 раза, стоек - в 5,5 раза, груминга - в 16 раз, движения - в 3 раза, выходов в открытые рукава - в 2,2 раза, заходов в закрытые рукава - в 1,6 раза меньше, чем в контроле (р<0,05). У самок отмечалось лишь достоверное увеличение числа принюхиваний (6±1,3 против 3±0,5). При этом медианы исследовательской активности, как у самцов, так и у самок подопытной группы, были ниже, а уровня тревожности - выше, чем у контрольной группы крыс (рисунок), то есть эти интегральные показатели изменились у животных обоего пола однонаправленно.
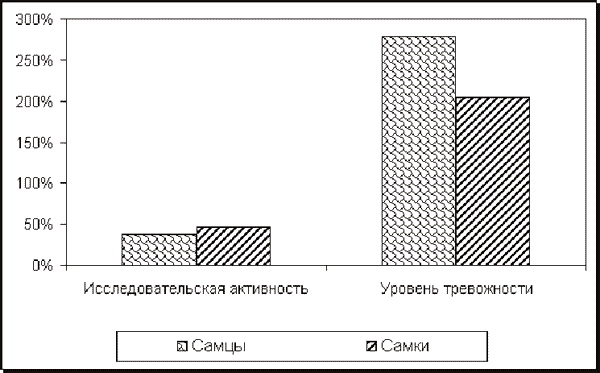
Рис.1. Значения медиан исследовательской активности и уровня тревожности (%), контроль принят за 100% и указан линией
Цитофотометрическое изучение активности ГСДГ показало, что гонадэктомия животных привела к достоверному ее возрастанию в нейронах слоя V неокортекса СТД и гиппокампа крыс обоего пола. У подопытных самцов активность данного фермента в нейронах слоя V неокортекса составила 0,487±0,043 против 0,339±0,039 усл. ед. в контроле. Данный показатель в нейронах гиппокампа у экспериментальных самцов равнялся 0,424±0,02 усл. ед., в контроле - 0,332±0,038 усл. ед. (р<0,05). Интенсивность реакции на ГСДГ у подопытных самок составляла в нейронах слоя V неокортекса и гиппокампа 0,345±0,026 и 0,427±0,016 усл. ед. соответственно против соответственно 0,258±0,021 и 0,369±0,023 усл. ед. в контроле (р<0,05).
| Показатели | Самцы | Самки | ||
|---|---|---|---|---|
| опыт (n=9) | контроль (n=7) | опыт (n=8) | контроль (n=7) | |
| Время бездействия, с | 91,9±12,4* (88,5) | 11,3±8,5 (2,8) | 16,9±8,2 (5,2) | 12,6±10 (1,9) |
| Число свешиваний | 1±0,5* (0) | 4±1,34 (4) | 1,7±0,9 (0) | 3±1,6 (1) |
| - стойки | 0,87±0,23* (1) | 4,8±1,32 (4) | 4,2=0,86 (5) | 5,5±1,9 (4) |
| - груминг | 0,12±0,13* (0) | 2±0,73 (1,5) | 5,7±2,6 (3) | 2,5±1,02 (4) |
| - принюхивание | 2,5±0,65 (2) | 3,3±0,8 (2,5) | 6±1,3* (6) | 3±0,5 (3) |
| - движение | 3,7±0,73* (4) | 11,8±1,25 (11) | 12,4±3,5 (12) | 10,7±3,4 (9) |
| - в открытых рукавах | 1,12±0,4* (1) | 2,5±0,43 (2,5) | 1,7±0,52 (1) | 4,8±2,4 (3) |
| - в закрытых рукавах | 1,87±0.4 (1,5) | 3±0,45 (3) | 2±0,43 (2) | 5,2±2,5 (3) |
| Исследовательская активность | 3,45±1,03* (2,2) | 13,7±2,5 (11,8) | 9,1±2,1 (8,3) | 15,6±6,3 (9,8) |
| - уровень тревожности | 3,7±0,65* (3,7) | 9,1±1,6 (9,3) | 14,2±5,6 (7,9) | 14,3±6,2 (9,3) |
| Интегральный показатель: - исследовательской активности | 2,1±0,76 (1,78) | 4±1,2 (4,7) | 7,5±5,7 (0,6) | 3,6±2,05 (1,3) |
| - уровня тревожности | 203±44,8* (201) | 82±19 (72) | 168±44 (142) | 102±41 (69) |
Примечание. * - различия с контролем статистически достоверны (р<0,05), в скобках - медиана.
Таким образом, в данном разделе работы нами установлено, что при гонадэктомии животных обоего пола наблюдается увеличение синтеза нейростероидов в цитоплазме нейронов изученных локализаций, что подтверждает наше предположение о возможности "нейтрализации" высокой вариабельности концентраций стероидных гормонов в мозге при их значительных изменениях в крови.
Выводы |
 |
 |
Полученные данные свидетельствуют, что гонадэктомия половозрелых крыс обоего пола привела к морфометрическим и гистохимическим изменениям, интенсификации процессов СРО в коре головного мозга и увеличению активности ГСДГ в нейронах слоя V СТД и гиппокампа. Эти изменения могут расцениваться как элементы морфологических и биохимических эквивалентов отклонений поведения подопытных животных. Их выраженность была выше у самцов, что проявлялось наличием у них большего количества достоверных отличий большинства исследованных показателей от контроля.
Литература |
 |
 1. Галкина О.В., Путилина Ф.Е., Романова А.А. и др. Изменение перекисного окисления липидов и антиоксидантной системы головного мозга крыс в ходе раннего постнатального развития // Нейрохимия. - 2009. - Т. 26, №2. - С. 111-116.
1. Галкина О.В., Путилина Ф.Е., Романова А.А. и др. Изменение перекисного окисления липидов и антиоксидантной системы головного мозга крыс в ходе раннего постнатального развития // Нейрохимия. - 2009. - Т. 26, №2. - С. 111-116. 2. Задворная О.В., Лебедько О.А., Рыжавский Б.Я. Влияние введения сустанона-250 самцам и самкам крыс в препубертатном периоде онтогенеза на показатели их развития и свободнорадикальное окисление в коре головного мозга // Дальневост. мед. журнал. - 2010. - №2. - С. 108-111.
2. Задворная О.В., Лебедько О.А., Рыжавский Б.Я. Влияние введения сустанона-250 самцам и самкам крыс в препубертатном периоде онтогенеза на показатели их развития и свободнорадикальное окисление в коре головного мозга // Дальневост. мед. журнал. - 2010. - №2. - С. 108-111. 3. Задворная О.В., Лебедько О.А., Учакина Р.В. и др. Влияние гонадэктомии на морфометрические, биохимические и гистохимические показатели развития коры головного мозга крыс // Дальневост. мед. журнал. - 2010. - №4. - С. 111-114.
3. Задворная О.В., Лебедько О.А., Учакина Р.В. и др. Влияние гонадэктомии на морфометрические, биохимические и гистохимические показатели развития коры головного мозга крыс // Дальневост. мед. журнал. - 2010. - №4. - С. 111-114. 4. Кисели Д. Практическая микротехника и гистохимия. - М.: Медицина, 1965. - 400 с.
4. Кисели Д. Практическая микротехника и гистохимия. - М.: Медицина, 1965. - 400 с. 5. Лойда 3., Госсрау Р., Шиблер Т. Гистохимия ферментов. Лабораторные методы. - М.: Мир, 1982.
5. Лойда 3., Госсрау Р., Шиблер Т. Гистохимия ферментов. Лабораторные методы. - М.: Мир, 1982. 6. Масагутов P.M., Юлдашев В.Л., Урицкий Б.Л. Соотношение уровней тестостерона и кортизола с показателями агрессивности у подростков // Рос. психиатр. журнал. - 2001. - №5. - С. 36-40.
6. Масагутов P.M., Юлдашев В.Л., Урицкий Б.Л. Соотношение уровней тестостерона и кортизола с показателями агрессивности у подростков // Рос. психиатр. журнал. - 2001. - №5. - С. 36-40. 7. Моренков Э.Д., Петрова Л.П. Нейроактивные стероиды и формирование полового диморфизма латеральной организации мозга // Руководство по функциональной межполушарной асимметрии. - М.: Научный мир, 2009. - С. 207-253. 8. Розен В.Б. Основы эндокринологии. - М.: Изд-во
7. Моренков Э.Д., Петрова Л.П. Нейроактивные стероиды и формирование полового диморфизма латеральной организации мозга // Руководство по функциональной межполушарной асимметрии. - М.: Научный мир, 2009. - С. 207-253. 8. Розен В.Б. Основы эндокринологии. - М.: Изд-во 8. Моск. ун-та, 1994.
8. Моск. ун-та, 1994. 9. Рыжавский Б.Я., Лебедько О.А., Белолюбская Д.С. и др. Отдаленные последствия пренатального воздействия свинца на развитие головного мозга // Морфология. - 2007. - Т. 131, №1. - С. 27-31.
9. Рыжавский Б.Я., Лебедько О.А., Белолюбская Д.С. и др. Отдаленные последствия пренатального воздействия свинца на развитие головного мозга // Морфология. - 2007. - Т. 131, №1. - С. 27-31. 10. Сашков В.А., Сельверова Н.Б., Моренков Э.Д. и др. Взаимосвязь уровня нейроактивных стероидов в мозге, поведения и тревожности у созревающих и половозрелых самок крыс в течение астрального цикла // Нейрохимия. - 2009. - Т. 26, №1. - С. 42-50.
10. Сашков В.А., Сельверова Н.Б., Моренков Э.Д. и др. Взаимосвязь уровня нейроактивных стероидов в мозге, поведения и тревожности у созревающих и половозрелых самок крыс в течение астрального цикла // Нейрохимия. - 2009. - Т. 26, №1. - С. 42-50. 11. Светухина В.М. Цитоархитектоника новой коры мозга в отряде грызунов (белая крыса). // Архив анатомии, гистологии и эмбриологии. - 1962. - Т. 42, №2. - С. 31-45.
11. Светухина В.М. Цитоархитектоника новой коры мозга в отряде грызунов (белая крыса). // Архив анатомии, гистологии и эмбриологии. - 1962. - Т. 42, №2. - С. 31-45. 12. De Kloet, E.K. Hormones, Brain and Stress // Endocrine Regulations. - 2003. - Vol. 37. - P. 51.
12. De Kloet, E.K. Hormones, Brain and Stress // Endocrine Regulations. - 2003. - Vol. 37. - P. 51.  13. Backstrom, T. Neuroendocrinology of premenstrual syndrome // Clin. Obstet. Ginecol. - 1994. - Vol. 35. - P. 612.
13. Backstrom, T. Neuroendocrinology of premenstrual syndrome // Clin. Obstet. Ginecol. - 1994. - Vol. 35. - P. 612. 14. Kerr J.E., Beck S.G., Handa R.J. Androgens selectively modulate C-fos messenger RNA indaction in the rat hippocampus following novelty // Neuroscience. - 1996. - Vol. 74, №3. - P. 757-766.
14. Kerr J.E., Beck S.G., Handa R.J. Androgens selectively modulate C-fos messenger RNA indaction in the rat hippocampus following novelty // Neuroscience. - 1996. - Vol. 74, №3. - P. 757-766. 15. Mellon S.H., Griffi n L.D., Synthesis, regulation and function of neurosteroids // Endocr. Res. - 2002. - Vol. 28, №4. - P. 463.
15. Mellon S.H., Griffi n L.D., Synthesis, regulation and function of neurosteroids // Endocr. Res. - 2002. - Vol. 28, №4. - P. 463. 16. Neil J.F., MacLusky I.L., McEwen B. The development of estrogen receptor systems in the rat brain: Perinatal development // Brain Research. - 1979. - Vol. 178, №1. - P. 129-142.
16. Neil J.F., MacLusky I.L., McEwen B. The development of estrogen receptor systems in the rat brain: Perinatal development // Brain Research. - 1979. - Vol. 178, №1. - P. 129-142. 17. Tsutsui K. Neurosteroid biosynthesis and action in the Purkinje cell // Journal of experimental neuroscience. - 2009. - №2. - P. 1-12.
17. Tsutsui K. Neurosteroid biosynthesis and action in the Purkinje cell // Journal of experimental neuroscience. - 2009. - №2. - P. 1-12.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»