2011 год № 4
Теоретическая и экспериментальная медицина
2Хабаровский филиал Дальневосточного научного центра физиологии и патологии дыхания СО РАМН - НИИ охраны материнства и детства, 680022, ул. Воронежская, 49, кор.1, e-mail: iomid@yandex.ru, г. Хабаровск
Резюме:
Ключевые слова:
Summary:
Key words:
Введение |
 |
 |
Широкое внедрение в клиническую практику эндоскопических методов исследования выявило значительную распространенность эрозивно-язвенных поражений верхних отделов пищеварительного тракта [4]. Этиологические факторы, патогенетические механизмы развития и коррекции эрозивно-язвенных поражений желудка сложны, многообразны и не всегда ясны. Нами было проведено комплексное экспериментальное исследование гастропротективного влияния ряда биологически активных веществ на модели эрозивно-язвенного поражения слизистой оболочки желудка, индуцируемого введением нестероидного противовоспалительного препарата (НПВП) - индометацина.
Целью исследования было выявить общие механизмы реализации эффектов гастропротекторов различной природы.
Материалы и методы |
 |
 |
В работе использовали рандомбредных половозрелых мышей-самцов массой 25-35 г. Повреждение слизистой оболочки желудка (СОЖ) моделировали внутрижелудочным введением индометацина в дозе 250 мг/кг ("Балканфарма"). В качестве гастропротективных веществ использовали:
1) даларгин - синтетический аналог лей-энкефалина (Tyr-D-Ala-Gly-Phe-Leu-Arg) и его безаргининовый аналог [ДА Lа]2-лей-энкефалин (Tyr-D-Ala-Gly-Phe-Leu);
2) седатин - синтетический аналог дерморфина (Arg-Tyr-D-Ala-Phe-Gly) и его безаргининовый аналог (Tyr-D-Ala-Phe-Gly).
Пептиды вводили экспериментальным животным в дозе 100 мкг/кг пятикратно ежесуточно внутрибрюшинно.
3) β-казоморфин-7 (Tyr-Pro-Phe-Pro-Gly-Pro-Ile) - экзогенный опиоидный пептид, производное казеина молока, вводили экспериментальным животным в дозе 1 мг/кг пятикратно, ежесуточно внутрибрюшинно.
Исследуемые пептиды были получены в лаборатории синтеза пептидов Российского кардиологического центра РАМН. Через 1 ч после последнего введения пептида животным подопытной группы интрагастрально при помощи зонда вводили индометацин и через 48 ч выводили из эксперимента. Для оценки участия в реализации эффекта системы NO-NOS использовали неселективный ингибитор NOS NG-нитро-L-аргинин метилового эфира (L-NAME; "ICN Biomedicals Inc"), который внутрибрюшинно инъецировали животным в дозе 9,3 10-5 М за 30 мин до введения пептидов.
Площадь эрозивно-язвенного поражения СОЖ измеряли с помощью компьютерной морфометрии на анализаторе изображения "Мекос-Ц" после видеозахвата под бинокулярной лупой (×6). Анализ пролиферативной активности эпителия желудка осуществляли методом авторадиографии, для чего животным за 1 ч до эвтаназии вводили Н3-тимидин из расчета 1 мкКюри на 1 г массы (уд. активность 84 Кюри/моль). Радиоавтографы готовили по принятой в лаборатории методике, использовали фотоэмульсию "Kodak Autoradiography" (Emulsion NTB Product code 8895666). Индекс меченых ядер (ИМЯ) определяли на основании подсчета 2500 эпителиоцитов СОЖ на продольных полнослойных срезах собственных желез желудка.
Для интегральной оценки процессов свободнорадикального окисления использовали метод хемилюминесценции (ХМЛ). Регистрацию ХМЛ осуществляли на люминесцентном спектрометре LS 50В "PERKIN ELMER". Сигнал стандартизировали с помощью встроенной программы Finlab. Спонтанную и индуцированную Fe2+ ХМЛ исследовали по методу [3]. Определяли светосумму за 1 мин спонтанной ХМЛ (Sсп.), максимум быстрой вспышки (h) индуцированной ХМЛ, светосумму (S1 инд.) за 4 мин после "быстрой" вспышки. Кинетику ХМЛ, инициированную Н2О2 в присутствии люминола [1, 10], анализировали по двум параметрам: максимуму быстрой вспышки (Н) и светосумме (S2 инд.) за 4 мин.
Статистическую обработку данных проводили с использованием ППП Statistica 6,0. Всего в экспериментах было использовано 266 животных.
Результаты и обсуждение |
 |
 |
Интрагастральное введение индометацина в дозе 250 мг/кг вызывало выраженное поражение СОЖ. Площадь эрозивно-язвенного поражения СОЖ у подопытных животных достигала 10,92±2,05 мм2. В контрольной группе повреждения отсутствовали. Введение индометацина достоверно снижало ИМЯ эпителия СОЖ (рис. 1). Деструктивное изменение СОЖ сопровождалось формированием выраженного оксидативного стресса. Об этом свидетельствуют данные хемилюминесцентного анализа, регистрирующие значительное повышение интенсивности свободнорадикальных процессов в СОЖ (рис. 2). Предварительное (до воздействия индометацина) 5-кратное введение даларгина существенно изменяло реакцию СОЖ на НПВП. Площадь эрозивно-язвенного поражения СОЖ снизилась до 1,79±0,54 мм2, что достоверно отличалось от показателя группы "индометацин". Введение даларгина полностью нивелировало угнетающее влияние индометацина на пролиферативную активность эпителия желудка (рис. 1) и значительно ослабило проявления оксидативного стресса в СОЖ (рис. 2). Ранее в клинических условиях нами было показано позитивное влияние даларгина на течение эрозивно-язвенной гастропатии, индуцированной применением НПВП [2].
Безаргининовый аналог даларгина не оказывал влияния ни на площадь эрозивно-язвенного поражения СОЖ (6,92±1,25 мм2), ни на пролиферативную активность эпителия (рис. 1). Имело место некоторое угнетающее влияние этого пептида на показатели тканевого оксидативного стресса. Однако антиоксидантный эффект безаргининового пептида был существенно меньше, по сравнению с даларгином (рис. 2).

Рис. 1. ДНК-синтетическая активность слизистой оболочки желудка подопытных животных исследуемых групп (% по отношению к контролю - контрольный параметр принят за 100%). * - р<0,05 по отношению к группе "индометацин"
Положительное влияние на состояние СОЖ при НПВП-гастропатиях имело место при введении другого опиоидного пептида - седатина. Предварительное 5-кратное введение седатина достоверно уменьшало площадь эрозивно-язвенного поражения СОЖ до 4,24±1,12 мм2. НПВП-индуцированное угнетение пролиферативной активности эпителия желудка снизилось с 45 до 17,5% (рис. 1). Хемилюминесцентные корреляты оксидативного стресса также были значительно ниже (рис. 2). Безаргининовый аналог седатина, так же, как и безаргининовый аналог даларгина, не корректировал негативных последствий воздействия индометацина на СОЖ экспериментальных животных.
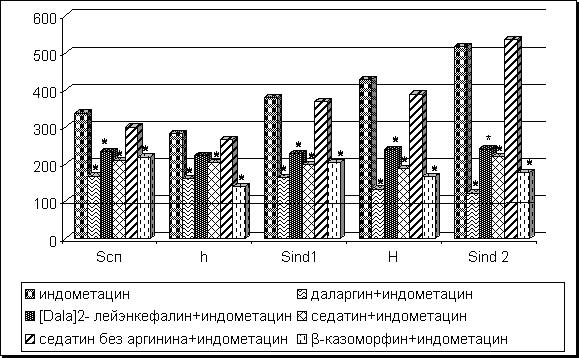
Рис. 2. Хемилюминесцентные показатели процессов свободнорадикального окисления в гомогенатах желудка животных исследуемых групп (% по отношению к контролю - контрольные параметры приняты за 100%). * - р<0,05 по отношению к группе "индометацин"
Таким образом, в представленных выше экспериментах аргининсодержащие опиоидные пептиды проявляли защитное действие в модели НПВП-индуцированной гастропатии, а их безаргининовые аналоги были лишены гастропротективной активности. Это дает основание считать, что в реализации гастропротективного действия аргининсодержащих опиоидных пептидов даларгина и седатина ведущая роль принадлежит присутствию в пептидах остатка молекулы Arg - субстрата для NO-синтаз.
β-казоморфин-7 не содержит в своей структуре аминокислоты Arg, однако так же обладает значительным гастропротективным действием. Предварительное введение β-казоморфина-7 нивелировало повреждающее влияние индометацина на СОЖ: у животных, получавших индометацин на фоне казоморфина, язвенного поражения СОЖ выявлено не было. В группе животных, получавших индометацин на фоне воздействия β-казоморфина-7, не было выявлено отклонений ДНК-синтетической активности эпителия СОЖ от контрольных показателей (рис. 1). Введение β-казоморфина-7 значительно ослабило проявление оксидативного стресса, индуцированного индометацином (рис. 2). Исследуемые хемилюминесцентные показатели хотя не достигали уровня контроля, но были достоверно ниже показателей группы "индометацин". Таким образом, предварительное воздействие β-казоморфина-7 практически нивелировало повреждающее влияние индометацина на СОЖ, эффект сопровождался нормализацией пролиферативной активности эпителия СОЖ и значительным ослаблением оксидативного стресса на тканевом уровне. В целом, эффект β-казоморфина-7 на СОЖ был практически аналогичен эффектам аргининсодержащих пептидов даларгина и седатина. Возможным объяснением гастропротективного действия β-казоморфина-7 служат данные литературы о том, что в ходе метаболизма β-казоморфина-7 образуется Рго-Gly-Pro, обладающий способностью стимулировать NOS, увеличивать кровоток в желудке, оказывать гастропротективное влияние [5, 11].
Для доказательства универсальной роли NOS-NO в реализации гастропротективного эффекта исследуемых опиоидных пептидов нами были проведены опыты с блокадой NOS с помощью L-NAME - неселективного ингибитора NO-синтаз. На фоне блокады образования NOS ни один из исследованных пептидов не реализовывал свое корригирующее действие на тканевой гомеостаз СОЖ по показателям ДНК-синтетической активности эпителия.
Таким образом, можно говорить об участии системы NO-NOS в реализации гастропротективных эффектов регуляторных пептидов при НПВП-индуцированных гастропатиях.
Данные [8] свидетельствуют, что гастропротективное действие морфина осуществляется посредством системы NOS-NO. Система NOS-NO не ограничивается протективным действием опиатов. Через него реализует свое действие широкий класс веществ. Гастропротективный эффект, обусловленный повышением активности eNOS в СОЖ, был описан для пептида грелина [14], орексина-А [7], простагландинов [9], омепразола и других ингибиторов протоновой помпы [12, 13].
Согласно представлениям A.M. Уголева [6], различные функции, в том числе специализированные, складываются из элементарных функций, которые реализуются определенным сочетанием ограниченного числа функциональных блоков. Система NOS-NO может служить одной из иллюстраций универсального функционального блока, принимающего участие в регуляции различных физиологических процессов.
Литература |
 |
 1. Арутюнян А.В., Дубинина Е.Е., Зыбина Н.Н. Методы оценки свободнорадикального окисления и антиоксидантной системы организма: метод. рек. - СПб., 2000. - С. 198.
1. Арутюнян А.В., Дубинина Е.Е., Зыбина Н.Н. Методы оценки свободнорадикального окисления и антиоксидантной системы организма: метод. рек. - СПб., 2000. - С. 198. 2. Болоняева Н.А., Животова Е.Ю., Флейшман М.Ю. и др. // Дальневост. мед. журнал. - 2005. - №2. - С. 28-30.
2. Болоняева Н.А., Животова Е.Ю., Флейшман М.Ю. и др. // Дальневост. мед. журнал. - 2005. - №2. - С. 28-30. 3. Владимиров Ю.А., Азизова О.А., Деев А.И. Свободные радикалы в живых системах // ВИНИТИ АН ССР: Итоги науки и техники. Сер. Биофизика. - М., 1991. - Т. 29. - С. 147.
3. Владимиров Ю.А., Азизова О.А., Деев А.И. Свободные радикалы в живых системах // ВИНИТИ АН ССР: Итоги науки и техники. Сер. Биофизика. - М., 1991. - Т. 29. - С. 147. 4. Маев И.В., Орлов Л.Л., Нефедова Ю.В. Эрозивные поражения слизистой желудка и двенадцатиперстной кишки // Клин. медицина. - 1997. - №6. - С. 57-60.
4. Маев И.В., Орлов Л.Л., Нефедова Ю.В. Эрозивные поражения слизистой желудка и двенадцатиперстной кишки // Клин. медицина. - 1997. - №6. - С. 57-60. 5. Самонина Г.Е., Копылова Г.Н., Сергеев В.И. и др. Коррекция кровотока желудка как один из возможных механизмов противоязвенных эффектов коротких пролинсодержащих пептидов // Рос. физиол. журнал. - 2001. - Т. 87, №11. - С. 1488-1492.
5. Самонина Г.Е., Копылова Г.Н., Сергеев В.И. и др. Коррекция кровотока желудка как один из возможных механизмов противоязвенных эффектов коротких пролинсодержащих пептидов // Рос. физиол. журнал. - 2001. - Т. 87, №11. - С. 1488-1492. 6. Уголев A.M. Функциональная эволюция и гипотеза функциональных блоков // Журнал эволюц. биохимии и физиологии. - 1983. - № 4. - С. 390-399.
6. Уголев A.M. Функциональная эволюция и гипотеза функциональных блоков // Журнал эволюц. биохимии и физиологии. - 1983. - № 4. - С. 390-399. 7. Brzozowski Т., Konturek P.С., Sliwowski Z. et al. Gastroprotective action of orexin-A against stress-induced gastric damage is mediated by endogenous prostaglandins, sensory afferent neuropeptides and nitric oxide // Digestion. - 2007. - Vol. 75(4). - P. 188-197.
7. Brzozowski Т., Konturek P.С., Sliwowski Z. et al. Gastroprotective action of orexin-A against stress-induced gastric damage is mediated by endogenous prostaglandins, sensory afferent neuropeptides and nitric oxide // Digestion. - 2007. - Vol. 75(4). - P. 188-197. 8. Gyires K. The role of endogenous nitric oxide in the gastroprotective action of morphine // Eur. J. Pharmacol. - 1994. - Vol. 255 (1-3). - P. 33-37.
8. Gyires K. The role of endogenous nitric oxide in the gastroprotective action of morphine // Eur. J. Pharmacol. - 1994. - Vol. 255 (1-3). - P. 33-37. 9. Konturek S.J., Brzozowski Т., Majka J. et al. Nitric oxidein gastroprotection by sucralfate, mild irritant, and nocloprost. Role of mucosal blood flow // Dig. Dig. Sci. - 1994. - Vol. 39(3). - P. 593-600.
9. Konturek S.J., Brzozowski Т., Majka J. et al. Nitric oxidein gastroprotection by sucralfate, mild irritant, and nocloprost. Role of mucosal blood flow // Dig. Dig. Sci. - 1994. - Vol. 39(3). - P. 593-600. 10. Kuzmenko A.I. Characterization of H2O2 - initiated oxidation of blood serum lipids by kinetic parameters // West. Med. J. - 1999. - Vol. 71, №4. - P. 63-66.
10. Kuzmenko A.I. Characterization of H2O2 - initiated oxidation of blood serum lipids by kinetic parameters // West. Med. J. - 1999. - Vol. 71, №4. - P. 63-66. 11. Lameu C., Pontieri V., Guerreiro J.R. et al. Brain nitric oxide production by a proline-rich decapeptide from Bothrops jararaca venom improves baroreflex sensitivity of spontaneously hypertensive rats // Hypertens Res. - 2010. - Vol. 33(12). - P. 1283-1288
11. Lameu C., Pontieri V., Guerreiro J.R. et al. Brain nitric oxide production by a proline-rich decapeptide from Bothrops jararaca venom improves baroreflex sensitivity of spontaneously hypertensive rats // Hypertens Res. - 2010. - Vol. 33(12). - P. 1283-1288 12. Le Q. L. Zang J., Xu Q.Z., Gao H. Y. Role of nitric oxide in omeprazole protection of the gastric mucosa in rat // Di Yi Jim Yi Da Xue Xue Bao. - 2001. - Vol. 21(12). - Р. 926-928.
12. Le Q. L. Zang J., Xu Q.Z., Gao H. Y. Role of nitric oxide in omeprazole protection of the gastric mucosa in rat // Di Yi Jim Yi Da Xue Xue Bao. - 2001. - Vol. 21(12). - Р. 926-928. 13. Murakami I., Satoh H., Asano S., Maeda R. Role of capsaicin-sensitive sensory neurons and nitric oxide in the protective effect of lansoprazole, a proton pump inhibitor, on gastric mucosa in rats // Jpn. J. Pharmacol. - 1996. - Vol. 72(2). - Р. 137-147.
13. Murakami I., Satoh H., Asano S., Maeda R. Role of capsaicin-sensitive sensory neurons and nitric oxide in the protective effect of lansoprazole, a proton pump inhibitor, on gastric mucosa in rats // Jpn. J. Pharmacol. - 1996. - Vol. 72(2). - Р. 137-147.  14. Sibilia V., Pagani F., Rindi G. et al. Central ghrelin gastroprotection involves nitric oxide/prostaglandin cross-talk // Br J Pharmacol. - 2008. - Vol. 154(3). - P. 688-697.
14. Sibilia V., Pagani F., Rindi G. et al. Central ghrelin gastroprotection involves nitric oxide/prostaglandin cross-talk // Br J Pharmacol. - 2008. - Vol. 154(3). - P. 688-697.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»