2013 год № 4
Обзоры литературы
2Федеральный центр сердечно-сосудистой хирургии, 680009, ул. Краснодарская, 2в, тел. 8-(4212)-78-06-01, г. Хабаровск
Резюме:
Ключевые слова:
2Federal Center of Cardiovascular Surgery, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Субаортальный стеноз (СубСт) является относительно редким врожденным пороком и составляет до 1 % всех врожденных аномалий [1]. Частота сочетания с другими ВПС составляет до 71 %, среди которых наиболее часто встречаются дефект межжелудочковой перегородки (ДМЖП), коарктация аорты (КоАо), атрио-вентрикулярная коммуникация (АВК), клапанный аортальный стеноз (АоСт), открытый артериальный проток (ОАП) [3, 10]. Так же часто встречается патология митрального клапана, что играет роль в патофизиологии обструкции у некоторых пациентов [4]. Спектр данной патологии распространяется от дискретной фиброзной мембраны до тоннельной обструкции [3, 15].
Обсуждение |
 |
 |
Этиология и патогенез. Хотя данную патологию и рассматривают в структуре врожденных пороков сердца, в последнее время некоторые авторы СубСт относят к приобретенной патологии с врожденной предрасположенностью [9, 11]. В пользу приобретенного характера заболевания они указывают следующие факты: изолированный порок крайне редко выявляется в периоде новорожденности, редко обнаруживается на вскрытии в неонатальных и фетальных сердцах [9].
Существует несколько теорий развития дискретного СубСт: теория турбулентности, геометрическая теория, теория механического воздействия и генетической предрасположенности [11]. Все они не противоречат друг другу, и суть их сводится к тому, что в результате воздействия турбулентного потока на выводной отдел левого желудочка (ВОЛЖ) в этой области возникает пролиферативный клеточный ответ с развитием подклапанной обструкции. Среди основных причин возникновения турбулентности авторы приводят следующие: аномально расположенные желудочковые трабекулы, которые достигают ВОЛЖ; смещение межжелудочковой перегородки в сторону выводного тракта ЛЖ; увеличение митрально-аортального контакта; уменьшение аорто-септального угла [9, 11].
Классификация. Ранее чаще всего использовали классификацию порока, разработанную Kelly D.T. c коллегами в 1972 г., в которой описано три анатомических варианта СубСт. ВОЛЖ может быть сужен за счет фиброзной мембраны (мембранозный тип), фиброзно-мышечного ворота (валикообразный тип) и фиброзно-мышечного "тоннеля" (тоннельный тип) [15].
В последнее время в зарубежной литературе используют классификацию, предложенную Choi и Sullivan в 1991 г. Она основана на морфологических особенностях, которые могут быть определены при эхокардиографическом исследовании. Авторы выделили 4 типа СубСт: короткий сегмент обструкции (дискретный стеноз, протяженность обструкции менее 1/3 диаметра аортального клапана); длинный сегмент обструкции (протяженность обструкции более 1/3 диаметра аортального клапана); СубСт в результате смещения септальных структур с наличием ДМЖП; СубСт в результате наличия ткани атриовентрикулярного клапана в ВОЛЖ [10].
Дискретная форма наиболее часто встречающаяся, составляет от 70 до 90 % подклапанных обструкций и характеризуется наличием фиброзной или фибромышечной мембраны, расположенной в ВОЛЖ между передней створкой митрального клапана и створками аортального клапана [7, 13, 22]. "Тоннельный" стеноз наиболее редкая и самая тяжелая из подклапанных обструкций. Частота встречаемости - от 2 до 10 %. Анатомическим субстратом является протяженное, циркулярное фиброзно-мышечное сужение ВОЛЖ, часто сочетается с гипоплазией фиброзного кольца и стенозом аортального клапана [25]. Данный вариант трудно дифференцируется с гипертрофической кардиомиопатией. Последняя определяется как гипертрофия ЛЖ с маленькой полостью при отсутствии любого увеличения постнагрузки [14]. Приблизительно у 25 % пациентов с диагнозом гипертрофическая кардиомиопатия встречается обструкция ВОЛЖ [17].
Также субаортальная обструкция может быть функциональной и вызвана различной степенью переднесистолического движения передней створки митрального клапана. Органическая обструкция может возникать при креплении хорд передней створки митрального клапана к межжелудочковой перегородке, может быть осложнением после первичных процедур при коррекции других ВПС (двойное отхождение магистральных сосудов, полная форма АВК и др.) [4, 5].
СубСт входит в состав некоторых комплексных ВПС, нуждающихся в хирургическом лечении (например, синдрома Шона), существенно усложняет хирургическую технику, влияет на тактику лечения и его результаты [25].
Естественное течение. Течение СубСт часто является прогрессивным. Некорригированный порок протекает с увеличением обструкции ВОЛЖ, прогрессивным повреждением аортального клапана, желудочковой дисфункцией и внезапной сердечной смертью [19]. Доминантным клиническим признаком может быть либо обструкция ВОЛЖ, либо аортальная регургитация, которая бывает более чем в 50 % случаев [1].
Выявлена связь между степенью обструкции и аортальной регургитацией. Если пиковый градиент давления (ГрД) достигает 50 мм рт. ст. и более, то увеличивается риск возникновения умеренной или выраженной аортальной регургитации [14]. Аортальная регургитация усиливает объемную перегрузку ЛЖ и предрасполагает к поражению миокарда. Аортальный клапан повреждается турбулентным током крови, возникающим при прохождении через место сужения во время систолы [11]. Распространение обструктивной фиброзной ткани на клапан может также привести к утолщению и искажению створок аортального клапана. Аортальная регургитация редко бывает выраженной у детей [14].
Диагностика. Наиболее информативный метод диагностики СубСт является эхокардиография (ЭхоКГ) с допплеровской оценкой кровотока [4, 6]. С помощью двухмерной ЭхоКГ определяют тип подклапанного сужения, его позицию, протяженность и взаимосвязь с окружающими структурами. При определении геометрии ВОЛЖ определяют следующие эхокардиографические показатели: митрально-аортальное расстояние от точки крепления некоронарной створки аортального клапана до точки крепления передней створки митрального клапана; диаметр отверстия аортального клапана; аорто-септальный угол, сформированный длинной осью восходящей аорты и продольной осью межжелудочковой перегородки; степень декстрапозиции аортального клапана; ширину ВОЛЖ в месте обструкции в систолу; толщину стенок ЛЖ и др. [6, 11, 12].
Непрерывноволновая допплерография используется для определения величины градиента обструкции ВОЛЖ из пятикамерной верхушечной позиции. Выявлена высокая корреляция пикового ГрД, определенного при допплерографии и ГрД, рассчитанного при катетеризации. Допплерография не позволяет точно определить величину обструкции при множественном сужении выходного тракта, тоннельном сужении и при большом ДМЖП. Цветовой допплер демонстрирует наличие и тяжесть сужения ВОЛЖ, аортальную и митральную регургитацию [4].
Хирургическое лечение. Основными критериями при выборе тактики лечения по-прежнему остаются величина ГрД на уровне обструкции и выраженность аортальной регургитации. Американской коллегией кардиологов и Американской сердечной ассоциацией (2008 г.) рекомендовано хирургическое лечение СубСт при пиковом ГрД выше 50 мм рт. ст. или среднем ГрД выше 30 мм рт. ст.; при пиковом ГрД менее 50 мм или среднем ГрД менее 30 мм рт. ст., при наличии аортальной регургитации, конечном систолическом размере ЛЖ более 50 мм или фракции выброса ЛЖ менее 55 % (класс I) [5].
Тактика при наличии аортальной недостаточности не однозначна. Одни авторы рекомендуют раннее хирургическое вмешательство при появлении аортальной регургитации и её увеличении [16], другие исследователи после изучения отдаленных результатов хирургического лечения СубСт не выявили достоверного уменьшения степени аортальной недостаточности [7], а по данным J.Oliver с коллегами отмечалось ее увеличение [19]. На тактику лечения влияет наличие сопутствующих сердечных аномалий. Например, при сопутствующем ДМЖП хирургическая коррекция потребуется в более раннем возрасте и при меньшем ГрД [14].
Спектр оперативных вмешательств при СубСт разнообразен в зависимости от вида обструкции и сопутствующих аномалий. Впервые о хирургическом лечении субаортальной мембраны с использованием закрытой трансвентрикулярной дилатации в 1956 г. сообщил Brock [8]. После этого Spencer c коллегами в 1958 г. устранили СубСт с использованием сердечно-лёгочного обхода и в 1960 г. описали хирургическое лечение диффузного тоннельного стеноза [24].
При коротком сегменте СубСт чаще всего выполняется трансаортальное иссечение фиброзной мембраны. При резекции ткани, вызывающей субаортальную обструкцию, с осторожностью манипулируют в "опасной" зоне межжелудочковой перегородки, ограниченной проекцией крепления 1/3 некоронарной, 2/3 правой коронарной створки и комиссурой между ними (рисунок). В этой области проходит пучок Гисса и делится на правую и левую ножки, существует риск развития полной поперечной атриовентрикулярной блокады при повреждении проводящих путей [18].
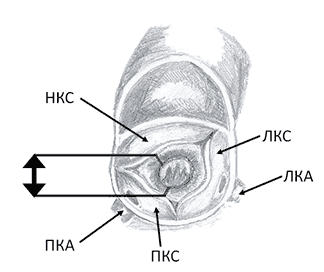
"Опасная" зона при хирургическом устранении дискретного субаортального стеноза, ограниченная проекцией крепления 1/3 некоронарной, 2/3 правой коронарной створки и комиссурой между ними (указана жирной стрелкой).
НКС - некоронарная створка, ПКС - правая коронарная створка, ЛКС - левая коронарная створка,
ПКА - правая коронарная артерия, ЛКА - левая коронарная артерия
По данным разных авторов отдаленная летальность при хирургическом устранении субаортальной обструкции близка к нолю [4, 22]. Однако рестеноз ВОЛЖ в последующем может встречаться с частотой до 55 % [12, 20]. Высокая частота возникновения рецидива стеноза привела к развитию гипотезы динамической обструкции пути, поэтому стали дополнительно выполнять ограниченную или обширную миотомию и миэктомию [16]. Ранее Morrow и соавторами (1964 г.) была описана техника чрезаортальной миотомии при гипертрофической кардиомиопатии, заключавшаяся в щадящем рассечении межжелудочковой перегородки [17]. Миэктомия МЖП проводится в проекции комиссуры между коронарными створками, при этом высекается эндокард с миокардом треугольной формы. Многие авторы рекомендуют ее выполнять при всех дискретных стенозах, что, по их мнению, снижает частоту рецидива за счет ремоделирования ВОЛЖ и восстановления геометрии ЛЖ [16, 19, 20]. Parry A.J. и van Son J.A. с коллегами в своих работах при сравнении хирургического лечения дискретных СубСт, кроме уменьшения частоты развития рестеноза, выявили снижение риска развития аортальной регургитации в группе пациентов, которым изолированная резекция субаортальной мембраны дополнялась агрессивной миэктомией межжелудочковой перегородки [20, 25].
Однако в некоторых исследованиях не выявлено существенных различий ближайших и отдаленных результатов хирургического лечения дискретных СубСт в группах с проведенной миэктомией и без таковой [12, 13, 23]. Geva A. с соавторами отмечает большую частоту реопераций по поводу рестеноза ВОЛЖ в первой группе [12]. Возникновение резидуального стеноза эти исследователи связывают не с примененной хирургической техникой, а с наличием дополнительной обструкции пути оттока ЛЖ (КоАо, синдром Шона) и других врожденных сердечно-сосудистых аномалий.
Модифицированная процедура Конно-Растана обеспечивает расширение ВОЛЖ с сохранением нативного клапана. Данная операция может выполняться у пациентов с СубСт, если при обычной резекции с дополнительной миэктомией сохраняется ГрД более 20-30 мм рт.ст., что в последующем будет требовать повторной операции. Техника операции заключается в чрезвентрикулярном (через правый желудочек) расширении межжелудочковой перегородки заплатой из биологического или синтетического материала, после чего расширяется выводной отдел правого желудочка [21].
К наиболее частым осложнениям при операциях по устранению дискретного субаортального стеноза относят травму проводящих путей, ятрогенный ДМЖП, бакэндокардит [3, 12].
Выводы
|
 |
 |
Дискретный субаортальный стеноз достаточно редкий ВПС, что осложняет изучение и оценку хирургического лечения данной аномалии. В настоящее время, хотя и приняты показания к хирургическому лечению, до сих пор есть сторонники хирургического вмешательства на более ранних этапах формирования дискретного субаортального стеноза. Среди исследователей нет однозначного мнения по поводу проведения дополнительной миэктомии в области межжелудочковой перегородки при устранении субаортальной обструкции, что связано с небольшим количеством наблюдений и частым сочетанием с другими ВПС.
Литература |
 |
 1. Белозеров Ю.М. Детская кардиология. - М: "МЕДпресс-информ", 2004. - С. 144-147.
1. Белозеров Ю.М. Детская кардиология. - М: "МЕДпресс-информ", 2004. - С. 144-147. 2. Бондарев Ю.И., Скопин И.И., Бондаренко И.Э., Макушин А.А. Тактика хирургического лечения подклапанного стеноза аорты // Грудная и сердечно-сосудистая хирургия. - 2000, № 1. - С. 23-28.
2. Бондарев Ю.И., Скопин И.И., Бондаренко И.Э., Макушин А.А. Тактика хирургического лечения подклапанного стеноза аорты // Грудная и сердечно-сосудистая хирургия. - 2000, № 1. - С. 23-28.  3. Караськов А.М., Железнев С.И., Стенин В.Г., Синельников Ю.С., Щукин В.С., Кудашева Н.А., Сурмамва А.Е., Казаков Н.А. Хирургическая тактика при врожденных предклапанных стенозах аорты // Патология кровообращения и кардиохирургия. - 2003, № 1. - С. 22-26.
3. Караськов А.М., Железнев С.И., Стенин В.Г., Синельников Ю.С., Щукин В.С., Кудашева Н.А., Сурмамва А.Е., Казаков Н.А. Хирургическая тактика при врожденных предклапанных стенозах аорты // Патология кровообращения и кардиохирургия. - 2003, № 1. - С. 22-26. 4. Митина Е.Н., Бондарев Ю.И., Данилов Е.Ю., Каграманов И.И. Ультразвуковая диагностика врожденных обструкций выводного тракта левого желудочка при определении показаний к коррекции порока // Грудная и сердечно-сосудистая хирургия. - 1995, № 4. -С. 47-52.
4. Митина Е.Н., Бондарев Ю.И., Данилов Е.Ю., Каграманов И.И. Ультразвуковая диагностика врожденных обструкций выводного тракта левого желудочка при определении показаний к коррекции порока // Грудная и сердечно-сосудистая хирургия. - 1995, № 4. -С. 47-52. 5. ACC/AHA 2008 Guidelines for the Management of Adults With Congenital Heart Disease. -P. 761-763.
5. ACC/AHA 2008 Guidelines for the Management of Adults With Congenital Heart Disease. -P. 761-763. 6. Barkhordarian R., Wen-Hong D., Li W., Josen M., Henein M., Ho S.Y. Geometry of the left ventricular outflow tract in fixed subaortic stenosis and intact ventricular septum: an echocardiographic study in children and adults // Journal of Thoracic and Cardiovascular Surgery. - 2007. - Vol. 133. - P. 196-203.
6. Barkhordarian R., Wen-Hong D., Li W., Josen M., Henein M., Ho S.Y. Geometry of the left ventricular outflow tract in fixed subaortic stenosis and intact ventricular septum: an echocardiographic study in children and adults // Journal of Thoracic and Cardiovascular Surgery. - 2007. - Vol. 133. - P. 196-203. 7. Brauner R., Laks H., Drinkwater D.C., Shvarts О., Eghbali K., Galindo A. Benefits of early repair of fixed subaortic stenosis // Journal of the American College of Cardiology. - 1997. - Vol. 30. - P. 1835-1842.
7. Brauner R., Laks H., Drinkwater D.C., Shvarts О., Eghbali K., Galindo A. Benefits of early repair of fixed subaortic stenosis // Journal of the American College of Cardiology. - 1997. - Vol. 30. - P. 1835-1842. 8. Brock R. Aortic subvalvar stenosis. A report of 5 cases diagnosed during life // Guy's Hospital Reports. - 1956. - Vol. 30. - Р. 3491.
8. Brock R. Aortic subvalvar stenosis. A report of 5 cases diagnosed during life // Guy's Hospital Reports. - 1956. - Vol. 30. - Р. 3491. 9. Cape E.G., Vanauker M.D., Gunnlaugur S., et al.Potential role of mechanical stress in the etiology of pediatric heart disease // Journal of the American College of Cardiology. - 1997. - Vol. 30. - P. 247-254.
9. Cape E.G., Vanauker M.D., Gunnlaugur S., et al.Potential role of mechanical stress in the etiology of pediatric heart disease // Journal of the American College of Cardiology. - 1997. - Vol. 30. - P. 247-254. 10. Choi J.Y., Sullivan I.D. Fixed subaortic stenosis: anatomical spectrum and nature of progression // British Heart Journal. - 1991. - Vol. 65. - P. 280-286.
10. Choi J.Y., Sullivan I.D. Fixed subaortic stenosis: anatomical spectrum and nature of progression // British Heart Journal. - 1991. - Vol. 65. - P. 280-286.  11. Cilliers A.M., Gewillig M. Rheology of discrete subaortic stenosis // Heart. - 2002, October. - Vol. 88(4). - P. 335-336.
11. Cilliers A.M., Gewillig M. Rheology of discrete subaortic stenosis // Heart. - 2002, October. - Vol. 88(4). - P. 335-336. 12. Geva A., McMahon C.J., Gauvreau K., Mohammed L. Risk factors for reoperation after repair of discrete subaortic stenosis in children // Journal of the American College of Cardiology. - 2007. - Vol. 15. - P. 1498-1504.
12. Geva A., McMahon C.J., Gauvreau K., Mohammed L. Risk factors for reoperation after repair of discrete subaortic stenosis in children // Journal of the American College of Cardiology. - 2007. - Vol. 15. - P. 1498-1504. 13. Hirata Y., Chen J.М, Quaegebeur J.M., Mosca R.S. The role of enucleation with or without septal myectomy for discrete subaortic stenosis // The Journal of Thoracic and Cardiovascular Surgery. - 2009. - Vol. 5. - P. 1168-1172.
13. Hirata Y., Chen J.М, Quaegebeur J.M., Mosca R.S. The role of enucleation with or without septal myectomy for discrete subaortic stenosis // The Journal of Thoracic and Cardiovascular Surgery. - 2009. - Vol. 5. - P. 1168-1172. 14. Jonas R.A. Comprehensive surgical management of congenital heart disease. - London : AHNOLD, 2004. -P. 675.
14. Jonas R.A. Comprehensive surgical management of congenital heart disease. - London : AHNOLD, 2004. -P. 675. 15. Kelly D.T., Wulfsberg E., Rowe R.D. Discrete subaortic stenosis // Circulation. -1972. -Vol. 46. -P. 309-322.
15. Kelly D.T., Wulfsberg E., Rowe R.D. Discrete subaortic stenosis // Circulation. -1972. -Vol. 46. -P. 309-322. 16. Lupinetti F.M., Pridjian A.K. , Callow L.B., Crowley D.C., Beekman R.H., Bove E.L. Optimum treatment of discrete subaortic stenosis // The Annals of Thoracic Surgery. - 1992. - Vol. 54. - P. 467-471.
16. Lupinetti F.M., Pridjian A.K. , Callow L.B., Crowley D.C., Beekman R.H., Bove E.L. Optimum treatment of discrete subaortic stenosis // The Annals of Thoracic Surgery. - 1992. - Vol. 54. - P. 467-471. 17. Morrow A.G., Lambrew C.T., Braunwald E. Idiopatic hypertrophic subaortic stenosis. - New York. - 1964. - P. 120-151.
17. Morrow A.G., Lambrew C.T., Braunwald E. Idiopatic hypertrophic subaortic stenosis. - New York. - 1964. - P. 120-151. 18. Ohye R.G., Devaney E.J., Bove E.L. Resection of discrete subaortic membranes // Operative Techniques in Thoracic and Cardiovascular Surgery. - 2002. - Vol. 7. - P. 172-175.
18. Ohye R.G., Devaney E.J., Bove E.L. Resection of discrete subaortic membranes // Operative Techniques in Thoracic and Cardiovascular Surgery. - 2002. - Vol. 7. - P. 172-175. 19. Oliver J.M., Gonzalez A., Gallego P., Sanchez-Recalde A., Benito F., Mesa J.M. Discrete subaortic stenosis in adults: increased prevalence and slow rate of progression of the obstruction and aortic regurgitation // Journal of the American College of Cardiology. - 2001. - Vol. 38. - P. 835-842.
19. Oliver J.M., Gonzalez A., Gallego P., Sanchez-Recalde A., Benito F., Mesa J.M. Discrete subaortic stenosis in adults: increased prevalence and slow rate of progression of the obstruction and aortic regurgitation // Journal of the American College of Cardiology. - 2001. - Vol. 38. - P. 835-842. 20. Parry A.J., Kovalchin J.P., Suda K., McElhinney D.B., Wudel J., Silverman N.H., Reddy V.M., Hanley F.L. Resection of subaortic stenosis: can a more aggressive approach be justified? // European Journal of Cardio-thoracic Surgery. - 1999. - Vol. 15. - P. 631-638.
20. Parry A.J., Kovalchin J.P., Suda K., McElhinney D.B., Wudel J., Silverman N.H., Reddy V.M., Hanley F.L. Resection of subaortic stenosis: can a more aggressive approach be justified? // European Journal of Cardio-thoracic Surgery. - 1999. - Vol. 15. - P. 631-638. 21. Roughneen P.T., DeLeon S.Y., Cetta F., Vitullo D.A., Bell T.J., Fisher E.A., Blakeman B.P., Bakhos M. Modified Konno-Rastan procedure for subaortic stenosis: indications, operative techniques, and results // The Annals of Thoracic Surgery. - 1998. - Vol. 65. - P. 1368-1376.
21. Roughneen P.T., DeLeon S.Y., Cetta F., Vitullo D.A., Bell T.J., Fisher E.A., Blakeman B.P., Bakhos M. Modified Konno-Rastan procedure for subaortic stenosis: indications, operative techniques, and results // The Annals of Thoracic Surgery. - 1998. - Vol. 65. - P. 1368-1376. 22. Ruzmetov M., Vijay P., Rodefeld M.D., Turrentine M.W., Brown J.W. Long-term results of surgical repair in patients with congenital subaortic stenosis // Interactive CardioVascular and Thoracic Surgery. - 2006, № 5. - P. 227-233.
22. Ruzmetov M., Vijay P., Rodefeld M.D., Turrentine M.W., Brown J.W. Long-term results of surgical repair in patients with congenital subaortic stenosis // Interactive CardioVascular and Thoracic Surgery. - 2006, № 5. - P. 227-233. 23. Serraf A. , Zoghby J., Lacour-Gayet F., Houel R., Belli E., Galletti L., Planch? C. Surgical treatment of subaortic stenosis: a seventeen-year experience // The Journal of Thoracic and Cardiovascular Surgery. - 1999. - Vol. 117. - P. 669-678.
23. Serraf A. , Zoghby J., Lacour-Gayet F., Houel R., Belli E., Galletti L., Planch? C. Surgical treatment of subaortic stenosis: a seventeen-year experience // The Journal of Thoracic and Cardiovascular Surgery. - 1999. - Vol. 117. - P. 669-678. 24. Spencer F.C., Neill C.A., Sank L., et al. Anatomical variations in 46 patients with congenital aortic stenosis // The American Journal of Surgery. - 1960, № 26. - Р. 204.
24. Spencer F.C., Neill C.A., Sank L., et al. Anatomical variations in 46 patients with congenital aortic stenosis // The American Journal of Surgery. - 1960, № 26. - Р. 204. 25. Van Son J.A., Schaff H.V., Danielson G.K., Hиagler D.J., Puga F.J. Surgical treatment of discrete and tunnel subaortic stenosis: late survival and risk of reoperation // Circulation. -1993. - Vol. 88, part 2. - P. 159-169.
25. Van Son J.A., Schaff H.V., Danielson G.K., Hиagler D.J., Puga F.J. Surgical treatment of discrete and tunnel subaortic stenosis: late survival and risk of reoperation // Circulation. -1993. - Vol. 88, part 2. - P. 159-169.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»