2014 год № 2
Теоретическая и экспериментальная медицина
2Хабаровский филиал ФГБУ "Дальневосточный научный центр физиологии и патологии дыхания" СО РАМН - НИИ охраны материнства и детства,680022, ул. Воронежская, 49, корп. 1, e-mail: iomid@yandex.ru, г. Хабаровск
Резюме:
Ключевые слова:
2Khabarovsk Facility of FSBI FSC PPR SB RAMS - Scientific research institute of Mother and Child Care, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Одним из тяжелых и распространенных заболеваний новорожденных является синдром дыхательных расстройств (респираторный дистресс-синдром). Он включает в себя патологические изменения в легких, возникающие у детей первых двух суток жизни, нередко заканчивается летальным исходом или приводит к развитию бронхолегочной дисплазии. Важнейшими факторами риска развития синдрома являются незрелость органа, обусловленная недоношенностью, а также применение искусственной вентиляции легких (ИВЛ) [1, 2, 3, 4, 8, 9, 11, 12]. Следует отметить, что не только анатомическая, но и биохимическая незрелость легочных структур создают предпосылки для повреждающего действия кислорода при ИВЛ. Прежде всего, это касается сниженного уровня высоко- и низкомолекулярных антиоксидантов, на фоне которого развивается оксидативный стресс, сопровождающийся повреждением различных молекулярно-клеточных структур [14] . Одним из существенных механизмов, определяющих тяжесть последствий синдрома дыхательных расстройств, является формирование гиалиновых мембран (ГМ), которые нарушают функционирование аэрогематического барьера и являются важным патогенетическим фактором дальнейшего развития бронхолегочной дисплазии. Согласно [12] ГМ являются компонентом преморбидных изменений при данной патологии. Они образуются из белков плазмы крови, компонентов сурфактанта, включают в себя некротизированные альвеолоциты, в них могут встречаться клетки амниотической жидкости. ГМ обнаружены в легких 47 % умерших новорожденных с экстремально низкой массой тела. Структура ГМ разнообразна. Они могут иметь "типичное" строение и выстилать расширенные альвеолы или быть "обтурирующими", закрывающими просвет нефункционирующих альвеол, полностью заполняющими мелкие альвеолы. ГМ могут быть гомогенными, имеющими прерывистый вид, слоистыми, комковатыми [1]. У новорожденных, проживших 49-72 часа ГМ имеют фрагментарный характер, у проживших 97-120 и более часов редкие фрагментированные мембраны обнаруживаются в мелких и средних альвеолах [2]. Данные литературы позволяют считать, что ГМ являются маркером и важным патогенетическим фактором поражения легких, способного приводить к тяжелым последствиям в неонатальном периоде онтогенеза, а также к нарушениям последующего развития органа.
Вышеизложенное обосновывает целесообразность разработки экспериментальных моделей болезни ГМ. Настоящая работа посвящена оценке возможности формирования ГМ в легких посредством введения новорожденным животным (крысам) блеомицина. Основанием для этого послужили факты, свидетельствующие о способности данного противоопухолевого антибиотика повреждать легочную ткань, в частности, альвеолоциты, а также приводить в последующем к бронхолегочной дисплазии, пневмофиброзу [5, 10, 13, 15].
Цель исследования - изучение влияния введения блеомицина новорожденным крысам на структуру и свободнорадикальный статус легких животных по достижении ими возраста 14 суток.
Материалы и методы
|
 |
 |
Эксперимент поставлен на 12 крысятах, которым в возрасте 1, 2 и 3 суток интраперитонеально введен блеомицин (1 мг/кг). Животных забивали декапитацией, легкие фиксировали в жидкости Карнуа, заливали в парафин. Срезы толщиной 7 мкм окрашивали гематоксилином и эозином. Контролем служили интактные животные (12).
Свободнорадикальный статус легких оценивали методом хемилюминесценции (ХМЛ). Регистрацию ХМЛ в гомогенатах легких осуществляли по методикам, описанным ранее [7]. Определяли: Ssp - интенсивность генерации свободных радикалов; h - содержание гидроперекисей липидов; Sind-1 - скорость образования перекисных радикалов; Sluc - генерацию супероксиданион радикала; H и Sind-2 - показатели, величины которых обратно коррелируют с перекисной резистентностью и активностью антиоксидантной антирадикальной защиты, сооветственно. Интенсивность ХМЛ, измеренную в милливольтах, рассчитывали на 1 г влажной ткани, взятой во время забоя животных, и выражали в относительных единицах. Статистическую обработку результатов проводили с помощью t критерия Стьюдента в программе "Statistica 6.0" . Различия между группами считали достоверными при p<0,05.
Результаты и обсуждение
|
 |
 |
Примененная доза блеомицина оказала выраженное общетоксическое действие, привела к гибели 4 из 12 крысят (33,3 %). Изучение легких выявило, что введение блеомицина привело к образованию ГМ, количество которых варьировало в легких разных животных. В альвеолах выявлялись оксифильно окрашенные ГМ. Большая часть ГМ имела гомогенную структуру и прилежала к стенкам альвеол. Реже они были хлопьевидными. Кроме того, ГМ обнаруживались также в просветах некоторых бронхов, при этом контактировали с их выстилкой (рис. 1-3).
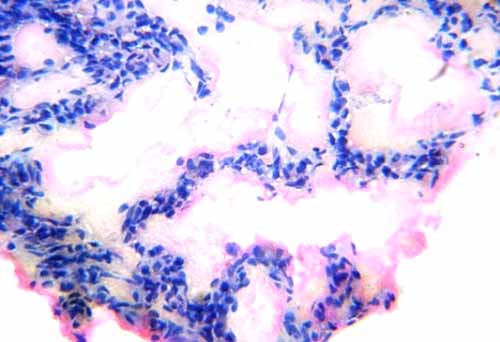
Рис. 1. Гиалиновые мембраны в альвеолах. Окраска гематоксилином и эозином. Увеличение 10×40
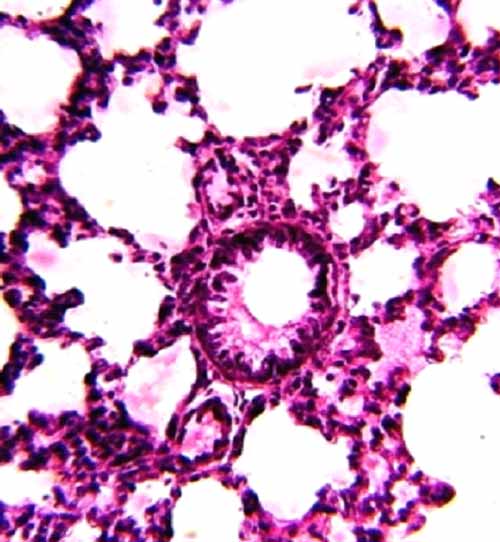
Рис. 2. Гиалиновые мембраны в альвеолах и мелком бронхе. Окраска гематоксилином и эозином. Увеличение 10×40
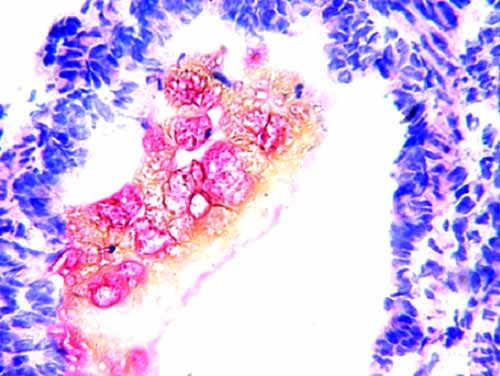
Рис. 3. Гиалиновые мембраны в просвете мелкого бронха. Окраска гематоксилином и эозином. Увеличение 10×40
Данные литературы свидетельствуют, что деградация ГМ происходит в течение нескольких суток после их образования [2]. Учитывая, что повреждающее действие блеомицина продолжается довольно длительно [5, 10], можно предполагать, что выявление ГМ в легких подопытных крысят через 10 суток после последнего введения препарата, обусловлено как продолжающимся повреждением альвеолоцитов препаратом, так и неполным распадом ГМ, образовавшихся непосредственно после введения блеомицина.
Изучение гистологических препаратов выявило также утолщение межальвеолярных перегородок, очаги ателектазов. В других участках срезов легких наблюдались растяжение альвеол, альвеолярных ходов, обнаруживались резко увеличенные альвеолы с истонченными стенками. При этом можно отметить, что подобные различия характера изменений альвеол описаны в легких детей при разных формах бронхолегочной дисплазии: "классической" и "новой", отличающихся разной продолжительностью болезни и проводившимся лечением [6]. Одной из структур, выявлявшихся в легких подопытных крыс, были микрокисты, образованные из расширенных альвеол и альвеолярных ходов. Они имели неправильную форму, некоторые были заполнены оксифильным содержимым, а на их стенках обнаруживались ГМ (рис. 4).
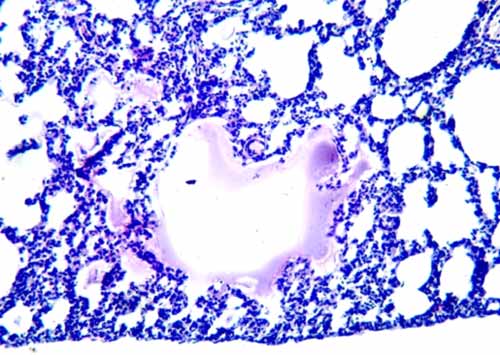
Рис. 4. Микрокиста, содержащая гиалиновые мембраны. Окраска гематоксилином и эозином. Увеличение 10×10
В интерстициальной ткани легких наблюдались периваскулярный и перибронхиальный отек, утолщение адвентициальных оболочек сосудов и бронхов, местами - их фиброз (рис. 5).
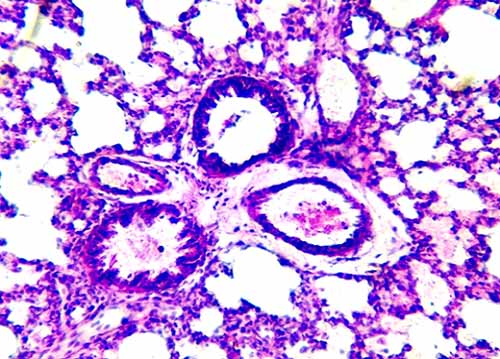
Рис. 5. Гипертрофия интерстициальной ткани, периваскулярный отек. Окраска гематоксилином и эозином. Увеличение 10×10
Результаты ХМЛ-анализа свидетельствовали, что при воздействии блеомицина важным патофизиологическим механизмом формирования ГБ является дискоординация локального редокс-метаболизма - смещение равновесия в системе "генерация-детоксикация" свободных радикалов в сторону гиперпродукции свободных радикалов и метаболитов свободнорадикального окисления. В легких крыс, подвергнутых воздействию блеомицина, все исследуемые ХМЛ-показатели достоверно превышали контрольные уровни: Ssp - в 2,6 раза (0,105±0,008 отн. ед. vs. 0,277±0,018 отн. ед., p<0,05), h - в 2,8 раза (0,73±0,05 отн. ед. vs. 2,06±0,12 отн. ед., p<0,05), Sind-1 - в 3,0 раза (0,87±0,06 отн. ед. vs. 2,64±0,17 отн. ед., p<0,05), Sluc - в 2,8 раза (0,092±0,006 отн. ед. vs. 0,256±0,015 отн. ед., p<0,05), Sind-2 - в 3,0 раза (2,56 0,12 отн. ед. vs. 7,88±0,32 отн. ед., p<0,05), H - в 2,9 раза (1,62±0,09 отн. ед. vs. 4,73 0,20 отн. ед., p<0,05). Таким образом, трехкратное введение новорожденным крысятам блеомицина обусловило целый ряд изменений структуры и свободнорадикального статуса легких. Они включали в себя, в частности, повреждения респираторных отделов органа на фоне оксидативного стресса, проявлявшиеся формированием в альвеолах ГМ. Учитывая патогенетическую роль этих изменений в патологии легких новорожденных, можно полагать, что примененное в работе воздействие может рассматриваться как возможный подход для моделирования болезни гиалиновых мембран. Рассматриваемая модель имеет и другие достоинства, в частности, моделирует гипертрофию и фиброз интерстициальной ткани, формирование кист.
Литература |
 |
 1. Глуховец Б.И., Гайворонский И.В., Белоусова Н.А., Пахаленко Д.В. Патогенетические особенности синдрома дыхательных расстройств у новорожденных с экстремально низкой массой тела // Архив патологии. - 2005. - Т. 67, № 4. - С. 3-5.
1. Глуховец Б.И., Гайворонский И.В., Белоусова Н.А., Пахаленко Д.В. Патогенетические особенности синдрома дыхательных расстройств у новорожденных с экстремально низкой массой тела // Архив патологии. - 2005. - Т. 67, № 4. - С. 3-5. 2. Голубев А.М., Перепелица С.А., Смердова Е.Ф. и др. Изменения легких у недоношенных новорожденных с болезнью гиалиновых мембран // Общая реаниматология. - 2009. - Т. 5, № 2. - С. 5-11.
2. Голубев А.М., Перепелица С.А., Смердова Е.Ф. и др. Изменения легких у недоношенных новорожденных с болезнью гиалиновых мембран // Общая реаниматология. - 2009. - Т. 5, № 2. - С. 5-11.  3. Голубев А.М., Мороз В.В., Сундуков А.В. Патогенез острого дистресс-синдрома // Общая реаниматология. - 2012. - Т. 8, № 4. - С. 13-21.
3. Голубев А.М., Мороз В.В., Сундуков А.В. Патогенез острого дистресс-синдрома // Общая реаниматология. - 2012. - Т. 8, № 4. - С. 13-21.  4. Гребенников В.А., Гаркуша В.Е., Геппе Н.А. Оценка эффективности ингаляций будесонида, применяемого для профилактики бронхолегочной дисплазии у недоношенных детей с различным гестационным возрастом // Пульмонология. - 2007. - № 4. - С. 7-11.
4. Гребенников В.А., Гаркуша В.Е., Геппе Н.А. Оценка эффективности ингаляций будесонида, применяемого для профилактики бронхолегочной дисплазии у недоношенных детей с различным гестационным возрастом // Пульмонология. - 2007. - № 4. - С. 7-11.  5. Дыгай А.М., Скурихин Е.Г., Ермакова Н.Н. и др. Антифибротический эффект нейролептика и иммобилизированнойгиалуронидазы при совместномназначениив условиях пневмофиброза // Бюллетень экспериментальной биологии и медицины. - 2012. - Т. 154, № 9. - С. 312-316.
5. Дыгай А.М., Скурихин Е.Г., Ермакова Н.Н. и др. Антифибротический эффект нейролептика и иммобилизированнойгиалуронидазы при совместномназначениив условиях пневмофиброза // Бюллетень экспериментальной биологии и медицины. - 2012. - Т. 154, № 9. - С. 312-316.  6. Игнатьева А.В., Гаймоленко И.Н., Баранчугова Л.М., Панченко А.С. Патоморфология легких при бронхолегочной дисплазии // Дальневосточный медицинский журнал. - 2012. - № 4. - С. 63-66.
6. Игнатьева А.В., Гаймоленко И.Н., Баранчугова Л.М., Панченко А.С. Патоморфология легких при бронхолегочной дисплазии // Дальневосточный медицинский журнал. - 2012. - № 4. - С. 63-66.  7. Лебедько О.А., Рыжавский Б.Я., Задворная О.В. Свободнорадикальный статус неокортекса белых крыс и его модификация экзогенными производными тестостерона // Дальневосточный медицинский журнал. - 2011. - № 4. - С. 95-99.
7. Лебедько О.А., Рыжавский Б.Я., Задворная О.В. Свободнорадикальный статус неокортекса белых крыс и его модификация экзогенными производными тестостерона // Дальневосточный медицинский журнал. - 2011. - № 4. - С. 95-99. 8. Овсянников Д.Ю., Давыдова И.В. Бронхолегочная дисплазия: вопросы терминологии и классификация // Российский педиатрический журнал. - 2008. № 2. - С. 18-23.
8. Овсянников Д.Ю., Давыдова И.В. Бронхолегочная дисплазия: вопросы терминологии и классификация // Российский педиатрический журнал. - 2008. № 2. - С. 18-23.  9. Овсянников Д.Ю., Кузьменко Л.Г., Гераськина В.П. и др. Частота бронхолегочной дисплазии в структуре респираторных заболеваний на различных этапах медицинской помощи детям и современные показатели летальности // Педиатрия. - 2009. - Т. 87, № 3. - С. 155-159.
9. Овсянников Д.Ю., Кузьменко Л.Г., Гераськина В.П. и др. Частота бронхолегочной дисплазии в структуре респираторных заболеваний на различных этапах медицинской помощи детям и современные показатели летальности // Педиатрия. - 2009. - Т. 87, № 3. - С. 155-159.  10. Рыжавский Б.Я., Лебедько О.А., Демидова О.В. Влияние введения блеомицина крысам в конце молочного периода на структуру легких и свободнорадикальное окисление в них (отсроченные последствия) // Дальневосточный медицинский журнал. - 2013. - № 2. - С. 81-84.
10. Рыжавский Б.Я., Лебедько О.А., Демидова О.В. Влияние введения блеомицина крысам в конце молочного периода на структуру легких и свободнорадикальное окисление в них (отсроченные последствия) // Дальневосточный медицинский журнал. - 2013. - № 2. - С. 81-84. 11. Самохин П.А., Цветкова Ю.В. Морфологические проявления бронхолегочной дисплазии новорожденных и клеточное обновление в легких при ней // Архив патологии. - 2010. - Т. 72, № 1. - С. 30-32.
11. Самохин П.А., Цветкова Ю.В. Морфологические проявления бронхолегочной дисплазии новорожденных и клеточное обновление в легких при ней // Архив патологии. - 2010. - Т. 72, № 1. - С. 30-32.  12. Самохин П.А., Цветкова Ю.В. Бронхолегочная дисплазия новорожденного: морфогенез, морфологическая диагностика // Архив патологии. - 2008. - Т. 70, № 4. - С. 37-42.
12. Самохин П.А., Цветкова Ю.В. Бронхолегочная дисплазия новорожденного: морфогенез, морфологическая диагностика // Архив патологии. - 2008. - Т. 70, № 4. - С. 37-42.  13. McNamara P.J., Murthy, Kantores C. Acute vasodilator effect of Rho-kinase inhibitors in neonatal rats with pulmonary hypertension unresponsive nitric oxide // J. Physiol. Lung. Cell. Mol. Physiol. - 2008. - Vol. 294, № 2. - P. 205-213.
13. McNamara P.J., Murthy, Kantores C. Acute vasodilator effect of Rho-kinase inhibitors in neonatal rats with pulmonary hypertension unresponsive nitric oxide // J. Physiol. Lung. Cell. Mol. Physiol. - 2008. - Vol. 294, № 2. - P. 205-213. 14. Shaffer T.H., Alapati D., Greenspan J.S., Wolfson M.R. Neonatal non-invasive respiratory support: physiological implications // Pediatr. Pulmonol. - 2012.- Vol. 47, № 9. - P. 837-847.
14. Shaffer T.H., Alapati D., Greenspan J.S., Wolfson M.R. Neonatal non-invasive respiratory support: physiological implications // Pediatr. Pulmonol. - 2012.- Vol. 47, № 9. - P. 837-847. 15. Tourneux P., Markham N., Seedorf, et al. Inhaled nitric oxide improves lung structure and pulmonary hypertension in model bleomycin-induced bronchopulmonary dysplasia in neonatal rats // Am. J. Physiol. Lung. Cell. Mol. Physiol. - 2009. - Vol. 296, № 2. - P. 1103-1111.
15. Tourneux P., Markham N., Seedorf, et al. Inhaled nitric oxide improves lung structure and pulmonary hypertension in model bleomycin-induced bronchopulmonary dysplasia in neonatal rats // Am. J. Physiol. Lung. Cell. Mol. Physiol. - 2009. - Vol. 296, № 2. - P. 1103-1111.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»