2014 год № 3
Фармакология и фармация
2Пятигорский медико-фармацевтический институт, 357532, пр. Калинина, 11, тел. 8-(793)-32-33-37, e-mail: canpgfa84@mail.ru, г. Пятигорск
Резюме:
Ключевые слова:
2Pyatigorsky branch of the State Budgetary Educational Establishment of Higher Professional Education "Volgograd State Medical University" of the Ministry of Public Health Services of the Russian Federation, Pyatigorsk
Summary:
Key words:
Введение |
 |
 |
Верапамила гидрохлорид является представителем группы антагонистов кальция. Помимо гипотензивного эффекта, он обладает выраженным антиаритмическим и антиатерогенным действием, метаболической нейтральностью, что делает его одним из препаратов выбора для комбинированной лекарственной терапии [1].
В ходе ранее проведенных исследований нами была разработана фармацевтическая композиция, в состав одной капсулы которой верапамила гидрохлорид входит в виде 4 таблеток продленного действия и лизиноприл в виде гранул [2].
Цель настоящей работы заключается в разработке и валидации ВЭЖХ методики для количественного определения верапамила гидрохлорида в фармацевтической композиции гипотензивного действия.
В статье представлены результаты валидации разработанной методики по параметрам: специфичность, линейность, правильность и повторяемость.
Материалы и методы
|
 |
 |
В работе использовались приборы: жидкостный хроматограф Agilent 1260 Infinity с колонкой Luna 5u длиной 25 мм с сорбентом Силасорб С18; рН-метр ионометр 410; аналитические весы марки Т-А-13.
Верапамила гидрохлорида в одной капсуле содержится в дозе 100 мг в виде 4 таблеток по 25 мг. В связи с этим, состав таблеток продленного действия (в пересчете на 1 таблетку):
Верапамила гидрохлорид - 25 мг;
Натрия альгината - 50 мг;
Микрокристаллическая целлюлоза (МКЦ) - 15 мг;
Магния стеарат - 0,6 мг;
Plasdone K-90 - 7,5 мг.
Определение валидационных параметров методики проводили на модельных смесях таблеток верапамила гидрохлорида в пересчете на одну дозу вещества (100 мг).
Растворы модельных смесей таблеток верапамила гидрохлорида и стандартного образца (СО) верапамила гидрохлорида для измерения площади пиков готовили в концентрации 0,1 мг/мл.
Методика. Около 0,4 г (точная навеска) порошка модельной смеси растертых таблеток верапамила гидрохлорида помещали в мерную колбу вместимостью 10 мл, встряхивали с 3 мл метанола в течение 10 мин., раствор доводили до метки этим же растворителем. Осадок отфильтровывали с помощью фильтра типа "синяя лента". 1 мл полученного раствора помещали в мерную колбу вместимостью 100 мл, растворяли в воде и доводили этим же растворителем до метки. Раствор фильтровали через фильтр типа "синяя лента", измеряли площади пиков.
В качестве подвижной фазы (ПФ) была выбрана система растворителей: фосфатный буферный раствор (рН=3,0) - ацетонитрил - изопропанол в соотношении 30:35:35, режим элюирования изократический. Скорость потока ПФ 0,8 мл/мин., объем пробы 20 мкл, температура термостата колонки 40 °С. Детектирование осуществляли с помощью УФ-детектора при длине волны 278 нм. В колонку хроматографа попеременно вводили равные объемы раствора СО верапамила гидрохлорида и растворы испытуемых модельных таблеток, измеряли площади пиков.
Результаты и обсуждение
|
 |
 |
На первом этапе для проведения анализа необходимо было подобрать растворитель для извлечения верапамила гидрохлорида из таблеточной массы. Использование водных растворителей не представлялось возможным, т. к. входящий в состав таблеток натрия альгинат медленно растворяется в воде, образуя вязкий гель. Учитывая растворимость верапамила гидрохлорида и вспомогательных веществ, нами было предложено использовать метанол, который эффективнее, чем этанол извлекает действующее вещество и в котором нерастворим натрия альгинат.
В качестве подвижной фазы нами была выбрана система: фосфатный буферный раствор (от 10 до 90) - ацетонитрил (от 10 до 90), без включения аминов и их производных, изократический режим элюирования и детектирование при 278 нм [5, 6]. В предложенных условиях на хроматограммах модельных смесей таблеток верапамила гидрохлорида фактор асимметрии пика верапамила и разрешение между пиком исследуемого вещества и пиком вспомогательных веществ не соответствовали требованиям НД [3]. Оптимальные результаты мы получили при введении в ПФ в качестве третьего компонента раствора изопропилового спирта. Соотношение растворителей фосфатный буферный раствор (рН 3,0) - ацетонитрил - изопропанол при этом составило 30:35:35.
Валидацию разработанной методики проводили в соответствии с проектом ОФС 42-0113-09 "Валидация аналитических методик".
Специфичность разработанной методики определяли путем сравнения хроматограмм модельных таблеток верапамила и плацебо-смеси. Время удерживания (tR) исследуемого вещества на хроматограмме СО верапамила составляет 3,29 минуты. На хроматограммах модельных таблеток верапамила помимо пика основного вещества с tR=3,29 мин. зафиксирован пик с tR=2,20 мин. На хроматограмме плацебо-смеси обнаружен пик, время удерживания которого также составляет 2,20 мин, а пик исследуемого вещества отсутствует (рисунок).
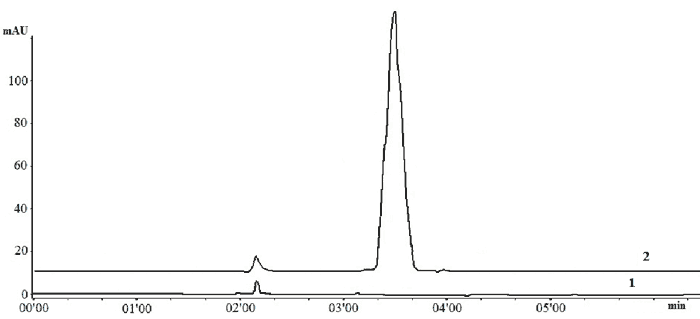
Рис. Хроматограмма модельных таблеток верапамила гидрохлорида (2) и плацебо-смеси (1)
Согласно растворимости вспомогательных веществ, пик на хроматограмме смеси "плацебо" соответствует PlasdoneK-90. В соответствии с полученными результатами установлено, что присутствие вспомогательных веществ не мешает определению верапамила гидрохлорида в таблетках.
Линейность определяли путем измерения площади пиков извлечений из 5 образцов модельных смесей таблеток верапамила гидрохлорида с содержанием действующего вещества 80, 90, 100, 110 и 120 %. Установлено, что аналитическая область методики, находящаяся в диапазоне 0,8-1,2 мг/мл, входит в пределы линейной зависимости и описывается уравнением у=14 959х -269,6 с коэффициентом корреляции r=0,999.
Правильность предлагаемой методики определяли на 6 образцах модельных смесей таблеток с известным содержанием верапамила гидрохлорида.
С целью проверки повторяемости методики проводили трехуровневый эксперимент по 3 опыта на каждом уровне. Диапазон измерения был выбран исходя из варьирования содержания верапамила в одной дозе лекарственной формы (±20 %).
Общие результаты валидационной оценки ВЭЖХ определения верапамила гидрохлорида в модельных смесях таблеток представлены в таблице.
| Наименование показателя | Оптимальное значение (НД) | Результат определения | Соответствие требованиям НД [3, 4] |
|---|---|---|---|
| Специфичность | однородность пика | пик определяемого вещества четко отделяется от пиков вспомогательных веществ | + |
| Аналитическая область | результаты должны иметь приемлемый уровень правильности и повторяемости | методика применима в интервале от 80 до 120 % от номинального значения содержания вещества в модельных таблетках | + |
| Линейность (коэффициент корреляции r) | |r|≥ 0,99 | 0,999 | + |
| Правильность (критерий Стьюдента) | ≤2,57 | 0,82 | + |
| Повторяемость (относительное стандартное отклонение RSD) | ≤3 % | 1,63 % | + |
Согласно представленным данным для разработанной методики выполняется условие линейной зависимости у=14 959х -269,6 (|r|≥0,990,99), правильности (tвыч.
Выводы
|
 |
 |
В ходе экспериментальной работы предложена методика количественного определения верапамила гидрохлорида в фармацевтической композиции методом ВЭЖХ. При помощи валидационной оценки установлено, что разработанная методика ВЭЖХ валидна по показателям: специфичность, аналитическая область, линейность, правильность, повторяемость.
Литература |
 |
 1. Диагностика и лечение артериальной гипертензии: Российские рекомендации (четвертый пересмотр) // Системные гипертензии. - 2010. - № 3. - С. 5-26.
1. Диагностика и лечение артериальной гипертензии: Российские рекомендации (четвертый пересмотр) // Системные гипертензии. - 2010. - № 3. - С. 5-26. 2. Компанцева Е.В. Разработка состава и технологии таблеток верапамила с контролируемым высвобождением действующего вещества // Вопросы биологической, медицинской и фармацевтической химии. - 2013. - № 3. - С. 17-20.
2. Компанцева Е.В. Разработка состава и технологии таблеток верапамила с контролируемым высвобождением действующего вещества // Вопросы биологической, медицинской и фармацевтической химии. - 2013. - № 3. - С. 17-20. 3. Сапрыкин Л.В. Практика и методические основы ВЭЖХ. - М., 2006. - 151 с.
3. Сапрыкин Л.В. Практика и методические основы ВЭЖХ. - М., 2006. - 151 с. 4. Эпштейн Н.А. Оценка пригодности (валидация) ВЭЖХ методик в фармацевтическом анализе (обзор) // Химико-фармацевтический журн. - 2004. - Т. 38, № 4. - С. 40-56.
4. Эпштейн Н.А. Оценка пригодности (валидация) ВЭЖХ методик в фармацевтическом анализе (обзор) // Химико-фармацевтический журн. - 2004. - Т. 38, № 4. - С. 40-56. 5. HPLC method for determination of verapamil in human plasma after solid-phase extraction // Journal of Biochemical and Biophysical Methods. - 2008. - Vol. 70, № 6. - P. 1297-1303.
5. HPLC method for determination of verapamil in human plasma after solid-phase extraction // Journal of Biochemical and Biophysical Methods. - 2008. - Vol. 70, № 6. - P. 1297-1303. 6. Ho P.C. Simultaneous HPLC analysis of S- and R-verapamil and metabolites, S- and R-norverapamil in human plasma // J. Liq. Chromatogr. and Relat. Technol. - 2000. - Vol. 23, № 11. - P. 1711-1723.
6. Ho P.C. Simultaneous HPLC analysis of S- and R-verapamil and metabolites, S- and R-norverapamil in human plasma // J. Liq. Chromatogr. and Relat. Technol. - 2000. - Vol. 23, № 11. - P. 1711-1723.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»