2015 год № 4
Теоретическая и экспериментальная медицина
2Институт охраны материнства и детства Хабаровского филиала Дальневосточного научного центра физиологии и патологии дыхания СО РАМН, 680022, ул. Воронежская, 49, корп. 1, тел./факс: 8-(4212)-35-63-35, 35-65-91, e-mail: iomid@yandex.ru;
3ООО "Медико-эстетический центр Биарриц", 680000, ул. Дзержинского, 71, тел. 8-(4212)-32-38-61, г. Хабаровск
Резюме:
Ключевые слова:
2Research Institute of maternity and infancy protection;
3Medical-esthetic Center "Bioritz", Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Дигидрокверцетин - это растительный антиоксидант, полифенольный биофлавоноид [2]. В литературе описано антипролиферативное и цитотоксическое воздействие биологически активных веществ класса биофлавоноидов на культуры опухолевых клеток [5]. Вместе с тем, характер влияния биофлавоноида кверцетина и его аналогов на нормальные клетки может существенно отличаться от влияния на опухолевые клетки [7].
Целью исследования было изучение характера влияния дигидрокверцетина (ДГК) на первичную культуру пульмональных фибробластов на интактном фоне и в условиях оксидативного стресса.
Материалы и методы
|
 |
 |
Объектом исследования служила первичная культура пульмональных фибробластов новорожденной белой крысы линии Wistar. Биоптат правого легкого подвергали механической дезагрегации с последующей обработкой коллагеназой панкреаса краба (Биолот, Россия) - 500 ед./мл при 37 оС в течение 15 мин. После двукратной отмывки раствором Хенкса (Биолот, Россия), полученный материал высевали в культуральные флаконы. Культивирование проводили в среде DMEM (Биолот, Россия) с добавлением 10 % фетальной бычьей сыворотки (Sigma, США) в газовой среде с 5 % содержанием СО2. Для исследования использовали клетки 5 пассажа.
Инкубацию пульмональных фибробластов с ДГК (Sigma Aldrich, США) проводили в течение 6 часов при концентрации вещества в культуральной среде 160 мкМ (50 мг/л). Оксидативный стресс моделировали добавлением в 15 мл инкубационной среды 0,001мл 3 % Н2О2 (60 мкМ) с экспозицией в течение 2 часов [3]. Формировали следующие серии: 1 - "контроль"; 2 - "ДГК" (воздействие ДГК в течение 6 часов); 3 - "оксидативный стресс" (добавление в культуральную среду Н2О2 с экспозицией в течение 2 часов); 4 - "ДГК + оксидативный стресс" (воздействие ДГК в течение 6 часов с обработкой культуры в заключительные 2 часа инкубации перекисью водорода).
Для оценки процессов генерации супероксид-анион радикалов пульмональными фибробластами использовали метод люцигенин-зависимой хемилюминесценции (ХМЛ) [1]. Регистрацию ХМЛ осуществляли на люминесцентном спектрометре LS 50B "PERKIN ELMER", сигнал стандартизировали с помощью встроенной программы "Finlab". Фибробласты снимали с подложки с помощью раствора трипсина-Версена (Биолот, Россия) и трехкратно отмывали раствором Хенкса. Подсчет клеток в суспензии фибробластов проводили в камере Горяева. Для хемилюминесцентого анализа использовали 1×106 клеток. Люцигенин ( N,N'-dimethyl-9,9'-biacridinium dinitrate; Sigma-Aldrich) добавляли в конечной концентрации 5 мкM. Определяли светосумму люцигенин-зависимого свечения (Sluc) за 5 минут, которую выражали в относительных единицах.
ДНК-синтетическую активность пульмональных фибробластов исследовали методом авторадиографии с 3Н-тимидином. В течение 1 часа клеточные монослои инкубировали при 37 оС в растворе Хенкса с добавлением 3Н-тимидина в концентрации 1 мкКюри/мл. После инкубации монослои тщательно промывали в растворе Хенкса и фиксировали в 96 % этаноле. Предметные стекла с монослоем фибробластов покрывали ядерной фотоэмульсией Ilford (Великобритания) и инкубировали при 4 оC в течение 28 суток. Затем проводили обработку проявителем Д-19, фиксировали в 33 % растворе гипосульфита натрия и окрашивали гематоксилином. Индекс меченых ядер (ИМЯ) рассчитывали на основании просмотра не менее 5 000 фибробластов каждого монослоя и выражали в процентах.
Параметры ядрышкового аппарата клеток оценивали с помощью компьютерной морфоцитометрии на анализаторе изображения "МЕКОС-Ц" в монослоях фибробластов, окрашенных азотнокислым серебром. Исследовали площадь ядер фибробластов, количество зон ядрышковых организаторов (ЯОР), суммарную площадь зон ЯОР в ядре. Площади ядер и зон ЯОР рассчитывали на основании измерения 50 клеток. Для анализа количества зон ЯОР просматривали 200 ядер фибробластов.
Результаты исследования обрабатывали с использованием программы "Statistica 6.0". Различия между контрольной и опытными сериями считали статистически достоверными при р<0,05, используя t-критерий Стьюдента. Всего в эксперименте было исследовано 24 монослоя фибробластов.
Результаты и обсуждение
|
 |
 |
Воздействие ДГК на первичную культуру пульмональных фибробластов (серия 2) индуцировало угнетение продукции супероксид-радикала: наблюдалось достоверное снижение интенсивности люцигенен-зависимой ХМЛ на 35,5 % (рис. 1). Показатель активности ДНК-синтетических процессов - индекс меченых ядер, характеризующий долю фибробластов в S-фазе клеточного цикла, - после воздействия ДГК не имел достоверных отличий от контрольного параметра (ИМЯ контроль - 30,69±3,70 %; ИМЯ ДГК - 26,33±2,90 %). Морфометрическое исследование ядер фибробластов выявило достоверное уменьшение их размеров на 9,5 % (таблица). Кроме того, мы наблюдали достоверное снижение суммарной площади зон ЯОР на 7,8 %. Количество зон ЯОР в ядрах фибробластов, подвергнутых воздействию ДГК, не отличалось от контрольного. Воздействие ДГК на размер ядер и ядрышковый аппарат фибробластов может быть обусловлено способностью биофлавоноидов ингибировать активность мембранной тирозинкиназы, необходимой для реализации эффектов ростовых факторов [8].
| Исследуемая серия | Площадь ядра (мкм2) | Суммарная площадь зон ЯОР (мкм2) | Количество зон ЯОР |
|---|---|---|---|
| Контроль | 218,60±4,39 | 17,03±0,39 | 3,95±0,07 |
| ДГК | 197,94±3,94* | 15,70±0,37* | 3,98±0,08 |
| Оксидативный стресс | 80,83±3,46* | 8,24±0,46* | 3,11±0,10* |
| ДГК + оксидативный стресс | 126,07±5,91*,** | 12,99±0,47*, ** | 3,35 ± 0,10* |
Примечание. * - р<0,05 по отношению к серии "контроль"; ** - р<0,05 по отношению к серии "оксидативный стресс".
Воздействие на культивируемые пульмональные фибробласты среды с 60 мкМ перекиси водорода (серия 3 - "оксидативный стресс") индуцировало достоверное повышение интенсивности люцигенен-зависимой ХМЛ в культуре на 78,3 % (рисунок). Выраженная активация процессов свободнорадикального окисления в культуре сопровождалась практически полным блоком ДНК-синтетических процессов в культуре: в монослоях клеток, подвергнутых воздействию оксидативного стресса, встречались лишь единичные меченые ядра, с минимальной интенсивностью метки. По мнению Davies K.J. (1999), при оксидативном стрессе происходит блокада синтеза ДНК с целью защиты генетического аппарата от оксидативного повреждения.
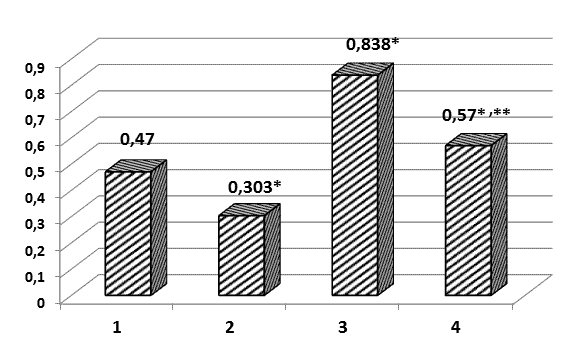
Рис. Интенсивность люцигенин-зависимой ХМЛ в суспензированной культуре пульмональных фибробластов новорожденных белых крыс: 1 - контроль; 2 - ДГК; 3 - оксидативный стресс; 4 - ДГК + оксидативный стресс
Примечание. * - р<0,05 по отношению к серии "контроль"; ** - р<0,05 по отношению к серии "оксидативный стресс".
В фибробластах, подвергнутых воздействию перекиси водорода, по сравнению с контролем, наблюдалось достоверное значительное (на 63 %) уменьшение показателя площади ядер фибробластов; снижение (на 51,6 %) суммарной площади зон ядрышковых организаторов, а также достоверное уменьшение количества зон ЯОР в ядрах фибробластов (таблица). По данным Mayer C., Grummt I. (2005) и Wnuk M., et al. (2008), оксидативный стресс угнетает синтез рибосомальной РНК, что выражается в отклонении параметров ядрышкового аппарата.
Выраженность изменений в первичной культуре фибробластов, индуцированных воздействием перекиси водорода, была несколько меньше в монослоях, предварительно инкубированных с ДГК (серия 4). Интенсивность люцигенин-зависимой ХМЛ в этих образцах культуры оставалась достоверно выше контрольного параметра (на 21,3 %), однако была достоверно (на 32 %) ниже аналогичного параметра группы "оксидативный стресс" (рисунок).
Аналогичная закономерность наблюдалась и при анализе размеров ядер и состояния ядрышкового аппарата у фибробластов, подвергнутых действию оксидативного стресса на фоне ДГК. Так, показатель площади ядер фибробластов и суммарной площади ядрышек клеток серии "ДГК+оксидативный стресс" был достоверно ниже контрольных параметров, однако, достоверно выше аналогичных показателей серии "оксидативный стресс" (таблица).
Особенно отчетливо цитопротективный эффект ДГК был заметен при анализе процессов синтеза ДНК в культуре фибробластов. Если в серии монослоев, подвергнутых воздействию перекиси водорода, мы наблюдали практически полное исчезновение ДНК-синтетической активности, то предварительное воздействие ДГК восстанавливало индекс меченых ядер культуры фибробластов до 6,56±1,50 %.
Результаты проведенного исследования в условиях первичной клеточной культуры указывают на наличие у растительного биофлавоноида дигидрокверцетина собственного прямого цитопротективного эффекта, реализующегося в условиях оксидативного стресса. Аналогичные по характеру эффекты были зарегистрированы Braganhol E., et al (2006) при исследовании влияния кверцетина на культуру нейронов гиппокампа [4]. Молекулярные механизмы цитопротективного влияния дигидрокверцетина в условиях оксидативного стресса требуют дальнейшего исследования.
Выводы
|
 |
 |
- Влияние 160 мкМ ДГК на первичную культуру пульмональных фибробластов индуцирует угнетение продукции супероксид-радикала, достоверное уменьшение размеров ядер фибробластов и суммарной площади зон ЯОР.
- Воздействие на культивируемые пульмональные фибробласты 60 мкМ перекиси водорода вызывает достоверную активацию продукции супероксид-радикала в культуре, блокаду ДНК-синтетической активности клеток и достоверное снижение площади ядер и суммарной площади зон ЯОР.
- На фоне действия ДГК имеет место существенное снижение цитотоксического действия оксидативного стресса: уменьшается продукция супероксид-радикала, происходит частичное восстановление пролиферативной активности клеточной культуры.
Литература |
 |
 1. Владимиров Ю.А., Проскурнина Е.В. Свободные радикалы и клеточная xемилюминесценция // Успехи биологической химии. - 2009. - Т. 49. - С. 341-388.
1. Владимиров Ю.А., Проскурнина Е.В. Свободные радикалы и клеточная xемилюминесценция // Успехи биологической химии. - 2009. - Т. 49. - С. 341-388. 2. Меньшикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. - М.: Фирма "Слово", 2006. - С. 556.
2. Меньшикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. - М.: Фирма "Слово", 2006. - С. 556.  3. Самохвалов В.А., Сметанина М.Д., Мусейкина Н.Ю. и др. Влияние низкой концентрации перекиси водорода на метаболизм клеток крови // Биомедицинская химия. - 2003. - Т. 2. - С. 122-127.
3. Самохвалов В.А., Сметанина М.Д., Мусейкина Н.Ю. и др. Влияние низкой концентрации перекиси водорода на метаболизм клеток крови // Биомедицинская химия. - 2003. - Т. 2. - С. 122-127. 4. Braganhol E., Zamin L.L., Canedo D., et al. Antiproliferative effect of quercetin in the human U138MG glioma cell line // Anti-Cancer Drugs. - 2006. - Vol. 17 (6). - P. 663-671.
4. Braganhol E., Zamin L.L., Canedo D., et al. Antiproliferative effect of quercetin in the human U138MG glioma cell line // Anti-Cancer Drugs. - 2006. - Vol. 17 (6). - P. 663-671. 5. Csokay B., Prajda N., Weber G., Olah E. Molecular mechanisms in the antiproliferative action of quercetin // Life Sciences. - 1997. - Vol. 60 (24). - P. 2157-2163.
5. Csokay B., Prajda N., Weber G., Olah E. Molecular mechanisms in the antiproliferative action of quercetin // Life Sciences. - 1997. - Vol. 60 (24). - P. 2157-2163. 6. Davies K.J. The broad spectrum of responses to oxidants in proliferating cells: a new paradigm for oxidative stress // IUBMB Life. - 1999. - Vol. 48 (1). - P. 41-70.
6. Davies K.J. The broad spectrum of responses to oxidants in proliferating cells: a new paradigm for oxidative stress // IUBMB Life. - 1999. - Vol. 48 (1). - P. 41-70. 7. Kim H.S., Quon Michael J., Kim Jeonga. New insights into the mechanisms of polyphenols beyond antioxidant properties; lessons from the green tea polyphenol,epigallocatechin 3-gallate // RedoxBiology. - 2014. - Vol. 2. - P. 187-195.
7. Kim H.S., Quon Michael J., Kim Jeonga. New insights into the mechanisms of polyphenols beyond antioxidant properties; lessons from the green tea polyphenol,epigallocatechin 3-gallate // RedoxBiology. - 2014. - Vol. 2. - P. 187-195. 8. Liang Y.C., Lin-shiau S.Y., Chen C.F., Lin J.K. Suppression of extracellular signals and cell proliferation through EGF receptor binding by(-)-epigallo- catechin gallateinhuman A431 epidermoid carcinoma cells // J. Cell. Biochem. - 1997. - Vol. 67. - P. 55-65.
8. Liang Y.C., Lin-shiau S.Y., Chen C.F., Lin J.K. Suppression of extracellular signals and cell proliferation through EGF receptor binding by(-)-epigallo- catechin gallateinhuman A431 epidermoid carcinoma cells // J. Cell. Biochem. - 1997. - Vol. 67. - P. 55-65. 9. Mayer C., Grummt I. Cellular stress and nucleolar function // Cell Cycle. - 2005. - Vol. 4 (8). - P. 1036-1038.
9. Mayer C., Grummt I. Cellular stress and nucleolar function // Cell Cycle. - 2005. - Vol. 4 (8). - P. 1036-1038. 10. O'Donnell V.B., Azzi A. High rates of extracellular superoxide generation by cultured human fibroblasts: involvement of a lipid-metabolizing enzyme // Biochem J. - 1996. - Vol. 318 (Pt 3). - P. 805-812.
10. O'Donnell V.B., Azzi A. High rates of extracellular superoxide generation by cultured human fibroblasts: involvement of a lipid-metabolizing enzyme // Biochem J. - 1996. - Vol. 318 (Pt 3). - P. 805-812. 11. Wnuk M., Lewinska A., Bugno M., Bartosz G., Slota E. Oxidant-induced decrease of the expression of nucleolar organizer regions in pig lymphocytes can be useful for monitoring the cellular effects of oxidative stress // Mutat Res - 2008. - Vol. 653 (1-2). - P. 124-129.
11. Wnuk M., Lewinska A., Bugno M., Bartosz G., Slota E. Oxidant-induced decrease of the expression of nucleolar organizer regions in pig lymphocytes can be useful for monitoring the cellular effects of oxidative stress // Mutat Res - 2008. - Vol. 653 (1-2). - P. 124-129.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»