2016 год № 3
Педиатрия
2Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел. 8-(4212)-76-13-96, e-mail: nauka@mail.fesmu.ru, г. Хабаровск
Резюме:
Ключевые слова:
2Far eastern state medical university, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
В настоящее время в концепции охраны репродуктивного здоровья особое место отводится проблемам подросткового возраста. Согласно данным ведущих российских урологов-андрологов, с каждым годом увеличивается количество мальчиков, страдающих различными формами нарушений репродуктивной сферы [3, 4]. С другой стороны, ожирение приобретает все больший удельный вес в патологии подросткового периода [6]. Общеизвестно, что пубертат - это возраст, когда активизируются процессы роста и полового созревания, в это время отмечается наибольшее напряжение и лабильность в функционировании репродуктивной, эндокринной и других систем. При этом риск нарушения репродуктивного здоровья существенно возрастает при наличии соматических и эндокринных заболеваний [10, 12].
Имеющиеся у современных исследователей сведения о физиологии и основных параметрах функциональной активности репродуктивной системы свидетельствуют о сложности механизмов регуляции каждого звена гипоталамо-гипофизарно-гонадной системы и всей системы в целом.
Учитывая тесную взаимосвязь желез внутренней секреции и повышенную их активность в период полового созревания, несомненный интерес представляет оценка влияния нарушения обмена веществ на становление репродуктивной системы у мальчиков-подростков. В этом аспекте особую медицинскую значимость приобретает исследование состояния репродуктивного статуса мальчиков-подростков, страдающих ожирением.
Цель исследования - изучить структуру полового созревания, последовательность появления вторичных половых признаков, особенности гормонального профиля при некоторых клинических формах нарушения репродуктивного статуса у мальчиков-подростков с ожирением.
Материалы и методы
|
 |
 |
Обследовано 69 подростков (12-17 лет) с ожирением I, II степени (индекс массы тела (ИМТ), равный или превышающий +2,0 SDS ИМТ) [6], находившихся на стационарном обследовании и лечении в клинике Хабаровского филиала ДНЦ ФПД - НИИ ОМиД. Дизайн исследования одобрен этическим комитетом, во всех случаях получено добровольное информированное согласие на участие в исследовании в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации (Форталеза, Бразилия, октябрь 2013 г.).
Для реализации цели исследования среди контингента обследованных детей были выделены следующие клинические группы. Первую группу (n=33) составили мальчики-подростки с ожирением, не осложненным метаболическим синдромом, вторую группу (n=36) - пациенты с ожирением, осложненным метаболическим синдромом. Группу сравнения составили 122 мальчика-подростка 1-й и 2-й групп здоровья с нормальной массой тела, сопоставимые по возрасту.
Диагностика метаболического синдрома основывалась на следующих признаках: абдоминальное ожирение, артериальная гипертензия, наличие двух или более характерных биохимических показателей крови: (гипертриглицеридемия, высокий уровень холестерина, повышение липопротеинов низкой плотности, повышенное содержание глюкозы в крови).
Оценка полового развития мальчиков-подростков по появлению и степени выраженности вторичных половых признаков проводилась по методике J. Tanner (1986) и стандартам полового развития М. В. Максимовой (1984, 1998), с последующей суммарной балльной оценкой стадии полового развития и соответствия её паспортному возрасту. Половое развитие мальчиков оценивалось в баллах по формуле: V, Ax, P, L, F , где V - мутация голоса, Ax - оволосение аксиллярных впадин, P - оволосение лобка, L - увеличение перстневидного хряща, F - рост усов и бороды. Всем детям проводилось УЗИ гонад, осмотр уролога, эндокринолога.
В сыворотке крови, взятой в утренние часы натощак, на микропланшетном ридере "StatFax-2100" (США) методом иммуноферментного анализа с помощью тест-систем фирмы "АлкорБио" (Санкт-Петербург) определяли пролактин, фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, эстрадиол (Е2), тестостерон, дегидроэпиандростерон - сульфат (ДГЭА-с), кортизол. Гормональный статус исследовали у всех мальчиков-подростков с ожирением и 40 детей группы сравнения.
Статистическую обработку полученных данных проводили с использованием программных средств пакета Statistica (версия 10).
Результаты и обсуждение
|
 |
 |
При анализе структуры полового созревания мальчиков-подростков с ожирением в обеих клинических группах были выявлены нарушения в виде отставания. При этом, при ожирении, не осложненном метаболическим синдромом, отставание темпов полового созревания было зарегистрировано в 35,6 % случаев. Во второй клинической группе - у мальчиков-подростков с ожирением, осложненным метаболическим синдромом, аналогичные нарушения отмечались в 1,2 раза чаще и составили 43,8 % случаев.
При оценке последовательности появления вторичных половых признаков, таких как Ах, Р, V и L, у мальчиков с ожирением выявлено более позднее их начало (табл. 1-4), особенно в группе мальчиков 14-16 лет (табл. 5) и соответствовало возрастной группе 13-14-летних подростков (II стадия по Tanner) в 27,0 % случаях.
| Возраст (лет) | 12 | 13 | 14 | 15 | 16 | 17 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | |
| V0 | 76,4 | 75,8 | 63,3 | 54,0 | 52,0 | 31,0 | 10,8 | 11,9 | 4,3 | 10,9 | 10,9 | - | 2,2 | 3,0 | - | - | - | - |
| V1 | 23,6 | 24,2 | 36,7 | 46,0 | 48,0 | 69,0 | 51,2 | 51,1 | 32,3 | 40,7 | 40,7 | 18,0 | 19,4 | 22,8 | 5,0 | 20,0 | 25,0 | - |
| V2 | - | - | - | - | - | - | 38 | 37 | 63,4 | 48,4 | 48,4 | 82,0 | 78,4 | 74,2 | 95,0 | 80,0 | 75,0 | 100 |
| Возраст (лет) | 12 | 13 | 14 | 15 | 16 | 17 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | |
| P1 | 67,0 | 59,0 | 64,0 | 16,0 | 18 | 10,6 | 8,0 | 9,0 | 2,0 | - | 2,0 | - | - | - | - | - | - | - |
| P2 | 33,0 | 39,0 | 26,0 | 74,0 | 72,0 | 30,0 | 54,0 | 56,0 | 10,0 | 16,0 | 14,0 | - | 10,0 | 12,0 | - | - | - | - |
| P3 | - | 2,0 | 10,0 | 10,0 | 10,0 | 60,4 | 38,0 | 35,0 | 80,0 | 54,0 | 56,8 | 24,0 | 70,5 | 72,5 | 56,0 | - | - | - |
| P4 | - | - | - | - | - | - | - | - | 8,0 | 30,0 | 27,2 | 64,0 | 14,5 | 11,5 | 23,0 | 66,6 | 69,8 | 4,0 |
| P5 | - | - | - | - | - | - | - | - | - | - | - | 12,0 | 5,0 | 4,0 | 21,0 | 33,4 | 30,2 | 96,0 |
| Возраст (лет) | 12 | 13 | 14 | 15 | 16 | 17 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-й гр. | 2-й гр. | К | 1-й гр. | 2-й гр. | К | |
| L1 | 100 | 100 | 85,7 | 82,0 | 85,0 | 66,6 | 48,0 | 50,0 | 15,0 | 40,0 | 42,0 | 2,5 | 8,0 | 10,0 | - | 6,0 | 10,0 | - |
| L2 | - | - | 14,3 | 18,0 | 15,0 | 33,4 | 52,0 | 50,0 | 85,0 | 60,0 | 58,0 | 97,5 | 92,0 | 90,0 | 100 | 94,0 | 90,0 | 100 |
| Возраст (лет) | 12 | 13 | 14 | 15 | 16 | 17 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | 1-я гр. | 2-я гр. | К | |
| Ах1 | 90,0 | 92,0 | 70,0 | 50,0 | 55,0 | 20,6 | 30,5 | 33,5 | 10,0 | 15,0 | 37,0 | - | - | - | - | - | - | - |
| Ах2 | 10,0 | 8,0 | 20,0 | 40,0 | 40,0 | 50,0 | 37,5 | 34,5 | 40,0 | 43,0 | 14,0 | 45,0 | 45,0 | 50,0 | 2,0 | 34,0 | 32,0 | - |
| Ах3 | - | - | 10,0 | 10,0 | 5,0 | 30,0 | 32,0 | 32,0 | 50,0 | 42,0 | 46,0 | 65,0 | 55,0 | 50,0 | 98,0 | 66,0 | 68,0 | 100 |
| Стадия | Соответствие возрасту | 1-я группа | 2-я группа | Группа сравнения |
|---|---|---|---|---|
| I | 11-13 | - | - | - |
| II | 12-14 | 25,2 | 27,2 | - |
| III | 13-15 | 31,5 | 32,0 | 14,4 |
| IV | 14-16 | 43,3 | 40,8 | 85,6 |
| V | 16-18 | - | - | - |
Известно, что только при достаточном развитии жировой ткани, лептин, один из главных инициаторов люлиберин-импульсов, достигает необходимых физиологических концентраций. Этот факт лежит в основе одной из теорий инициации пубертата [8]. В то же время, гиперпродукция лептина у пациентов с ожирением вызывает снижение гонадотропной функции [14]. Наши данные согласуются с исследованиями ряда авторов, свидетельствующими о том, что избыточный вес, приводящий к лептинорезистентности, способствует снижению выработки половых гормонов и клинически в дальнейшем проявляется задержкой становления пубертата [2, 8].
У 100 % обследованных подростков с ожирением были выявлены нарушения со стороны репродуктивной системы (табл. 6). Отклонения в репродуктивном статусе проявлялись в виде варикоцеле (12,1 % и 13,8 %), сперматоцеле (15,1 % и 13,8 %), гипогонадизма (48,4 % и 50 %), гинекомастии (24,2 % и 22,2 %) в 1и 2 группах, соответственно. Достоверных различий в частоте встречаемости различных форм нарушений репродуктивного здоровья между 1-й и 2-й группами не выявлено. Преимущественной формой нарушений репродуктивного статуса в обеих группах являлся гипогонадизм.
| Группа | Мальчики-подростки (69) | |||
|---|---|---|---|---|
| варикоцеле | сперматоцеле | гипогонадизм | гинекомастия | |
| 1-я группа | 4 | 5 | 16 | 8 |
| 2-я группа | 5 | 5 | 18 | 8 |
Учитывая вышеуказанные данные об отсутствии различий в частоте встречаемости клинических форм нарушений репродуктивного здоровья между 1-й и 2-й группами, уровни гонадотропинов первоначально исследовали в общей группе мальчиков-подростков с ожирением. Зарегистрировали достоверное увеличение всех исследуемых параметров. Так, уровни ЛГ, ФСГ, пролактина превышали аналогичные показатели в группе сравнения в 1,98-, 2,89- и 1,93 раза, соответственно (рисунок). Повышение уровня ЛГ у мальчиков-подростков с ожирением в сопоставлении с изменением уровня лептина было ранее описано в работе Солодиловой Е.А. и соавт. [8]. Значительное повышение уровня ФСГ, вероятно, обусловлено возрастной эволюцией степени его участия в органогенезе репродуктивной системы мальчиков [9]. Зарегистрированное повышение уровня пролактина в группе пациентов с ожирением, возможно, связано со стимулирующим эффектом эстрогенов жировой ткани. Известно, что высокий уровень эстрогенов индуцирует секрецию пролактина посредством ингибирования синтеза дофамина [13].
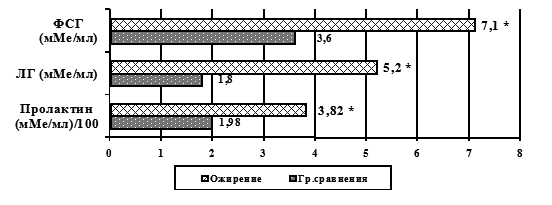
Рис. Уровни гипофизарных половых гормонов у мальчиков-подростков с ожирением
Примечание. * - достоверные различия с группой сравнения р<0,05.
Полученные нами данные свидетельствовали в пользу дискоординации работы гипофизарно-гонадной системы у мальчиков-подростков с ожирением, и повлекли за собой попытку оценить особенности гормонального статуса в аспекте выявленных нарушений репродуктивного здоровья. Был проведен анализ некоторых параметров гормонального статуса у подростков с гипогонадизмом, варикоцеле, сперматоцеле, гинекомастией (табл. 7).
| Показатель | Группа сравнения | Мальчики-подростки с ожирением | |||
|---|---|---|---|---|---|
| гипогонадизм | сперматоцеле | варикоцеле | гинекомастия | ||
| Тестостерон, нмоль/л | 15,5±1,5 | 4,67±0,43* | 13,67±1,2 | 12,67±1,05 | 12,1±1,25 |
| Эстрадиол, пг/мл | 47,4±5,3 | 69,7±11,2* | 59,9±6,4 | 65,4±6,4* | 72,3±6,4* |
| ЛГ, мМе/мл | 1,8±0,24 | 1,7±0,6 | 3,39±0,6* | 3,04±0,5* | 5,2±0,6* |
| ФСГ, мМе/мл | 3,6±0,21 | 2,4±0,9 | 7,42±0,7* | 6,98±0,6* | 7,56±0,7* |
| Пролактин, мМе/мл | 198±24,5 | 400,55±57,45* | 330,01±62,5* | 352,01±47,2* | 428,1±52,6* |
| Кортизол, нмоль/л, | 477,8±21,8 | 438,6±54,0 | 502,0±52,2 | 512,2±48,4 | 558,8±44,2* |
| ДГЭА-с, мкг/мл | 2,5±0,33 | 2,22±0,3 | 2,3±0,23 | 2,42±0,14 | 2,62±0,11 |
Примечание. * - достоверные различия с группой контроля р<0,05.
В группе мальчиков-подростков с гипогонадизмом уровни гонадотропинов ЛГ и ФСГ не превышали аналогичные значения в группе сравнения. Однако отмечалась выраженная тенденция к повышению уровня ФСГ ("гипогонадизм" 2,4±0,9 мМе/мл vs. "группа сравнения" 3,6±0,21 мМе/мл; p<0,07). Уровень пролактина в исследуемой клинической группе достоверно превышал показатели группы сравнения в 2,03 раза. Установлено достоверное снижение уровня тестостерона в 3,32 раза. При этом, показатели эстрадиола достоверно, в 1,47 раза превышали аналогичные показатели в группе сравнения, что, вероятно, объясняется более интенсивным превращением тестостерона в эстрадиол на периферии и может быть следствием увеличенной выработки эстрогенов клетками семенных канальцев [1, 9]. Уровни гормонов надпочечников - кортизола, ДГЭА-с не превышали аналогичных значений в группе сравнения. Выявленные особенности гормонального статуса пациентов данной группы сходны с гормональным портретом мужчин с нормотропным гипогонадизмом, патогенез которого пока еще недостаточно изучен [1, 9]. При этой патологии яички не способны адекватно ответить на физиологическую стимуляцию, а на уровне гипоталамо-гипофизарной системы нарушен механизм обратной связи. Необходимо отметить, что при гиперпролактинемии нарушается превращение тестостерона в дигидротестостерон в периферических тканях, повышается связывание тестостерона с глобулином, нарушается стимулированная ЛГ секреция тестостерона, уменьшается секреция ФСГ, нарушается механизм обратной связи между уровнем эстрогенов и секрецией гонадотропинов [9, 15].
У подростков с орхопатологией наименее выраженные изменения со стороны гормонального профиля отмечались в группе со сперматоцеле. Зарегистрировали достоверное повышение уровней гонадотропинов - ЛГ, ФСГ, пролактина в 1,89-, 2,07-, 1,67 раза, соответственно.
При варикоцеле, помимо повышения уровней ЛГ, ФСГ, пролактина, отмечалось достоверное повышение уровня эстрадиола в 1,38 раза. В исследованиях [4] у мальчиков с варикоцеле и нормальной массой тела не выявлено значимых отклонений уровней гонадотропинов (ЛГ, ФСГ) в течение всего периода наблюдения (до- и после оперативного лечения). Следует отметить, что по данным авторов [5] наиболее значимым в прогностическом аспекте является тот факт, что морфологическая картина варикоцеле имеет свои неблагоприятные особенности: атипичные формы канальцев эмбрионального типа, раннее угнетение сперматогенеза. Таким образом, полученные нами данные о значимом нарушении функции гипофизарно-гонадной оси свидетельствуют, что наличие ожирения у мальчиков с варикоцеле является более неблагоприятным в прогностическом отношении фактором становления репродуктивного здоровья, в сравнении с аналогичной формой орхопатии у подростков с нормальной массой тела.
У мальчиков-подростков с гинекомастией повышение уровней гонадотропинов - ЛГ, ФСГ, пролактина имело более выраженный характер по сравнению с пациентами других групп, и достоверно отличалось от значений в группе сравнения в 2,89, 2,1, 2,17 раза, соответственно. Уровень тестостерона не имел достоверных отличий, но при этом зарегистрировали достоверное повышение уровня эстрадиола в 1,53 раза, что соответствует данным ряда авторов [11].
Необходимо отметить, что показатели гормонов надпочечников (кортизол и ДГЭА-с) во всех исследуемых группах пациентов не имели достоверной разницы от значений в группе сравнения. Исключение составил уровень кортизола у пациентов с гинекомастией, исследуемые параметры которого достоверно превышали аналогичные показатели в группе сравнения. Можно предположить, что у этой группы подростков имелась гиперфункция гипофизарно-адреналовой системы и, по-видимому, связанная с ней дискорреляция в системе гипоталамус - гипофиз - половые железы. Избыток адреналовых стероидов может снижать чувствительность половых желез к ЛГ, с уменьшением синтеза тестостерона и реципрокным повышением уровня ЛГ. Однако возможен и центральный механизм действия на уровне гипоталамуса или гипофиза с нарушением секреции ФСГ [7, 9].
Таким образом, ожирение у мальчиков-подростков сопровождается не только изменениями в функциональной активности звеньев эндокринной системы, но и нарушениями со стороны становления репродуктивного статуса с реализацией в структурную андрологическую патологию. Мультидисциплинарное персонализированное наблюдение с участием педиатров, урологов-андрологов и эндокринологов, включая комплексное своевременное обследование функции гипоталамо-гипофизарно-гонадной системы при ожирении, своевременная коррекция выявленных нарушений является необходимым условием для обеспечения правильного развития подрастающего поколения в аспекте демографической стабилизации и укрепления репродуктивного здоровья нации.
Литература |
 |
 1. Алексеева М.Л., Екимова Е.В., Колодько В.Г. и др. Регуляция репродукции и алгоритмы диагностики ее нарушений // Проблемы репродукции. - 2007. - № 3. - С. 15-24.
1. Алексеева М.Л., Екимова Е.В., Колодько В.Г. и др. Регуляция репродукции и алгоритмы диагностики ее нарушений // Проблемы репродукции. - 2007. - № 3. - С. 15-24.  2. Вербицкая О.Г., Попова В.А., Афонин А.А., и др. Исследование маркеров нарушений функционирования репродуктивной системы у мальчиков и подростков, страдающих ожирением // Педиатрия. - 2014. - Т. 93, № 2. - С. 145-146.
2. Вербицкая О.Г., Попова В.А., Афонин А.А., и др. Исследование маркеров нарушений функционирования репродуктивной системы у мальчиков и подростков, страдающих ожирением // Педиатрия. - 2014. - Т. 93, № 2. - С. 145-146. 3. Ефимова Н.В., Штыкова О.В., Киселева О.А. Состояние соматического и репродуктивного здоровья современных подростков по результатам углубленной диспансеризации // Современные проблемы науки и образования. - 2015. - № 5. - Режим доступа: http://www.science-education.ru/ru/article/view?id=21892 (дата обращения 20.05.2016 г.).
3. Ефимова Н.В., Штыкова О.В., Киселева О.А. Состояние соматического и репродуктивного здоровья современных подростков по результатам углубленной диспансеризации // Современные проблемы науки и образования. - 2015. - № 5. - Режим доступа: http://www.science-education.ru/ru/article/view?id=21892 (дата обращения 20.05.2016 г.). 4. Каневская Т.А., Яцык С.П., Абрамов К.С., Шарков С.М., Фомин Д.К. Репродуктивное здоровье детей и подростков, перенесших хирургическую коррекцию в связи с андрологической патологией // Педиатрическая фармакология. - 2009. - Т. 6, № 1. - С. 15-22.
4. Каневская Т.А., Яцык С.П., Абрамов К.С., Шарков С.М., Фомин Д.К. Репродуктивное здоровье детей и подростков, перенесших хирургическую коррекцию в связи с андрологической патологией // Педиатрическая фармакология. - 2009. - Т. 6, № 1. - С. 15-22. 5. Кондаков В.Т., Пыков М.И. Варикоцеле. - М.: Видар, 2000. - 99 с.
5. Кондаков В.Т., Пыков М.И. Варикоцеле. - М.: Видар, 2000. - 99 с. 6. Рекомендации по диагностике, лечению и профилактике ожирения у детей и подростков. - М.: Практика, 2015. - 136 с.
6. Рекомендации по диагностике, лечению и профилактике ожирения у детей и подростков. - М.: Практика, 2015. - 136 с. 7. Смирнов В.В., Саакян Л.Д. Гинекомастия у детей и подростков // Лечащий врач. - 2014. - С. 38.
7. Смирнов В.В., Саакян Л.Д. Гинекомастия у детей и подростков // Лечащий врач. - 2014. - С. 38.  8. Солодилова Е.А., Кондратьева Е.И., Кравец Е.Б., Горбатенко Е.В. особенности полового созревания у мальчиков с ожирением // Кубанский научный медицинский вестник. - 2011. - № 3 (126). - С. 158-164.
8. Солодилова Е.А., Кондратьева Е.И., Кравец Е.Б., Горбатенко Е.В. особенности полового созревания у мальчиков с ожирением // Кубанский научный медицинский вестник. - 2011. - № 3 (126). - С. 158-164.  9. Руководство по андрологии / Под ред. Тиктинского О.Л. - Л.: Медицина, 1990. - 416 с.
9. Руководство по андрологии / Под ред. Тиктинского О.Л. - Л.: Медицина, 1990. - 416 с.  10. Chen X., Sekine M., Hamanishi S., Wang H., Gaina A., Yamagami T., Kagamimori S. Lifestyles and health-related quality of life in Japanese schoolchildren: a cross-sectional study // Prev. Med. - 2011. - № 4. - Р. 668-678.
10. Chen X., Sekine M., Hamanishi S., Wang H., Gaina A., Yamagami T., Kagamimori S. Lifestyles and health-related quality of life in Japanese schoolchildren: a cross-sectional study // Prev. Med. - 2011. - № 4. - Р. 668-678.  11. Eren E., Edgunlu T., Korkmaz H.A., Cakir E.D., Demir K., Cetin E.S., Celik S.K. Genetic variants of estrogen beta and leptin receptors may cause gynecomastia in adolescent // Gene. - 2014. - May 15. - Vol. 541, № 2. - Р. 101-106.
11. Eren E., Edgunlu T., Korkmaz H.A., Cakir E.D., Demir K., Cetin E.S., Celik S.K. Genetic variants of estrogen beta and leptin receptors may cause gynecomastia in adolescent // Gene. - 2014. - May 15. - Vol. 541, № 2. - Р. 101-106.  12. Griffiths L.J., Parsons T.J., Hill A.J. Self-esteem and quality of life in obese children and adolescents: a systematic review // Pediatr Obes. - 2010. - № 5. - Р. 282-304.
12. Griffiths L.J., Parsons T.J., Hill A.J. Self-esteem and quality of life in obese children and adolescents: a systematic review // Pediatr Obes. - 2010. - № 5. - Р. 282-304.  13. Irizarry K.A., Brito V., Freemark M. Screening for metabolic and reproductive complications in obese children and adolescents // Pediatr. - 2014. - № 43. - Р. 9.
13. Irizarry K.A., Brito V., Freemark M. Screening for metabolic and reproductive complications in obese children and adolescents // Pediatr. - 2014. - № 43. - Р. 9. 14. Ribeiro S.M., dos Santos Z.A., da Silva R.J., Louzada E., Donato J.Jr., Tirapegui J. Leptin: aspects on energetic balance, physical exercise and athletic amenorrhea // Arq. Bras. Endocrinol. Metabol. - 2007. - № 51 (1). - P. 11-24.
14. Ribeiro S.M., dos Santos Z.A., da Silva R.J., Louzada E., Donato J.Jr., Tirapegui J. Leptin: aspects on energetic balance, physical exercise and athletic amenorrhea // Arq. Bras. Endocrinol. Metabol. - 2007. - № 51 (1). - P. 11-24. 15. Sansone A., Romanelli F., Sansone M., Lenzi A., Di Luigi L. Gynecomastia and hormones // Endocrine. - 2016. - № 4. - P. 1-8.
15. Sansone A., Romanelli F., Sansone M., Lenzi A., Di Luigi L. Gynecomastia and hormones // Endocrine. - 2016. - № 4. - P. 1-8.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»