2016 год № 4
Акушерство и гинекология
2КГБУЗ "Родильный дом № 2" министерства здравоохранения Хабаровского края, 680020, пер. Казарменный, 4, тел./факс 8-(4212)-21-25-42, e-mail: kgbuz@rd2khv;
3КГБОУ ВПО "Институт повышения квалификации специалистов здравоохранения" министерства здравоохранения Хабаровского края, 680009, ул. Краснодарская, 9, тел./факс 8-(4212)-72-87-15, e-mail: rec@ipksz.khv.ru, г. Хабаровск
Резюме:
Ключевые слова:
2Regional state budget institution Health "Maternity Hospital № 2" of the Ministry of Health of the Khabarovsk Territory;
3Territorial State Budget Educational Institution of Additional Professional Education "Postgraduate Institute for Public Health Workers", Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Фолатный цикл представляет собой сложный каскадный процесс, контролируемый ферментами, которые в качестве коферментов имеют производные фолиевой кислоты. Ключевым энзимом является 5,10-метилентетрагидрофолат-редуктаза (MTHFR), которая переводит фолиевую кислоту в ее активную форму. Ген MTHFR, контролирующий данные реакции, локализуется на коротком плече хромосомы 1 (1р36.3) и состоит из 11 экзонов. Миссенс-мутация (точечная мутация) С677Т, связанная с замещением цитозина на тимин в положении 677, вызывает замену аланина на валин (p.Ala222Val) в каталитическом домене белка-фермента, приводя к снижению его активности у гомозиготного варианта по полиморфному аллелю на 70 %, у гетерозиготных генотипов - на 35-50 %. Именно снижение активности данного фермента - одна из важных причин накопления гомоцистеина в организме [4, 5, 8, 10, 12, 13].
Мутантные генотипы MTHFR по 677 позиции, особенно в сочетании с низким уровнем фолатов, могут выступать как потенциальный фактор риска развития изменений репродуктивной функции: при бесплодии, невынашивании беременности, при фетоплацентарной недостаточности, преэклампсии, задержке развития и формировании пороков развития плода. Среди целого спектра механизмов нарушения фертильности можно обозначить как эффекты гипергомоцистеинемии, так и изменения процессов метилирования ДНК в соматических и половых клетках [1, 2, 6, 7, 9, 12, 14, 15].
Цель исследований - определение частоты встречаемости, структуры полиморфизма гена фолатного цикла (MTHFR) у женщин пришлого и коренного населения Приамурья и оценка течения беременности для оптимизации диагностических и лечебно-профилактических мероприятий.
Материалы и методы
|
 |
 |
Для изучения распространенности полиморфизмов гена MTHFR нами было обследовано 460 беременных женщин пришлого и коренного населения, проживающих в условиях городской (г. Хабаровск) и сельской (Нанайский район) местностях Приамурья, вставших на учет в женских консультациях на ранних сроках гестации, методом случайной выборки. На основе заполнения "Паспорта будущих родителей" все женщины были разделены на группы: городские пришлые (289 человек), сельские пришлые (92 человека) европеоидной расы и сельские коренные (79 человек) монголоидной расы - нанайки (нанайцы - народ, относящийся к коренному населению бассейна Амура (прежнее название - гольды)).
Исследования соответствовали разработанным программам, утвержденных этическим комитетом Хабаровского филиала ДНЦ ФПД-НИИОМиД с информированным добровольным согласием пациентов. При лабораторном обследовании проводился забор венозной крови в утренние часы, натощак. Исследования полиморфизма генов фолатного цикла состояли из двух этапов: пробоподготовки и непосредственного определения методом ПЦР в реальном времени (Real-Time PCR) с использованием мультитестовой системы "Генетика метаболизма фолатов" производства фирмы "ДНК-технология". Для оценки распределения полиморфных вариантов гена MTHFR применялисьосновные критерии диагностики в виде 3 генотипов: нормальный гомозиготный генотип (СС), мутантные генотипы гетерозиготный (СТ) и гомозиготный (ТТ).
Клиническая характеристика течения беременности проводилась на примере пришлого городского населения на базе Краевого государственного бюджетного учреждения здравоохранения "Родильный дом № 2" министерства здравоохранения Хабаровского края (г. Хабаровск) по разработанной карте с учетом используемых стандартов "Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология" (2012 г.). Динамику течения беременности во всех трех триместрах удалось проследить у 208 пациенток.
Статистическую обработку полученных данных проводили с использованием программных средств пакета "Statistica" (версия 10).
Результаты и обсуждение
|
 |
 |
Проведенная сравнительная характеристика по частоте встречаемости полиморфизмов гена метилентетрагидрофолатредуктазы (MTHFR) выявила их особенности у обследуемых беременных.
У женщин городского пришлого населения гомозиготный нормальный (СС) и гетерозиготный мутантный (СТ) генотипы встречались практически в равных долях (47,4 % и 46,7 %) соответственно (рисунок).
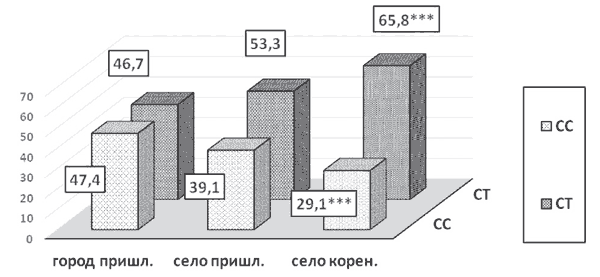
Рис. Частота встречаемости (%) нормального гомозиготного (СС) и мутантного гетерозиготного (СТ) вариантов полиморфизма гена MTHFR (С677Т) у женщин пришлого и коренного населения
У женщин сельского пришлого населения в 1,4 раза преобладал гетерозиготный генотип (СТ) - 53,3 % в сравнении с гомозиготным нормальным генотипом (СС) - 39,1 %. Особенностью сельского коренного населения (нанайки) являлось достоверное увеличение (в 2,3 раза) частоты встречаемости гетерозиготного генотипа (СТ).
Достоверных различий в показателях мутантного гомозиготного (ТТ) генотипов MTHFR у беременных пришлого городского и сельского населения не обнаружено.
Нами проведен анализ и дана сравнительная характеристика течения беременности с учетом выявленных измененных генотипов по периодам гестации.
Такое осложнение как рвота беременных (токсикоз) в 1-м триместре встречалось во всех наблюдаемых группах с различной частотой. У женщин с мутантным гомозиготным генотипом MTHFR данное состояние отмечалось в 1,4 раза чаще (50,0 %), чем у женщин с мутантным гетерозиготным (35,6 %) и в 1,7 раза с нормальным (29,3 %) вариантами. Высокий риск развития плацентарной недостаточности зарегистрирован у пациенток при мутантном гомозиготном варианте (41,7 %), что в 1,5 раза выше показателей с нормальным генотипом (28,3 %). Такая же тенденция отмечена и для анемических состояний уже на ранних сроках беременности: у лиц, гомозиготных по данной мутации, клинико-лабораторные признаки выявлялись достоверно чаще (16,7 %) в сравнении с группой с нормальным генотипом (7,6 %).
При обследовании взятых на учет беременных выявлено, что только 5,4 % из них можно считать практически здоровыми. Преобладающее большинство женщин страдали соматической патологией, наиболее часто встречалась патология желудочно-кишечного тракта (50,5 %). На втором месте по частоте встречаемости находилась патология нервной системы в виде соматоформной дисфункции вегетативной нервной системы (32,4 %). Женщины, страдающие заболеваниями мочевыделительной системы, составили 26,0 %. У 35,8 % беременных женщин отмечался отягощенный аллергологический анамнез. По поводу патологии щитовидной железы наблюдались 21,6 % женщин. Только 11,8 % обследованных знали о факте наличия анемии до беременности. У 6,4 % женщин в анамнезе отмечались различные кровотечения (носовые, желудочно-кишечные и другие). В связи с этим при наличии гетерозиготных мутаций у женщин в 1 триместре обострение хронической патологии (16,3 %) встречалось в 3 раза чаще (p<0,05) в сравнении с нормальным генотипом (5,4 %).
Особенно важен тот факт, что у беременных с гомозиготным мутантным генотипом более часто (8,3 %), в 7,5 раз, чем при нормальном полиморфизме гена MTHFR (1,1%) были выявлены маркеры врожденных пороков развития плода (p<0,05).
Оценка течения беременности второго триместра у наблюдаемых женщин представлена следующими данными. У пациенток, носителей гетерозиготного варианта MTHFR в 1,4 раза чаще отмечалась угроза прерывания беременности (32,7 %), в 2,6 раза - отеки беременных (8,7 %) и в 1,3 раза более частые ОРВИ (27,9 %) в сравнении с группой с нормальным генотипом (23,9 %, 3,3 %, 21,7 % соответственно). Группа женщин с мутантным гомозиготным вариантом гена MTHFR характеризовалась формированием анемических состояний у 66,7 % беременных, что в 1,6 чаще, чем у женщин с гетерозиготным (41,3 %) и с нормальным (43,5 %) генотипами. Во время 2-го УЗИ-скрининга в 8,3 % случаев подтвердились врожденные пороки развития плода у беременных с мутантным гомозиготным полиморфизмом.
В третьем триместре у женщин с гетерозиготным вариантом гена MTHFR сохранялась угроза прерывания беременности у 21,2 % женщин, что в 1,6 раза чаще, чем с нормальным гомозиготным генотипом (13,0 %). Практически с той же частотой, как и на более ранних сроках, у женщин в третьем триместре встречались перенесенные ОРВИ (22,1 %) и обострения хронической патологии (19,2 %) при наличии мутантных гетерозигот, что в 1,4-1,5 раз чаще, чем в группе пациенток без мутаций по данному гену. Результатом осложненного течения беременности на фоне мутантного гомозиготного генотипа MTHFR являются диагностируемая внутриутробная гипоксия (33,3 %), задержка внутриутробного развития плода (8,3 %) и сформированные пороки у детей.
В связи с тем, что мутации MTHFR играют определенную роль в развитии акушерских осложнений и репродуктивных потерь, полученные нами результаты имеют диагностическую значимость и требует персонифицированного подхода к проведению лечебно-профилактических мероприятий. Необходимо включение данных исследований в диагностический алгоритм на этапе прегравидарной подготовки или в ранние сроки гестации при постановке на учет в женских консультациях для формирования групп риска, что позволит проводить патогенетически обоснованную и своевременную коррекцию выявленных гестационных нарушений.
Литература |
 |
 1. Абдулраб А.С. Роль тромбофилии в развитии синдрома задержки роста плода: автореф. … дис. канд. мед. наук. - М., 2006. - 22 с.
1. Абдулраб А.С. Роль тромбофилии в развитии синдрома задержки роста плода: автореф. … дис. канд. мед. наук. - М., 2006. - 22 с. 2. Бескоровайная Т.С. Влияние некоторых генетических факторов на нарушение репродукции у человека: дис. … канд. мед. наук. - М., 2005. - С. 89.
2. Бескоровайная Т.С. Влияние некоторых генетических факторов на нарушение репродукции у человека: дис. … канд. мед. наук. - М., 2005. - С. 89. 3. Гречанина Е.Я. Законамерная связь между развитием некоторых эпигенетических болезней и нарушением метилирования ДНК вследствие дефецита ферментов фолатного цикла // Ультразвукова перинатальна діагностика. - 2010. - № 29. - С. 27-59.
3. Гречанина Е.Я. Законамерная связь между развитием некоторых эпигенетических болезней и нарушением метилирования ДНК вследствие дефецита ферментов фолатного цикла // Ультразвукова перинатальна діагностика. - 2010. - № 29. - С. 27-59. 4. Доброхотова Ю.Э., Джобава Э.М., Аминтаева Л.А. и соавт. Эндотелиальная дисфункция: гомоцистеин и оксид азота у беременных групп высокого риска. Современные подходы к терапии. Роль фолиевой кислоты // Проблемы репродукции. - 2010. - № 6. - С. 98-103.
4. Доброхотова Ю.Э., Джобава Э.М., Аминтаева Л.А. и соавт. Эндотелиальная дисфункция: гомоцистеин и оксид азота у беременных групп высокого риска. Современные подходы к терапии. Роль фолиевой кислоты // Проблемы репродукции. - 2010. - № 6. - С. 98-103. 5. Доброхотова Ю.Э., Джобава Э.М., Степанян А.В. и соавт. Синдром привычной потери беременности у пациенток с истмико-цервикальной недостаточностью. Современный комплексный подход к диагностике и терапии // Проблемы репродукции. - 2011. - № 3. - С. 98-104.
5. Доброхотова Ю.Э., Джобава Э.М., Степанян А.В. и соавт. Синдром привычной потери беременности у пациенток с истмико-цервикальной недостаточностью. Современный комплексный подход к диагностике и терапии // Проблемы репродукции. - 2011. - № 3. - С. 98-104.  6. Калашникова Е.А., Кокаровцева С.Н.,Бабадаева Н.М. и соавт. Полиморфизм гена МТГФР С 677Т и гипергомоцистеинемия у пациентов с потерей беременности и венозными тромбозами // Терапевтический архив. - 2006. - № 6. - С. 70-76.
6. Калашникова Е.А., Кокаровцева С.Н.,Бабадаева Н.М. и соавт. Полиморфизм гена МТГФР С 677Т и гипергомоцистеинемия у пациентов с потерей беременности и венозными тромбозами // Терапевтический архив. - 2006. - № 6. - С. 70-76. 7. Кох Н.В., Воронина Е.Н., Пасман Н.М., Филипенко М.Л. Исследование влияния генетической предрасположенности к тромбофилии на течение беременности // Вестник НГУ: Серия: Биология, клиническая медицина. - 2008. - Т. 6, № 2. - С. 20-24.
7. Кох Н.В., Воронина Е.Н., Пасман Н.М., Филипенко М.Л. Исследование влияния генетической предрасположенности к тромбофилии на течение беременности // Вестник НГУ: Серия: Биология, клиническая медицина. - 2008. - Т. 6, № 2. - С. 20-24. 8. Лебеденкова М.В. Клиническое значение гипергомоцистеинемии в прогрессировании нефропатий // Нефрология и диализ. - 2006. - № 4. - С. 329-335.
8. Лебеденкова М.В. Клиническое значение гипергомоцистеинемии в прогрессировании нефропатий // Нефрология и диализ. - 2006. - № 4. - С. 329-335.  9. Михайлин Е. С. Встречаемость некоторых наследственных тромбофилий при гестозе и преждевременной отслойке нормально расположенной плаценты // Медицинская генетика. - 2005. - № 5. - С. 63-66.
9. Михайлин Е. С. Встречаемость некоторых наследственных тромбофилий при гестозе и преждевременной отслойке нормально расположенной плаценты // Медицинская генетика. - 2005. - № 5. - С. 63-66. 10. Тапильская Н.И., Гайдуков С.Н. Устранение дефицита фолатов - основная стратегия коррекции гомоцистеинзависимой эндотелиальной дисфункции // Гинекология. - 2013.- № 3. - С. 70-74.
10. Тапильская Н.И., Гайдуков С.Н. Устранение дефицита фолатов - основная стратегия коррекции гомоцистеинзависимой эндотелиальной дисфункции // Гинекология. - 2013.- № 3. - С. 70-74. 11. Трифонова, Е.А. Генетичекое разнообразие и структура галлотипов локуса MTHFR в якутской популяции // Якутский медицинский журнал. - 2009. - № 2 (26). - С. 42-45.
11. Трифонова, Е.А. Генетичекое разнообразие и структура галлотипов локуса MTHFR в якутской популяции // Якутский медицинский журнал. - 2009. - № 2 (26). - С. 42-45. 12. Ходжаева З.С., Блинецкая С.Л. Мутация гена MTHFR С677Т и синдром репродуктивных потерь // Вестник Российского университета дружбы народов. - 2009. - № 6. - С. 339-343.
12. Ходжаева З.С., Блинецкая С.Л. Мутация гена MTHFR С677Т и синдром репродуктивных потерь // Вестник Российского университета дружбы народов. - 2009. - № 6. - С. 339-343.  13. Ших Е.В., Махова А.А. Преимущества проведения коррекции фолатного статуса с использованием витаминно-минерального комплекса, содержащего метафолин // Трудный пациент. - 2013. - № 8-9. - С. 20-26.
13. Ших Е.В., Махова А.А. Преимущества проведения коррекции фолатного статуса с использованием витаминно-минерального комплекса, содержащего метафолин // Трудный пациент. - 2013. - № 8-9. - С. 20-26. 14. Hobbs C.A. Polymorphismsin Genes Involvedin Folate Metabolismas Maternal Risk Factors for Down Syndrome / C.A. Hobbs, S.L. Sherman, P. Yi, et al. // Am. J. Hum. Genet. - 2000. - Vol. 67. - P. 623-630.
14. Hobbs C.A. Polymorphismsin Genes Involvedin Folate Metabolismas Maternal Risk Factors for Down Syndrome / C.A. Hobbs, S.L. Sherman, P. Yi, et al. // Am. J. Hum. Genet. - 2000. - Vol. 67. - P. 623-630. 15. Zetterberg H. No association between the MTHFR A1298C and transcobalamin C776G genetic polymorphisms and hyperhomocysteinemia in thrombotic disease / H. Zetterberg, A. Coppola, A. D'Angelo, et al. // Thromb. Res. - 2002. - Vol. 108. - P. 127-131.
15. Zetterberg H. No association between the MTHFR A1298C and transcobalamin C776G genetic polymorphisms and hyperhomocysteinemia in thrombotic disease / H. Zetterberg, A. Coppola, A. D'Angelo, et al. // Thromb. Res. - 2002. - Vol. 108. - P. 127-131.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»