2016 год № 4
Обзоры литературы
Резюме:
Ключевые слова:
Summary:
Key words:
Введение |
 |
 |
Приобретенный иммунитет имеет широкий потенциал для ответных реакций на инфекционные агенты, встречающиеся в течение жизни. Главную роль в реализации этих реакций играют Т лимфоциты. Активация Т клеточных рецепторов имеет большое значение в развитии клеток, пролиферации, клеточной гибели, продукции цитокинов, дифференциации Т клеток и в целом сохранении гомеостаза. Эти функции во многом зависят от регуляции клеточной сигнализации [6, 21]. Ключевым медиатором Т клеточной сигнализации является внутриклеточный кальций (Ca2+), который контролирует многочисленные клеточные процессы. Динамика и характер изменения концентрации Ca2+, в виде распространяющихся волн, когерентных осцилляций активирует физиологические функции лимфоцитов. Амплитуда и пространственно - временной профиль локализующихся сигналов обусловливает экспрессию генов [23]. Механизм, который приводит к экспрессии генов, связан с высвобождением Ca2+ через кальций - селективные каналы в плазматической мембране, после истощения внутриклеточных кальциевых депо. Депо - зависимый ток Ca2+ в клетки осуществляется за счет активности белков семейства stromal interaction molecule (Stim) и Orai [29, 4, 15, 24, 19]. Интеграция белков Stim и Orai приводит к активации факторов транскрипции NFAT, NF-kB, AP-1, экспрессии иммуномодулирующих цитокинов и иммунному ответу [10, 1, 3, 4].
Вследствие этого, представляется важным в настоящем обзоре рассмотреть механизмы кальциевой сигнализации в лимфоцитах, способы регуляции транскрипции генов провоспалительных цитокинов.
Обсуждение
|
 |
 |
Активация лимфоцитов
Активация лимфоцитов довольно сложный процесс, в котором осуществляется ряд реакций, приводящих к клеточному делению и дифференцировке. Ключевым событием в инициации этих реакций является взаимодействие рецепторов лимфоцитов с главным комплексом гистосовместимости на поверхности антиген - представляющих клеток и формирование иммунологического синапса [20]. Иммунологический синапс - это крупная функциональная структура, обеспечивающая адгезию клеток, реорганизацию цитоскелета и передачу сигналов [17]. В результате, индуцируется фосфоинозитол - сигнальный каскад биохимических реакций в плазматической мембране, приводящий к активации адаптерных молекул и тирозинкиназ. Они фосфорилируют и активируют фосфолипазу Сγ1 в Т клетках [21]. Фосфолипаза Сγ1 является ключевым ферментом в фосфоинозитол-сигнальном каскаде реакций. Этот фермент, локализуясь в плазматической мембране, контролирует уровень фосфотидилинозитол-3,4-бифосфата в клетках и катализирует его гидролиз в ответ на клеточные стимулы.
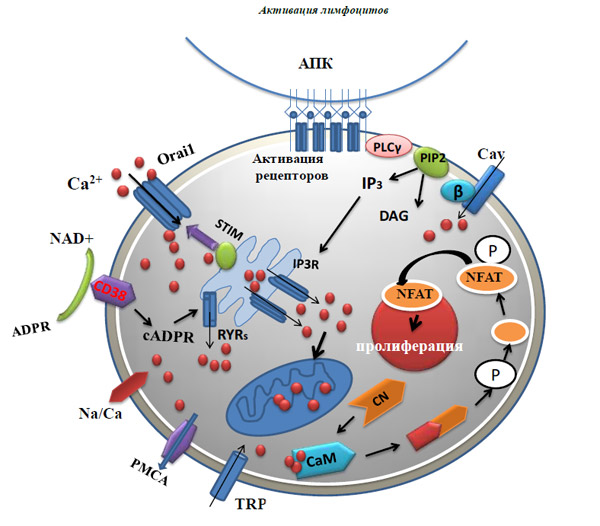
Рис. 1. Кальциевая сигнализация в лимфоцитах
АПК - антиген - представляющая клетка, PLCγ - фосфолипаза Сγ, PIP2 - фосфатидилинозитолбифосфат, Cav - потенциал - зависимый канал, P - неорганический фосфат, NFAT - ядерный фактор активации Т клеток, CN - кальцинейрин, CaM - кальмодулин, IP3R - инозитол-1,4,5-трифосфат - чувствительные рецепторы, Na/Ca - натрий/кальциевый насос, PMCA - СaАТФаза плазматической мембраны, RYRs - рианодиновые рецепторы, Stim - белки эндоплазматического ретикулума, белки Orai - поро-образующие субъединицы кальций - селективных каналов.
В процессе гидролиза фосфолипаза Cγ расщепляет PIP2 в плазматической мембране на два вторичных мессенджера: диацилглицерол, и инозитол-1,4,5-трифосфат (InsP3) [10, 29, 18]. Диацилглицерол в слое плазматической мембраны, активирует протеинкиназу С и ras - зависимые пути. InsP3 представляет собой низкомолекулярную водорастворимую молекулу, которая диффундирует из мембраны в цитозоль и там, индуцирует высвобождение Ca2+ из двух депо: эндоплазматического ретикулума и внеклеточной среды [4, 15]. Это приводит к изменению уровня Ca2+ в цитозоле и запуску механизмов кальциевой сигнализации. Таким образом, активация лимфоцитов является кальций-зависимым процессом.
Высвобождение кальция из внутриклеточного депо
Транспорт Ca2+ из депо в цитозоль осуществляется по градиенту концентрации, поскольку уровень кальция значительно ниже в цитозоле (100нМ) чем в депо (100-800мкМ) [10]. Высвобождение Ca2+ из депо в основном опосредовано рецепторами нескольких семейств каналов: инозитол-1,4,5-трифосфат-чувствительными рецепторами (IP3R), пуринергическими рецепторами P2X7, рианодиновыми рецепторами RYRs [24]. Они имеют различный профиль экспрессии, механизм активации и обеспечивают пассивный поток ионов [15].
В мембране эндоплазматического ретикулума лимфоцитов экспрессируется субсемейство белков, которые влияют на уровень кальция в цитозоле IP3R. Эти каналы представляют собой тетрамеры, которые содержат домены, связывающие молекулы IP3 [21]. Взаимодействие IP3 с рецепторами каналов влияет на их открытие и высвобождение Ca2+ из депо [4, 6, 17].
Структурными и функциональными аналогами IP3R являются рианодиновые рецепторы. Это крупные гомотетрамерные субъединицы, образующие три изоформы: RYR1, RYR2, RYR3 [21]. Известно, что рианодиновые рецепторы активируются при повышении уровня циклической АДФ-рибозы, которая продуцируется из β-НАД под действием фермента АДФ - рибозилциклазы - CD38 [8, 13, 22, 26]. В значительном количестве CD38 экспрессируется во время активации лимфоцитов. CD38 катализирует синтез циклической АДФ-рибозы, которая мобилизует Ca2+ из внутриклеточного депо [26, 33].
В Т клетках экспрессируется три изоформы пуринергических рецепторов (P2X1, P2X4, P2X7), реагирующих на изменение уровня внеклеточных пуринов и функционирующих в качестве ионных каналов. Они представляют собой семейство неселективных ионных каналов, которые активируются внеклеточными молекулами АТФ. Открытие этих каналов, особенно P2X7, вызывает приток Ca2+ и активацию пролиферации лимфоцитов [21].
Таким образом, высвобождение Ca2+ из депо вносит относительно небольшой вклад в суммарный кальциевый сигнал по сравнению с током Ca2+ сквозь каналы плазматической мембраны. Этот процесс является триггером более крупного тока Ca2+ по каналам плазматической мембраны в клетку.
Ток Ca2+ по каналам плазматической мембраны
Значительный ток Ca2+ в клетку осуществляется через каналы плазматической мембраны лимфоцитов [7, 9]. К ним относят каналы, активируемые белками Stim и Orai, каналы TRP, потенциал-зависимые кальциевые каналы Cav. Они также имеют различный профиль экспрессии, механизм активации [9, 15]. Лимфоциты на экспрессируют белки семейства TRP: TRPC1, TRPC3, TRPM2, TRPM4, TRPM7, TRPV1, TRPV2. Доказано участие этих каналов в транспорте и гомеостазе внутриклеточного кальция [25]. Во время активации TRP каналов осуществляется деполяризация мембраны с изменением уровня кальция. Так, каналы TRPC3 в активном состоянии регулируют ток Ca2+ в клетку, каналы TRPM4 снижают поступление Ca2+, деполяризуя мембрану, каналы TRPV1 имеют низкую проницаемость для ионов кальция [5, 31].
Лимфоциты экспрессируют потенциал - зависимые каналы Cav L-типа: Cav1.1, Cav1.2, Cav1.3, Cav1.4. Они содержат поро - формирующую субъединицу α и регуляторные β3 и β4 субъединицы и обеспечивают ток Ca2+ внутрь клетки во время активации лимфоцитов [2, 9, 14].
Наибольшее значение в регуляции гомеостаза Ca2+ имеют кальций - селективные каналы. Они отличаются высокой селективностью и низкой кондуктивностью. В основе активации данных каналов лежит механизм депо - зависимого тока Ca2+ в клетки, а именно активация кальций - селективных каналов в ответ на истощение депо [6, 7, 17]. Известно, что молекулярными медиаторами депо - зависимого тока Ca2+ являются семейство белков Stim и Orai. Белки Stim играют роль сенсоров Ca2+ в депо, они во время активации клетки кооперируются с белками Orai. В свою очередь, белки Orai образуют пору в плазматической мембране, через которую осуществляется ток Ca2+ в клетку [17, 19, 24, 28, 6].
Таким образом, координация и регуляция кальциевых сигналов опосредуется молекулярными компонентами кальций - селективных каналов, белками Stim и Orai [21, 29, 30].
Кальциевая сигнализация в реализации иммунного ответа
Основная функция Ca2+ в контроле пролиферации клеток заключается в активации ядерного фактора активации Т клеток (NFAT). В иммунных клетках активированная NFAT оказывает влияние на экспрессию генов, которые опосредуют нарушения генетических программ, включая эффекторы иммунных функций, клеточную пролиферацию и клеточную гибель [3, 6, 11, 12].
В периферических лимфоцитах экспрессируется четыре семейства факторов транскрипции NFAT1-4, особенностью которых является регуляция уровня Ca2+ и кальцинейрина - ключевого элемента в механизме активации NFAT [16, 12, 18]. В цитоплазме покоящихся клеток NFAT обычно находится в фосфорилированной форме [3].
В процессе стимуляции клетки NFAT дефосфорилируется кальцинейрином - кальмодулин - зависимой серин/треонин фосфатазой [32]. В дефосфорилированном состоянии NFAT импортируется в ядро, где кооперируется с кофакторами транскрипции [27]. Во время инактивации механизма сигнализации, кальций - чувствительные киназы в ядре фосфорилируют NFAT, который затем покидает ядро, после чего транскрипция генов прекращается [12]. Длительный период кальциевой сигнализации требуется для индукции пролиферации клеток, поэтому клеткам важно сохранять NFAT в его активной форме [3, 16, 19].
Внутриклеточный кальций функционирует как универсальный вторичный мессенджер в эукариотических клетках, включая клетки иммунной системы. В лимфоцитах кальциевые сигналы индуцируют различные иммунные реакции, от процессов толерантности до активации воспаления, в зависимости от механизма активации кальциевых каналов. Главным образом, процессы кальциевой сигнализации опосредуются в лимфоцитах кальций - селективными каналами, которые активируются по механизму депо - зависимого тока. Это основной механизм передачи пространственных и временных сигналов в лимфоцитах. Значительное изменение уровня внутриклеточного Ca2+ инициирует ядерный фактор активации лимфоцитов и продукцию провоспалительных цитокинов. Напротив, ингибирование депо - зависимого входа кальция в клетки, кальцинейрин / NFAT-зависимых путей вызывает механизмы иммуносупрессии, поэтому модуляция механизмов кальциевой сигнализации широко используется в терапевтических стратегиях иммунных расстройств.
Литература |
 |
 1. Arbabian A., Brouland J., Geґleґbart P., Bobe R., Enouf J., Papp B. Endoplasmic reticulum calcium pumps and cancer // International Union of Biochemistry and Molecular Biology. - 2011. - Vol. 37, № 3. - P. 139-149.
1. Arbabian A., Brouland J., Geґleґbart P., Bobe R., Enouf J., Papp B. Endoplasmic reticulum calcium pumps and cancer // International Union of Biochemistry and Molecular Biology. - 2011. - Vol. 37, № 3. - P. 139-149. 2. Badou A., Jha M.K., Matza D., Flavell R.A Emerging roles of L-type voltage-gated and other calcium channels in T lymphocytes // Frontiers in immunology. - 2013. - Vol. 4. - P. 1-10.
2. Badou A., Jha M.K., Matza D., Flavell R.A Emerging roles of L-type voltage-gated and other calcium channels in T lymphocytes // Frontiers in immunology. - 2013. - Vol. 4. - P. 1-10. 3. Bengsch B., Wherry E.J. The Importance of Cooperation: Partner less NFAT Induces T cell Exhaustion // Immunity. - 2015, № 42. - Р. 203-205.
3. Bengsch B., Wherry E.J. The Importance of Cooperation: Partner less NFAT Induces T cell Exhaustion // Immunity. - 2015, № 42. - Р. 203-205. 4. Berridge M.J. The endoplasmic reticulum: a multifunctional signaling organelle // Cell Calcium. - 2002. - Vol. 32, № 5-6. - P. 235-249.
4. Berridge M.J. The endoplasmic reticulum: a multifunctional signaling organelle // Cell Calcium. - 2002. - Vol. 32, № 5-6. - P. 235-249. 5. Cheng K.T., Ong H.L., Liu X., Ambudkar I.S. Contribution and regulation of TRPC channels in store-operated Ca2+ entry // Current top membranes. - 2013. - № 71. - P. 1-20.
5. Cheng K.T., Ong H.L., Liu X., Ambudkar I.S. Contribution and regulation of TRPC channels in store-operated Ca2+ entry // Current top membranes. - 2013. - № 71. - P. 1-20.  6. Hogan P.G., Rao A. Store-operated calcium entry: Mechanisms and modulation // Biochemical and biophysical research communications. - 2015. - № 460. - P. 40-49.
6. Hogan P.G., Rao A. Store-operated calcium entry: Mechanisms and modulation // Biochemical and biophysical research communications. - 2015. - № 460. - P. 40-49. 7. Hot M. CRAC channels, calcium and cancer // Biochimica et biophysica acta. - 2016. - Vol. 1863, № 6. - P. 1408-1417.
7. Hot M. CRAC channels, calcium and cancer // Biochimica et biophysica acta. - 2016. - Vol. 1863, № 6. - P. 1408-1417. 8. Guse A. H. Calcium mobilizing second messengers derived from NAD // Biochimica et Biophysica Acta. -2015. -Vol. 1854, № 19. - P. 1132-1137.
8. Guse A. H. Calcium mobilizing second messengers derived from NAD // Biochimica et Biophysica Acta. -2015. -Vol. 1854, № 19. - P. 1132-1137. 9. Izquierdo J., Bonilla-Atodia F., Canas C.A., Tobon G.J. Calcium, channels, intracellular signaling and autoimmunity // Reumatologia clinica. - 2014. - Vol. 10, № 1. - P. 43-47.
9. Izquierdo J., Bonilla-Atodia F., Canas C.A., Tobon G.J. Calcium, channels, intracellular signaling and autoimmunity // Reumatologia clinica. - 2014. - Vol. 10, № 1. - P. 43-47. 10. Krebs J., Agella L.B., Michalak M. Ca2+ homeostasis and endoplasmic reticulum stress: an integrated view of calcium signaling // Biochemical and biophysical research communications. - 2015. - № 460. - P. 114-121.
10. Krebs J., Agella L.B., Michalak M. Ca2+ homeostasis and endoplasmic reticulum stress: an integrated view of calcium signaling // Biochemical and biophysical research communications. - 2015. - № 460. - P. 114-121. 11. Lee M.D., Bingham K.N., Mitchell T.Y., Meredith J.L., Rawlings J.S. Calcium mobilization is both required and sufficient for initiating chromatin decondensation during activation of peripheral T-cells // Molecular Immunology. - 2015. - № 63. - Р. 540-549.
11. Lee M.D., Bingham K.N., Mitchell T.Y., Meredith J.L., Rawlings J.S. Calcium mobilization is both required and sufficient for initiating chromatin decondensation during activation of peripheral T-cells // Molecular Immunology. - 2015. - № 63. - Р. 540-549. 12. Macian F. NFAT proteins: key regulators of T cell development and function // Nature publishing group. - 2005. - Vol. 5. - P. 472-484.
12. Macian F. NFAT proteins: key regulators of T cell development and function // Nature publishing group. - 2005. - Vol. 5. - P. 472-484.  13. Magnone M., Nencioni A., Bruzzone S. NAD+ Levels Control T Cell Calcium Signaling and Activation // Messenger. - 2015. - Vol. 4, № 1. - P. 98-103.
13. Magnone M., Nencioni A., Bruzzone S. NAD+ Levels Control T Cell Calcium Signaling and Activation // Messenger. - 2015. - Vol. 4, № 1. - P. 98-103. 14. Matza C.D., Badou A., Klemic K.G., Stein J., Govindarajulu U., Nadler M.J., Kinet J.P., Peled A., Shapira O.M., Kaczmarek L.K., Flavell R.E. T cell receptor mediated calcium entry requires alternatively spliced Cav1.1 // PLOS ONE. - 2016. - Vol. 11, № 1. - P. 1-17.
14. Matza C.D., Badou A., Klemic K.G., Stein J., Govindarajulu U., Nadler M.J., Kinet J.P., Peled A., Shapira O.M., Kaczmarek L.K., Flavell R.E. T cell receptor mediated calcium entry requires alternatively spliced Cav1.1 // PLOS ONE. - 2016. - Vol. 11, № 1. - P. 1-17. 15. Nohara L.L., Stanwood S.R., Omilusik K.D. Jefferies W.A. Tweeters, woofers and horns: the complex orchestration of calcium currents in T lymphocytes // Front. Immunol. - 2015. - Vol. 6, № 234. - P. 1-9.
15. Nohara L.L., Stanwood S.R., Omilusik K.D. Jefferies W.A. Tweeters, woofers and horns: the complex orchestration of calcium currents in T lymphocytes // Front. Immunol. - 2015. - Vol. 6, № 234. - P. 1-9. 16. Pan M., Xiong Y., Chen F. NFAT gene family in inflammation and cancer // Curr. Mol. Med. - 2013. - № 4. - P. 543-554.
16. Pan M., Xiong Y., Chen F. NFAT gene family in inflammation and cancer // Curr. Mol. Med. - 2013. - № 4. - P. 543-554. 17. Prakriya М. Store-Operated Orai channels: Structure and Function // Published by Elsevier. - 2013. - Vol. 71. -P. 1-3.
17. Prakriya М. Store-Operated Orai channels: Structure and Function // Published by Elsevier. - 2013. - Vol. 71. -P. 1-3. 18. Putney J.W. Calcium Signaling: Deciphering the Calcium-NFAT Pathway // Current Biology. - 2011. - Vol. 22, № 3. - P. 87-89.
18. Putney J.W. Calcium Signaling: Deciphering the Calcium-NFAT Pathway // Current Biology. - 2011. - Vol. 22, № 3. - P. 87-89. 19. Putney J. W. Pharmacology of store-operated calcium signaling // Molecular interventions. - 2010. - Vol. 10, № 4. -P. 209-218.
19. Putney J. W. Pharmacology of store-operated calcium signaling // Molecular interventions. - 2010. - Vol. 10, № 4. -P. 209-218. 20. Randriamampita C., Lellouch A. Imaging early signaling events in T lymphocytes with fluorescent biosensors // Biotechnology. - 2014. - № 9. - P. 203-212.
20. Randriamampita C., Lellouch A. Imaging early signaling events in T lymphocytes with fluorescent biosensors // Biotechnology. - 2014. - № 9. - P. 203-212. 21. Robert V., Triffaux E., Savignac M., Pelletier L. Calcium signaling in T-lymphocytes // Biochimie. - 2011. - № 93. - P. 2087-2094.
21. Robert V., Triffaux E., Savignac M., Pelletier L. Calcium signaling in T-lymphocytes // Biochimie. - 2011. - № 93. - P. 2087-2094. 22. Rosen D., Bloor-Young D., Squires J., Parkesh R., Waters G., Vasudevan S.R, Lewis A.M., Churchill G.C. Synthesis and use of cell-permeant cyclic ADP-ribose // Biochemical and Biophysical Research Communications. - 2012. - № 418. - P. 353-358.
22. Rosen D., Bloor-Young D., Squires J., Parkesh R., Waters G., Vasudevan S.R, Lewis A.M., Churchill G.C. Synthesis and use of cell-permeant cyclic ADP-ribose // Biochemical and Biophysical Research Communications. - 2012. - № 418. - P. 353-358. 23. Rüdiger S. Stochastic models of intracellular calcium signals // Physics Reports. - 2014. - № 534. - P. 39-87.
23. Rüdiger S. Stochastic models of intracellular calcium signals // Physics Reports. - 2014. - № 534. - P. 39-87. 24. Sammels E., Parys J.B., Missiaen L., Smedt H.D., Bultynck G. Intracellular Ca2+ storage in health and disease: A dynamic equilibrium // Cell Calcium . - 2010. - № 47. - P. 297-314.
24. Sammels E., Parys J.B., Missiaen L., Smedt H.D., Bultynck G. Intracellular Ca2+ storage in health and disease: A dynamic equilibrium // Cell Calcium . - 2010. - № 47. - P. 297-314. 25. Santoni G., Farfariello V., Liberati S., Morelli M.B., Nabissi M., santoni M., Amantini C. The role of transient receptor potential type-2 ion channels in innate and adaptive immune responses // Frontiers in immunology. - 2013. - Vol. 4, № 34. - P. 1-9.
25. Santoni G., Farfariello V., Liberati S., Morelli M.B., Nabissi M., santoni M., Amantini C. The role of transient receptor potential type-2 ion channels in innate and adaptive immune responses // Frontiers in immunology. - 2013. - Vol. 4, № 34. - P. 1-9. 26. Schmid F., Bruhn S., Weber K., Mittrücker H. Guse A CD38: A NAADP degrading enzyme // FEBS . - 2011. - Vol. 585. - P. 3544-3548.
26. Schmid F., Bruhn S., Weber K., Mittrücker H. Guse A CD38: A NAADP degrading enzyme // FEBS . - 2011. - Vol. 585. - P. 3544-3548. 27. Shou J., Jing J., Xie J.,You L., Jing Z., Yao J., Han W., Pan H. Nuclear factor of activated T cells in cancer development and treatment // Cancer Letters. - 2015. - Vol. 361, № 2. - P. 174-184.
27. Shou J., Jing J., Xie J.,You L., Jing Z., Yao J., Han W., Pan H. Nuclear factor of activated T cells in cancer development and treatment // Cancer Letters. - 2015. - Vol. 361, № 2. - P. 174-184. 28. Smyth J.S., Hwang S., Tomita T, DeHaven W.I., Mercer J.C., Putney J.W. Activation and regulation of store-operated calcium entry // Journal of Cellular and Molecular Medicine. - 2010. - Vol. 14, № 10. - P. 2337-2349.
28. Smyth J.S., Hwang S., Tomita T, DeHaven W.I., Mercer J.C., Putney J.W. Activation and regulation of store-operated calcium entry // Journal of Cellular and Molecular Medicine. - 2010. - Vol. 14, № 10. - P. 2337-2349. 29. Soboloff J., Rothberg B.S., Madesh M., Gill D.L. Stim proteins: dynamic calcium signal transducers // Nature. - 2012. - Vol. 13. - P. 549-565.
29. Soboloff J., Rothberg B.S., Madesh M., Gill D.L. Stim proteins: dynamic calcium signal transducers // Nature. - 2012. - Vol. 13. - P. 549-565. 30. Stathopulos P., Ihura M. Structural aspects of calcium - release activated calcium channel function // Channels. - 2014. - № 17. - P. 344-353.
30. Stathopulos P., Ihura M. Structural aspects of calcium - release activated calcium channel function // Channels. - 2014. - № 17. - P. 344-353. 31. Toldi G. The regulation of calcium homeostasis in T lymphocytes // Frontiers in immunology. - 2013. - Vol. 4, № 432. - P. 1-2.
31. Toldi G. The regulation of calcium homeostasis in T lymphocytes // Frontiers in immunology. - 2013. - Vol. 4, № 432. - P. 1-2.  32. Vandewalle A., Tourneur E., Bens M., Chassin C., Werts C. Calcineurin/NFAT signaling and innate host defense: a role for NOD1-mediated phagocyte functions // Cell Communication and Signaling. - 2014. - Vol. 12, № 8. - P. 1-10.
32. Vandewalle A., Tourneur E., Bens M., Chassin C., Werts C. Calcineurin/NFAT signaling and innate host defense: a role for NOD1-mediated phagocyte functions // Cell Communication and Signaling. - 2014. - Vol. 12, № 8. - P. 1-10. 33. Wei W., Graeff R, Yue J. Roles and mechanisms of the CD38/cyclic adenosine diphosphate ribose/Ca2+ signaling pathway // J. Biol. Chem. - 2014. - Vol. 26, № 1. - P. 58-67.
33. Wei W., Graeff R, Yue J. Roles and mechanisms of the CD38/cyclic adenosine diphosphate ribose/Ca2+ signaling pathway // J. Biol. Chem. - 2014. - Vol. 26, № 1. - P. 58-67.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

