2017 год № 2
Хирургия сердца и сосудов
2Сибирский федеральный биомедицинский исследовательский центр им. акад. Е.Н. Мешалкина, г. Новосибирск;
3Федеральный центр сердечно-сосудистой хирургии, г. Красноярск
Резюме:
Ключевые слова:
2Siberian Federal Biomedical Research Center n.a. acad. E.N. Meshalkin, Novosibirsk
3Federal Center of Cardiovascular Surgery, Krasnoyarsk
Summary:
Key words:
Введение |
 |
 |
Дискретный субаортальный стеноз (ДСубАоСт) занимает 1-2 % от всех врожденных пороков сердца (ВПС) [4] и 8-10 % среди других сужений ВТЛЖ [7]. Более чем в половине случаев ДСубАоСт сочетается с другими ВПС, среди которых чаще всех встречаются дефект межжелудочковой перегородки (ДМЖП), коарктация аорты (КоАо), клапанный аортальный стеноз (АоСт), открытый артериальный проток (ОАП) [1, 2, 5]. Отдаленная летальность при простом иссечении ДСубАоСт с миэктомией или без неё близка к нулю. Однако частота резидуальных стенозов достигает 35 % и увеличивается с продолжительностью послеоперационного периода [3, 5, 8, 9]. Изучив литературные данные, мы обнаружили лишь небольшое число публикаций, касающихся причин возврата обструкции [4, 5, 6]. Таким образом, данная проблема не достаточно глубоко изучена и требует дальнейших научных изысканий. Цель данного исследования: выявить факторы риска развития рестенозов после хирургической коррекции ДСубАоСт у пациентов педиатрической группы.
Материалы и методы
|
 |
 |
Материалом для научной работы послужили данные 163 пациентов с ДСубАоСт в возрасте от 3 мес. до 18 лет, подвергшихся оперативному лечению в период с 2003 по 2013 гг. Исследование является мультицентровым. В работе использован материал, взятый в ФГБУ "ННИИПК им. акад. Е.Н. Мешалкина" и в Федеральных Центрах сердечно-сосудистой хирургии Хабаровска и Красноярска, где прооперированы по 151, 7 и 5 детей соответственно. Пациенты с обструкцией ВТЛЖ в составе унивентрикулярных ВПС, пороков развития конотрункуса, а также после коррекции общего атриовентрикулярного канала не рассматривались.
В 65,6 % (n=107) случаев ДСубАоСт сочетался с другими врожденными аномалиями сердечно-сосудистой системы. 37,8 % из этих пациентов (n=40) ранее уже выполняли коррекцию ВПС. Наиболее часто встречался ДМЖП (32,5 %), несколько реже ОАП (21,5 %). Нередко отмечалось сочетание ДСубАоСт с другой обструкцией пути оттока из ЛЖ: с КоАо - 13,5 %, АоСт - 10,4%, надклапанным стенозом аорты - 1,8 %, КоАо в сочетании с гипоплазией дуги аорты - 1,8 %. В некоторых наблюдениях (n=7) отмечалось сочетание более двух ВПС одновременно. В 26,4 % (n=43) случаев дети с ДСубАоСт перенесли предшествующие операции на сердце и магистральных сосудах по поводу КоАо, ДМЖП и ОАП.
Применялись стандартные методы инструментальных исследований: электрокардиография (ЭКГ), рентгенография, трансторакальная (ТТ) и чреспищеводная (ЧП) эхокардиография (ЭхоКГ). Решающее значение имела ЭхоКГ.
Показаниями к хирургическому лечению ДСубАоСт являлись клинические проявления порока, пиковый градиент давления (ГрД) на уровне стеноза свыше 50 мм рт. ст. или средний ГрД свыше 30 мм рт. ст. (измеренный методом ЭхоКГ), гипертрофия миокарда, наличие и прогрессирование аортальной недостаточности либо наличие сопутствующего ВПС, требующего коррекции. К рестенозу мы отнесли сужение в ВТЛЖ в послеоперационном периоде с пиковым ГрД свыше 50 мм рт. ст. или средним ГрД свыше 30 мм рт. ст.
Составление базы данных и статистическая обработка выполнялись на персональном компьютере c применением пакета программ STATISTICA 6.0 (StatSoft, USA). Нормальность распределения признака оценивали с помощью гистограммы распределения признака, а также критериев Шапиро-Уилка. Все количественные признаки при нормальном распределении представлены средним значением ± стандартное отклонение; или медианой с межквартильным размахом при неправильном распределении признака. При сравнении по количественному признаку двух независимых групп использовался U-критерий Манна-Уитни, для качественных признаков - двусторонний вариант точного критерия Фишера. Для анализа вероятности наступления изучаемого исхода в определенный период применяли метод Каплана-Мейера, при однофакторном исследовании различий в группах в зависимости от времени наступления исхода - логарифмический ранговый критерий. Критический уровень значимости при проверке статистических гипотез р=0,05.
Результаты и обсуждение
|
 |
 |
Пациентов мужского пола было почти вдвое больше женского: 100 (61,3%) против 63 (38,7%). Возраст на момент проведения операции составил 9±4,8 лет. Систолический ГрД на ВТЛЖ, определенный методом ЭхоКГ, равнялся 69±30 мм рт. ст. Другие клинико-антропометрические показатели представлены в таблице 1.
| Показатели | n | Среднее | Стандартное отклонение |
|---|---|---|---|
| Возраст, лет | 163 | 9,1 | 4,9 |
| Рост, см | 163 | 129 | 30 |
| Вес, кг | 163 | 31,5 | 20,3 |
| ППТ (Bois), м2 | 163 | 1,04 | 0,41 |
| Пиковый ГрД, мм рт. ст. | 163 | 69 | 30 |
| Средний ГрД, мм рт. ст. | 163 | 40 | 24 |
| ФВ, % | 163 | 73 | 7 |
| УО, мл | 163 | 48,4 | 22,1 |
| КДО ЛЖ, мл | 163 | 67,9 | 32,2 |
| иКДО ЛЖ, мл/м2 | 163 | 71,2 | 39,3 |
| ЗСЛЖ, см | 163 | 0,95 | 0,33 |
| МЖП, см | 163 | 1 | 0,37 |
| ММ ЛЖ, г | 163 | 127,4 | 82,1 |
| иММ ЛЖ, г/м2 | 163 | 117,1 | 47,6 |
| Пиковый ГрД сразу после операции, мм рт. ст. | 163 | 18,4 | 10,1 |
| Средний ГрД сразу после операции, мм рт. ст. | 163 | 9,2 | 6,8 |
| Время окклюзии аорты, мин. | 163 | 54 | 39,6 |
| Время ИК, мин. | 163 | 90,3 | 60,1 |
| Время экстубации, ч | 163 | 11 | 15,7 |
| Перевод из ПИТ, сутки | 163 | 2,7 | 1,4 |
| Время от операции до выписки, сутки | 163 | 12,5 | 5,8 |
| Срок наблюдения в послеоперационном периоде, мес. | 134 | 62,2 | 48,1 |
| Послеоперационный пиковый ГрД на сроке наблюдения 62±48 мес., мм рт. ст. | 134 | 29,1 | 20,9 |
Примечание. ППТ - площадь поверхности тела; ГрД - градиент давления в выходном отделе левого желудочка, ФВ - фракция выброса левого желудочка, УО - ударный объем, иКДО ЛЖ - индекс конечного диастолического объема левого желудочка, ЗСЛЖ - толщина задней стенки левого желудочка, МЖП - толщина межжелудочковой перегородки, иММ ЛЖ - индекс массы миокарда левого желудочка, ГрД - градиент давления, ИК - искусственное кровообращение, ПИТ - палата интенсивной терапии.
В большинстве случаев (63,8 %, n=104) выполнялась обычная резекция стенозирующих элементов, в 33,7 % (n=55) резекция дополнялась септальной миэктомией. Техника операции и методика определения состояния ВТЛЖ ранее описана нами [2]. Нормативный размер ВТЛЖ соответствовал Z-score=0 по номограммам Daubeney, et al., 1999. В связи с патологией аортального клапана (АоК), кроме резекции подклапанной мембраны, в трех случаях (1,8 %) выполнялась процедура Росса-Конно и в одном случае (0,8 %) - процедура Росса.
Оценка послеоперационного ГрД проводилась интраоперационно методом ЧП ЭхоКГ, затем через 1-7 дней методом ТТ ЭхоКГ. Представленный в таблице 1 "ГрД сразу после операции" вычислялся, как среднее арифметическое нескольких измерений в послеоперационном периоде на госпитальном этапе. Госпитальная летальность составила 1,2 % (n=2). Причиной смерти в обоих случаях явилась прогрессирующая сердечно-сосудистая недостаточность с присоединением полиорганной недостаточности.
Из осложнений, характерных для хирургического лечения ДСубАоСт, полная АВ-блокада отмечалась в 4,2 % (n=7) случаев, что потребовало имплантации электрокардиостимулятора. В одном случае наблюдалась перфорация МЖП с образованием ятрогенного дефекта, который сразу был закрыт заплатой из ксеноперикарда.
Послеоперационный период отслежен у 134 пациентов из 161 (83,2 %) и составил 62,2±48,1 мес. Зафиксирован один летальный (0,7 %) исход по типу "внезапной сердечной смерти", возникший у пациентки через 5,3 года после первичного устранения СубАоСт. Резидуальная обструкция наблюдалась в 12,7 % (n=17) из 134 пациентов, десятерым из них (58,8 %) выполнялось устранение стеноза. Повторные операции были выполнены не всем пациентам с рестенозом. Это связано с отказом или желанием отсрочить оперативное лечение со стороны некоторых пациентов. На рисунке 1 представлена кривая Каплана-Мейера свободы от рестеноза. Кумулятивная доля пациентов без рестеноза на сроке наблюдения 98 мес. (8,2 лет) составила 80 %, стандартная ошибка (ст. ош.) 0,05. При более длительном периоде наблюдения ст. ош. превышает 0,05. Медиана времени свободы от рестеноза не достигнута.
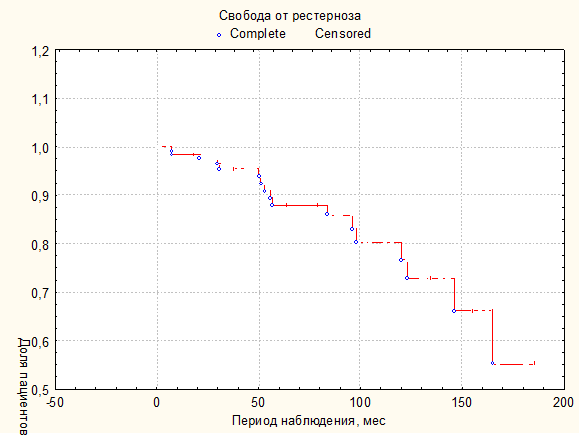
Рис. Кривая Каплана-Мейера, анализ свободы от рестеноза (n=134)
Для выявления предикторов рестеноза проведена сравнительная оценка клинических и ЭхоКГ данных пациентов в группах с возникшей резидуальной обструкцией (n=17) и без нее (n=117), таблица 2. Статистически значимыми показателями, влияющими на возникновение рестеноза, оказались следующие: возраст пациентов (р=0,03), площадь поверхности тела (ППТ) на момент проведения первичной операции (р=0,005), сращение субаортальной мембраны с АоК (р=0,02), меньший размер фиброзного кольца АоК (р=0,03), более высокий непосредственный послеоперационный пиковый ГрД на уровне ВТЛЖ (р=0,04).
| № | Переменные | Все пациенты (n=134) | Без рестеноза (n=117) | С рестенозом (n=17) | Значение р | |
|---|---|---|---|---|---|---|
| 1. | Возраст на момент первичной операции, лет * | 9 (5,4; 12,3) | 9,6 (5,7; 13,2) | 6,3 (3,9; 9,1) | 0,03 | |
| 2. | Период наблюдения, мес. * | 48,2 (25; 91) | 45 (25; 90) | 55,6 (31; 98) | 0,38 | |
| 3. | ППТ на момент первичной операции, м2 * | 0,99 (0,74; 1,32) | 1,01 (0,8; 1,37) | 0,7 (0,58; 1,07) | 0,005 | |
| Форма дискретного СубАоСт | ||||||
| 4. | Фиброзная мембрана | 66 (49,2 %) | 57 (48,7%) | 9 (52,9%) | 0,85 | |
| 5. | Фибромышечная мембрана | 68 (50,8 %) | 60 (51,3%) | 8 (47,1%) | 0,85 | |
| Наличие сопутствующего ВПС | ||||||
| 6. | Аортальный стеноз | 15 (11,2 %) | 12 (10,3%) | 3 (17,6%) | 0,33 | |
| 7. | ДМЖП | 40 (29,9 %) | 34 (29,1%) | 6 (35,3%) | 0,71 | |
| 8. | Коарктация аорты | 21 (15,7 %) | 21 (17,9%) | 0 (0%) | 0,07 | |
| 9. | Сращение СубАоСт с АоК | 18 (13,4 %) | 12 (10,2%) | 6 (35,2%) | 0,02 | |
| 10. | Сращение СубАоСт с МК | 21 (15,6 %) | 17 (14,5%) | 4 (23,5%) | 0,31 | |
| 11. | ФКАоК, см * | 1,7 (1,4; 2) | 1,7 (1,5; 2) | 1,5 (1,1; 1,7) | 0,03 | |
| 12. | ФКАоК/ППТ, мм/м2 * | 1,6 (1,3; 2) | 1,6 (1,3; 2) | 1,9 (1,4; 2) | 0,21 | |
| 13. | Расстояние от АоК до СубАоСт, мм * | 5 (3; 6,7) | 5 (3; 6,3) | 4,3 (2,7; 8,3) | 0,89 | |
| 14. | Расстояние от АоК до СубАоСт/ППТ, мм/м2 * | 4,7 (2,8; 7) | 4,6 (2,6; 6,9) | 7,2 (4,8; 9,5) | 0,14 | |
| 15. | ИММ ЛЖ, г/м2 * | 106,4 (80,6; 135,5) | 107 (81,1; 140,3) | 90,8 (76,3; 130,3) | 0,4 | |
| 16. | иКДО ЛЖ мл/м2 * | 58,9 (48,6; 72,8) | 59,1 (49,2; 72,7) | 58 (43,2; 81,7) | 0,75 | |
| 17. | Пиковый ГрД до операции, мм рт. ст. * | 68 (52; 83) | 68 (52; 86) | 70 (54,5; 78,5) | 0,96 | |
| 18. | Пиковый ГрД сразу после операции, мм рт. ст. * | 18 (11,3; 24) | 17,5 (10,5; 23,5) | 22,2 (17,6; 28) | 0,04 | |
Примечание. *Переменные с неправильным распределением, представлены медианой (верхний квартиль; нижний квартиль). ППТ - площадь поверхности тела, ДМЖП - дефект межжелудочковой перегородки, СубАоСт - субаортальный стеноз, АоК - аортальный клапан, МК - митральный клапан, ФКАоК - фиброзное кольцо аортального клапана, ИММ ЛЖ - индекс массы миокарда левого желудочка, иКДО ЛЖ - индекс конечного диастолического объема левого желудочка, ГрД - градиент давления.
Для применения однофакторного анализа на время до наступления рестеноза количественные данные предварительно разбивались на отрезки с формированием двух групп. Данный статистический тест выявил следующие предикторы возврата обструкции: возраст пациентов на момент первичного устранения СубАоСт менее 4 лет (р=0,04), ППТ менее 0,7 м2 (р=0,00002), размер фиброзного кольца АоК менее 1,5 см2 (р=0,03), сращение стенозирующих элементов со створками АоК (р=0,0003), непосредственный послеоперационный пиковый ГрД более 30 мм рт. ст. (р=0,03).
Обобщая литературные данные по изучаемой проблеме, исследователи указывают на следующие предикторы рестеноза: ранний возраст при первичной операции [4, 5, 6], высокий пред- [5, 6] и послеоперационный ГрД [4, 9], наличие многоуровневой обструкции [5], близкое расположение стенозирующих элементов к АоК [5], наличие сопутствующих ВПС (КоАо, a. lusoria, внутрисердечные аномалии) [4, 5, 6], гипоплазию фиброзного кольца АоК [5, 9]. Данные нашего исследования отчасти совпали с результатами этих публикаций. Однако мы не обнаружили значимой статистической связи высокого предоперационного ГрД и наличие сопутствующих ВПС (КоАо, ДМЖП, АоСт) с развитием рестеноза.
Хирургическое лечение ДСубАоСт имеет хорошие непосредственные и отдаленные результаты с низкой послеоперационной летальностью. Частота резидуальной обструкции увеличивается со временем наблюдения. Факторами риска развития рестеноза, по нашим данным, являются ранний возраст пациентов и малая площадь поверхности тела на момент первичного устранения ДСубАоСт, сращение стенозирующих элементов со створками АоК, высокий непосредственный послеоперационный пиковый ГрД.
Литература |
 |
 1. Караськов А.М., Железнев С.И., Стенин В.Г. и др. Хирургическая тактика при врожденных предклапанных стенозах аорты // Патология кровообращения и кардиохирургия. - 2003. № 1. - С. 22-26.
1. Караськов А.М., Железнев С.И., Стенин В.Г. и др. Хирургическая тактика при врожденных предклапанных стенозах аорты // Патология кровообращения и кардиохирургия. - 2003. № 1. - С. 22-26. 2. Налимов К.А., Горбатых Ю.Н., Омельченко А.Ю. и др. Непосредственные результаты различных методов хирургического лечения дискретных субаортальных стенозов у детей // Кардиология и сердечно-сосудистая хирургия. - 2013. № 5. - С. 67-70.
2. Налимов К.А., Горбатых Ю.Н., Омельченко А.Ю. и др. Непосредственные результаты различных методов хирургического лечения дискретных субаортальных стенозов у детей // Кардиология и сердечно-сосудистая хирургия. - 2013. № 5. - С. 67-70.  3. Brauner R., Laks H., Drinkwater D.C., et al. Benefits of early repair of in fixed subaortic stenosis // J. Am. Coll. Cardiol. - 1997. - Vol. 30. - P. 1812-1835.
3. Brauner R., Laks H., Drinkwater D.C., et al. Benefits of early repair of in fixed subaortic stenosis // J. Am. Coll. Cardiol. - 1997. - Vol. 30. - P. 1812-1835.  4. Dodge-Khatami A., Schmid M., Rousson V., et al. Risk factors for reoperation after relief of congenital subaortic stenosis // Eur. J. Cardiothorac. Surg. - 2008. - Vol. 33 (5). - P. 885-889.
4. Dodge-Khatami A., Schmid M., Rousson V., et al. Risk factors for reoperation after relief of congenital subaortic stenosis // Eur. J. Cardiothorac. Surg. - 2008. - Vol. 33 (5). - P. 885-889.  5. Geva A., McMahon C.J., Gauvreau K., et al. Risk factors for reoperation after repair of discrete subaortic stenosis in children // J. Am. Coll. Cardiol. - 2007. - Vol. 15. - P. 1498-1504.
5. Geva A., McMahon C.J., Gauvreau K., et al. Risk factors for reoperation after repair of discrete subaortic stenosis in children // J. Am. Coll. Cardiol. - 2007. - Vol. 15. - P. 1498-1504.  6. Hirata Y., Chen J.M., Quaegebeur J.M., Mosca R.S. The role of enucleation with or without septal myectomy for discrete subaortic stenosis // J. Thorac. Cardiovasc. Surg. - 2009. - Vol. 137. - P. 1169-1172.
6. Hirata Y., Chen J.M., Quaegebeur J.M., Mosca R.S. The role of enucleation with or without septal myectomy for discrete subaortic stenosis // J. Thorac. Cardiovasc. Surg. - 2009. - Vol. 137. - P. 1169-1172.  7. Kirklin J.W., Barratt-Boyes B.G. Cardiac surgery: morphology, diagnostic criteria, natural history, techniques, results, and indications, 2nd ed., Vol. 2. New York : Churchill Livingstone, 1993. P. 1212-1224.
7. Kirklin J.W., Barratt-Boyes B.G. Cardiac surgery: morphology, diagnostic criteria, natural history, techniques, results, and indications, 2nd ed., Vol. 2. New York : Churchill Livingstone, 1993. P. 1212-1224.  8. Ohye R.G., Devaney E.J., Bove E.L. Resection of discrete subaortic membranes // Operative Techniques in Thoracic and Cardiovascular Surgery. - 2002. - Vol. 7. - P. 172-175.
8. Ohye R.G., Devaney E.J., Bove E.L. Resection of discrete subaortic membranes // Operative Techniques in Thoracic and Cardiovascular Surgery. - 2002. - Vol. 7. - P. 172-175.  9. Serraf A., Zoghby J., Lacour-Gayet F., et al. Surgical treatment of subaortic stenosis: a seventeen-year experience // J. Thorac. Cardiovasc. Surg. - 1999. - Vol. 117. - P. 669-678.
9. Serraf A., Zoghby J., Lacour-Gayet F., et al. Surgical treatment of subaortic stenosis: a seventeen-year experience // J. Thorac. Cardiovasc. Surg. - 1999. - Vol. 117. - P. 669-678.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»