2017 год № 2
Хирургия
2Краевая клиническая больница № 2, 680030, ул. Павловича, 1б, e-mail: hospital@nxt.ru;
3Консультативно-диагностический центр "Вивея", 680030, ул. Запарина, 83, e-mail: viveya@inbox.ru, г. Хабаровск
Резюме:
Ключевые слова:
2Clinical Hospital № 2;
3Consulting and Diagnostic Center "Viveya", Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Аневризма селезеночной артерии (АСА) впервые описана в 1770 году M.Beaussier, последующие описания сделаны только в 1844 и 1847 годах, а к 1953 году было описано лишь 262 случая этой патологии с частотой встречаемости по данным патологоанатомических вскрытий от 0,01 % до 9,8 % [12]. P.D. Bedford и B.Lodge (1960) при проведении 250-ти последовательных аутопсий при целенаправленном осмотре селезеночной артерии (СА) обнаружили ее аневризму в 26 случаях, что составило 10,4 %, при этом размеры описанных этими авторами аневризм составляли от 0,3 до 2,5 см [12]. АСА, размеры которых превышают 5 см, считаются гигантскими [10,16,24, 28] и встречаются гораздо реже. По данным F.Zampieri, et al. к 2005 году в литературе было описано всего 18 случаев гигантских АСА [28]. В 2015 году S. Akbulut и E. Otan при анализе баз данных Pubmed, Medline, Google Sholar и Google сообщили о 69 публикациях с описанием в них 78 случаев АСА, размеры которых превышали 5 см [10]. Имеется описание гигантской АСА, достигшей размеров 30×20×20 см [25].
С появлением современных технологий визуализации высокого разрешения - мультиспиральной компьютерной томографии, магнитно-резонансной томографии, ангиографии, частота прижизненного выявления АСА увеличилась. Их чаще всего обнаруживают случайно при проведении обследования, назначенного по другим показаниям. В настоящее время АСА по частоте занимают третье место среди всех интраабдоминальных аневризм после аневризм брюшной аорты и подвздошных артерий [10].
АСА разделяют на истинные и ложные или псевдоаневризмы. При истинной аневризме ее стенки представлены всеми тремя сосудистыми слоями: интимой, медией и адвентицией, в то время как псевдоаневризма формируется не более чем из двух вышеуказанных компонентов, при этом обычно отсутствует адвентиция [9].
Среди факторов, способствующих формированию АСА, отмечены панкреатит, беременность (особенно многократная), портальная гипертензия, атеросклеротические дегенеративные изменения СА, травма, дисплазии соединительной ткани, трансплантация печени у больных с циррозом [8, 15, 18, 22, 23, 26], септическая эмболия с развитием так называемой микотической аневризмы [28]. Наиболее частой причиной формирования псевдоаневризм СА считается панкреатит, при котором ферменты поджелудочной железы воздействуют на эластические волокна сосудистой стенки, что приводит к их деструкции и способствует формированию псевдоаневризмы [10]. Во многих случаях причина остается неизвестной.
В большинстве случаев (80 % по данным мета-анализа S.Akbulut и E.Otan (2015) АСА могут длительно существовать бессимптомно. При симптомном же течении больные предъявляют жалобы на боль в эпигастрии, левом верхнем квадранте живота, чувство полноты в желудке, потерю аппетита, тошноту, в ряде случаев рвоту [6, 10, 13]. При очень больших размерах аневризмы может определяться пульсирующее образование в области эпигастрия или левой верхней части живота [10, 23].
У части больных случаются разрывы АСА с прорывом в брюшную полость, забрюшинное пространство, прилежащие органы: желудок [11], петли кишечника [2, 10, 21, 26], поджелудочную железу и Вирсунгов проток [2, 10, 22, 26]. Такие разрывы сопровождаются жизнеугрожающими кровотечениями, требующими немедленного хирургического вмешательства [5, 10, 22]. Риск спонтанных разрывов по данным различных авторов колеблется от 2 % до 10 % и сопровождается летальностью в 10-40 % случаев, в том числе и у больных, которым выполнено экстренное хирургическое пособие [10]. Особенно высока летальность при разрыве АСА у больных с портальной гипертензией [18]. АСА чаще встречаются у женщин, однако разрывы чаще происходят у мужчин [8, 18]. В случаях гигантских аневризм риск разрыва увеличивается до 28 %, при этом риск разрыва псевдоаневризм выше, чем истинных и достигает 37 % [10]. Клиника спонтанных разрывов часто проявляется внезапной болью в левом верхнем квадранте живота или эпигастрии с иррадиацией в левое плечо, нестабильной гемодинамикой вплоть до развития гиповолемического шока [10, 26]. При прорыве аневризмы в желудок могут возникать кровавая рвота и мелена [27].
Лечение АСА может быть только хирургическим. В литературе приводятся данные о применении "открытых" хирургических методов, среди которых описаны аневризмэктомия, аневризмэктомия со спленэктомией, лигирование селезеночной артерии с аневризмэктомией или без таковой. Открытое хирургическое вмешательство нередко затрагивает и прилежащие к аневризме органы (чаще всего селезенку, поджелудочную железу, левые отделы толстой кишки), при этом объем оперативного пособия зависит от размеров аневризмы, ее локализации по ходу СА, опыта хирургической команды [10, 13, 23, 24, 26, 27].
В последние годы большое распространение приобрели эндоваскулярные технологии лечения АСА, такие, как транскатетерная эмболизация аневризмы, установка стент-графта, введение тромбина в полость аневризмы, эмболизация проксимального сегмента селезеночной артерии с использованием спиралей или эмболизирующих веществ (ethylene vinyl alcohol copolymer), специального клея (N-butyl-2-cyanoacrylate) [6, 7, 14, 16, 17, 19, 20]. Выбор той или иной эндоваскулярной технологии зависит от многих факторов. Например, эмболизация аневризматического мешка и установка стент-графта чаще применяются при относительно небольших аневризмах. В случаях гигантских АСА при установке стент-графта имеется высокий риск его миграции в полость аневризмы, часто возникают трудности при проведении катетера в отрезок селезеночной артерии, расположенный дистальнее аневризмы [14]. В подобных случаях успешно применялась эмболизация проксимального отрезка основного ствола селезеночной артерии [7, 14, 16, 19]. Прекращение притока крови из эмболизированной селезеночной артерии часто приводит к снижению функциональной активности селезенки. Поэтому эмболизация СА с успехом применяется при циррозе печени с выраженными проявлениями портальной гипертензии и гиперспленизма для снижения давления в портальной системе, коррекции цитопении [1, 3, 4, 20], а также при выполнении трансплантации печени для устранения синдрома обкрадывания селезеночной артерией печеночного артериального кровотока [3].
Наблюдение
|
 |
 |
Приводим собственное наблюдение, в котором для лечения гигантской АСА использована проксимальная эмболизация селезеночной артерии.
Больной Ю., 62 лет, в мае 2011 года проходил обследование в одной из зарубежных клиник в связи с появлением болей в левой половине грудной клетки. При проведении мультиспиральной компьютерной коронарной ангиографии изменений в венечных артериях выявлено не было, но при попутном осмотре верхних отделов брюшной полости в области тела поджелудочной железы обнаружено образование размером 4,5×4 см, с небольшими включениями кальция и пристеночным внутриполостным плотным компонентом величиной 2×3 см, расцененное как киста поджелудочной железы (рис.1). Помимо этого, в обоих надпочечниках были найдены образования размерами в левом - 2×3 см, в правом - 4×2,5 см (так называемые инциденталомы), которые при последующем целенаправленном обследовании не показали признаков гормональной активности.

Рис. 1. Больной Ю. Спиральная компьютерная томография, 2011 год. Аневризма селезеночной размером 4,5×4 см (указана стрелкой)
По возвращении в Россию в июне 2011 года в связи с увеличением печени был направлен на ультразвуковое исследование (УЗИ) в поликлинику, во время которого обнаружено, что печень выступает из-под края реберной дуги на 4,5 см, косой вертикальный размер (КВР) правой доли увеличен до 18,0 см, толщина левой доли - до 9,2 см, эхогенность паренхимы значительно повышена. Воротная вена - 1,0 см. Поджелудочная железа нормальных размеров с неровными контурами, эхогенность значительно повышена. На границе тела и хвоста железы определялось образование размером 4,2×4,8 см. При контрольных УЗИ отмечено увеличение диаметра воротной вены: в феврале 2012 года - до 1,2 см, в июле 2013 года - до 1,4 см, на границе тела и хвоста поджелудочной железы так же определялось жидкостное образование размерами 4,4×4,1×4,8 см с неоднородной внутренней структурой, эхоплотными включениями и перегородками. При исследовании образования методом цветового допплеровского картирования (ЦДК) зон васкуляризации в нем выявлено не было и оно было расценено как кистозно-солидное образование поджелудочной железы.
29.11.2015 года пациент поступил в кардиологическое отделение нашей клиники в связи с ухудшением течения артериальной гипертензии, проявившейся кризом с повышением АД до 230/120 мм рт. ст. При планировании обследования решено выполнить спиральную компьютерную томографию брюшной полости с контрастным усилением для оценки в динамике размеров выявленных ранее инциденталом надпочечников. Размеры этих опухолей существенно не изменились, но в области тела поджелудочной железы выявлена аневризма селезеночной артерии размерами 5,1×6,3×6,2 см, частично тромбированная, с размерами нетромбированной части 4,1×4,7×5,2 см. Тромбированная часть располагалась в виде полумесяца по заднебоковой поверхности справа, стенки и тромб частично кальцинированы. В верхнем полюсе аневризмы четко видна приносящая, а по левой стороне - выносящая части селезеночной артерии, диаметрами по 7 мм (рис. 2 и 3). Размеры поджелудочной железы: хвост 24 мм, тело 7 мм (истончено за счет аневризмы), головка 27 мм. Вирсунгов проток дистальнее аневризмы расширен до 5 мм, проксимальнее до 4 мм. Селезенка нормальныых размеров и структуры, отмечено увеличение размеров печени с наличием во втором ее сегменте гемангиомы диаметром 1,4 см. Ширина воротной вены - 1,1 см.

Рис. 2. Больной Ю. Спиральная компьютерная томография с контрастным усилением, 2015 год. Размеры аневризмы селезеночной артерии увеличились до 6,3×6,2 см
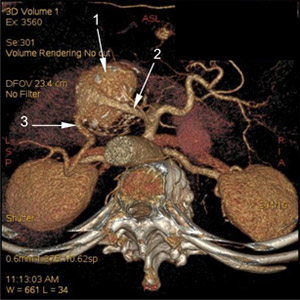
Рис. 3. Больной Ю. Спиральная компьютерная томография с контрастным усилением, 2015 год:
1) аневризма селезеночной артерии 5,1×6,3×6,2 см;
2) приводящий сегмент селезеночной артерии;
3) отводящий сегмент селезеночной артерии
В результате антигипертензивной терапии (периндоприл-А 10 мг + бисопролол 10 мг + индапамид-ретард 1,5 мг) артериальное давление стабилизировалось на уровне 130/80 мм рт. ст. и больной был выписан из стационара. Перед выпиской осмотрен хирургом, который высказал мнение о наличии высокого риска осложнений в случае использования открытого хирургического вмешательства на АСА в связи с особенностями ее расположения, плотным контактом с тканью поджелудочной железы и предложил проконсультировать больного с рентгенангиохирургом для определения возможности эндоваскулярного лечения.
24.02.2016 года больной вновь госпитализирован в нашу клинику для проведения плановой ангиографии и определения лечебной тактики в отношении АСА. При ангиографии СА подтверждено наличие гигантской аневризмы размером 6×6 см, расположенной ближе к аорте, без четко выраженной шейки (рис. 4). В связи с отсутствием надлежащих эмболизирующих материалов пациент был выписан с рекомендациями ограничения физических нагрузок, контроля нормальных цифр АД. После поставки эмболизирующих спиралей он снова был госпитализирован и 24.08.2016 ему проведена селективная катетеризация СА с её последовательной эмболизацией отделяемыми мини-спиралями "СООК" размерами 15×15, 10×8, 8×5мм. На контрольной ангиографии отмечено значительное замедление контрастирования СА и аневризмы (рис. 5).
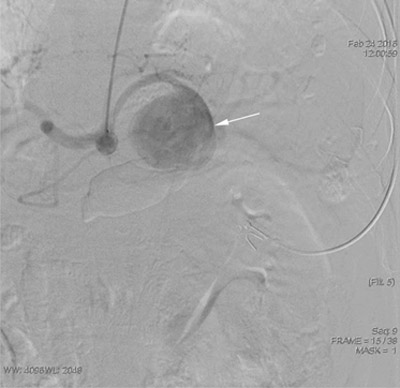
Рис. 4. Больной Ю. Ангиография от 24.02.2016 г. Аневризма селезеночной артерии 6×6 см
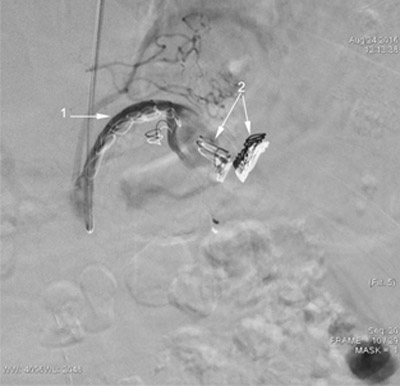
Рис. 5. Больной Ю. Ангиография от 24.08.2016 г. Проксимальный сегмента СА эмболизирован миниспиралями "СООК" (1). Эмболизирующие спирали в просвете аневризмы (2). Кровоток в аневризме редуцирован
Оперативное вмешательство перенес удовлетворительно. На третий день после вмешательства проведена контрольная СКТ (рис. 6). В полости аневризмы возле устья выносящего и на протяжении 3,5 см в просвете приносящего сегментов СА расположены мини-спирали металлической плотности. Аневризма полностью тромбирована, хотя отмечено некоторое различие тромботической массы по плотности, возможно из-за разницы во времени образования. В артериальную фазу в полости аневризмы контрастный препарат не определялся.
Рис. 6. Больной Ю. Спиральная компьютерная томография с контрастным усилением от 26.08.2016 г.
1. Аневризма селезеночной артерии заполнена тромботическими массами, кровоток в ней отсутствует.
2. Эмболизирующие спирали в проксимальном сегменте селезеночной артерии.
Больной выписан из стационара на восьмой день после операции в удовлетворительном состоянии. Ближайший и отдаленный послеоперационные периоды протекали без осложнений. При контрольной СКТ через пять месяцев после операции полость аневризмы полностью тромбирована с кальцинатами внутри нее и по стенкам.
Наше наблюдение подтверждает, что даже достаточно большие АСА могут протекать бессимптомно и оказываются случайной находкой при обследовании больных по иным показаниям. Необходимость оперативного лечения в данном случае была продиктована не только наличием самой АСА, но еще и тем, что в течение пяти лет произошло увеличение ее диаметра с 4,5 до 6,2 см, что создавало дополнительный риск ее разрыва. Выбор в пользу эндоваскулярной проксимальной эмболизации СА был сделан на основании имеющихся в литературе описаний успешного применения при лечении АСА этой методики, преимуществами которой являются относительная малоинвазивность, высокая эффективность, хорошая переносимость больными и небольшое количество послеоперационных осложнений. Кроме того, ее использование позволяет сохранить селезенку, кровоснабжение которой сохраняется за счет коротких желудочных, желудочно-сальниковых и панкреатических коллатералей.
Немаловажным преимуществом эндоваскулярных методик лечения АСА является возможность их использования в тех ситуациях, когда открытое хирургическое вмешательство невозможно или сопряжено с высоким операционным риском, обусловленным как анатомическими особенностями аневризмы и прилежащих органов, так и состоянием больного [16].
Литература |
 |
 1. Боровский С.П., Адылова Г.С., Алимухамедова Д.К. и др.Эмболизация селезеночной артерии при портальной гипертензии у детей // Хирургия. Журнал им. Н.И.Пирогова. - 2000. - № 6. - С. 15-17.
1. Боровский С.П., Адылова Г.С., Алимухамедова Д.К. и др.Эмболизация селезеночной артерии при портальной гипертензии у детей // Хирургия. Журнал им. Н.И.Пирогова. - 2000. - № 6. - С. 15-17. 2. Вишнякова М.В., Лерман А.В., Сташук Г.А. и др. Диагностика и эндоваскулярное лечение псевдоаневризмы селезеночной артерии (клиническое наблюдение) //Диагностическая и интервенционная радиология. - 2010. - Т. 4, № 4. - С. 97-100.
2. Вишнякова М.В., Лерман А.В., Сташук Г.А. и др. Диагностика и эндоваскулярное лечение псевдоаневризмы селезеночной артерии (клиническое наблюдение) //Диагностическая и интервенционная радиология. - 2010. - Т. 4, № 4. - С. 97-100. 3. Гранов Д.А., Таразов П.Г., Поликарпов А.А. и др. Эмболизация селезеночной артерии у пациентов, перенесших ортотопическую трансплантацию печени // Вестник трансплантологии и искусственных органов. - 2016. - Т. 18. - № 1. - С. 17-21.
3. Гранов Д.А., Таразов П.Г., Поликарпов А.А. и др. Эмболизация селезеночной артерии у пациентов, перенесших ортотопическую трансплантацию печени // Вестник трансплантологии и искусственных органов. - 2016. - Т. 18. - № 1. - С. 17-21. 4. Грубник В.В., Загороднюк О.Н., Грубник В.Ю. Ранние послеоперационные осложнения эмболизации селезеночной артерии // Харькiвська хiрургiчна школа. - 2012. - Т. 54, № 3. - С. 129-132.
4. Грубник В.В., Загороднюк О.Н., Грубник В.Ю. Ранние послеоперационные осложнения эмболизации селезеночной артерии // Харькiвська хiрургiчна школа. - 2012. - Т. 54, № 3. - С. 129-132. 5. Кошевой А. П., Бутуханов С. Б., Белоус И. А. Аневризма селезеночной артерии, варикозное расширение вен желудка как источник желудочно-кишечного кровотечения // Анналы хирургии. - 2008. - № 4. - С. 79-81.
5. Кошевой А. П., Бутуханов С. Б., Белоус И. А. Аневризма селезеночной артерии, варикозное расширение вен желудка как источник желудочно-кишечного кровотечения // Анналы хирургии. - 2008. - № 4. - С. 79-81. 6. Мизин А.Г., Павлов П.И.,. Козлов В.И, Серенко А.Н. Опыт эндоваскулярного лечения аневризм висцеральных артерий // Международный Журнал интервенционной кардиоангиологии 2008 №14.- Режим доступа: http://www.rnoik.ru/ru/?idx=205&PHPSESSID=0a09c23ecb58e8af834013c57a3c29b4 (дата обращения 24.02.2017).
6. Мизин А.Г., Павлов П.И.,. Козлов В.И, Серенко А.Н. Опыт эндоваскулярного лечения аневризм висцеральных артерий // Международный Журнал интервенционной кардиоангиологии 2008 №14.- Режим доступа: http://www.rnoik.ru/ru/?idx=205&PHPSESSID=0a09c23ecb58e8af834013c57a3c29b4 (дата обращения 24.02.2017). 7. Abada H.T., Capasso P., Golzarian J. Endovascular Options for Splenic Artery Aneurysms //Endovascular today. - 2012. - April. - P. 53-55.
7. Abada H.T., Capasso P., Golzarian J. Endovascular Options for Splenic Artery Aneurysms //Endovascular today. - 2012. - April. - P. 53-55. 8. Abbas M.A., Stone W.M., Fowl R.J., et al. Splenic artery aneurysms: Two decades experience at Mayo Clinic // Annals of Vascular Surgery. - 2002. - Vol. 16. - № 4. - P. 442-449.
8. Abbas M.A., Stone W.M., Fowl R.J., et al. Splenic artery aneurysms: Two decades experience at Mayo Clinic // Annals of Vascular Surgery. - 2002. - Vol. 16. - № 4. - P. 442-449. 9. Agrawal G.A., Johnson P.T., Fishman E.K. Splenic Artery Aneurysms and Pseudoaneurysms: Clinical Distinctions and CT Appearances // American Journal of Roentgenology. - 2007. - Vol. 18. - № 4. - P. 992-999.
9. Agrawal G.A., Johnson P.T., Fishman E.K. Splenic Artery Aneurysms and Pseudoaneurysms: Clinical Distinctions and CT Appearances // American Journal of Roentgenology. - 2007. - Vol. 18. - № 4. - P. 992-999. 10. Akbulut S., Otan E. Management of Giant Splenic Artery Aneurysm: Comprehensive Literature Review // Medicine. - 2015. - Vol. 94. - № 27. - P. e1016.
10. Akbulut S., Otan E. Management of Giant Splenic Artery Aneurysm: Comprehensive Literature Review // Medicine. - 2015. - Vol. 94. - № 27. - P. e1016. 11. Al-Tashi M., Krajina A., Sobotka L., et al. Massive gastric bleeding from pseudoaneurysm of the arteria lienalis as a serious complication of pancreatic pseudocyst perforating to the stomach // Folia Gastroenterologica et Hepatologica. - 2005. - Vol. 3. - № 4. - P. 144-149.
11. Al-Tashi M., Krajina A., Sobotka L., et al. Massive gastric bleeding from pseudoaneurysm of the arteria lienalis as a serious complication of pancreatic pseudocyst perforating to the stomach // Folia Gastroenterologica et Hepatologica. - 2005. - Vol. 3. - № 4. - P. 144-149. 12. Bedford P.D., Lodge B. Aneurysm of the Splenic Artery // Gut. - 1960. - Vol. 1. - № 4. - P. 312-320.
12. Bedford P.D., Lodge B. Aneurysm of the Splenic Artery // Gut. - 1960. - Vol. 1. - № 4. - P. 312-320. 13. Deger K.C., Gundes E., Fedakar A. Surgical management of a splenic artery aneurysm // Clinical Case Reports. - 2016. - Vol. 4. - № 5. - P. 524-525.
13. Deger K.C., Gundes E., Fedakar A. Surgical management of a splenic artery aneurysm // Clinical Case Reports. - 2016. - Vol. 4. - № 5. - P. 524-525. 14. Guziński M., Kurcz J., Kukulska M. Embolization of a True Giant Splenic Artery Aneurysm Using NBCA Glue - Case Report and Literature Review // Polish Journal of Radiology. - 2015. - Vol. 80. - P. 155-158.
14. Guziński M., Kurcz J., Kukulska M. Embolization of a True Giant Splenic Artery Aneurysm Using NBCA Glue - Case Report and Literature Review // Polish Journal of Radiology. - 2015. - Vol. 80. - P. 155-158. 15. Heestand G., Sher L., Lightfoote J., et al. Characteristics and management of splenic artery aneurysm in liver transplant candidates and recipients // The American surgeon. -2003. - Vol. 69. - № 11. - P. 933-40.
15. Heestand G., Sher L., Lightfoote J., et al. Characteristics and management of splenic artery aneurysm in liver transplant candidates and recipients // The American surgeon. -2003. - Vol. 69. - № 11. - P. 933-40. 16. Ho M.F., Chan Y.C., Cheng S.W. Successful endovascular management of giant splenic artery aneurysms // Vascular. - 2013. - Vol. 21. - № 5. - P. 317-322.
16. Ho M.F., Chan Y.C., Cheng S.W. Successful endovascular management of giant splenic artery aneurysms // Vascular. - 2013. - Vol. 21. - № 5. - P. 317-322. 17. Kilani M.S., Izaaryene J., Cohen F., et al. Ethylene vinyl alcohol copolymer (Onyx®) in peripheral interventional radiology: Indications, advantages and limitations // Diagnostic and Interventional Imaging. - 2015. - Vol. 96. - № 4. - P. 319-326.
17. Kilani M.S., Izaaryene J., Cohen F., et al. Ethylene vinyl alcohol copolymer (Onyx®) in peripheral interventional radiology: Indications, advantages and limitations // Diagnostic and Interventional Imaging. - 2015. - Vol. 96. - № 4. - P. 319-326. 18. Lee P.C., Rhee R.Y., Gordon R.Y., et al. Management of splenic artery aneurysms: the significance of portal and essential hypertension // Journal of the American College of Surgeons. - 1999. - Vol. 189. - № 5. - P. 483-490.
18. Lee P.C., Rhee R.Y., Gordon R.Y., et al. Management of splenic artery aneurysms: the significance of portal and essential hypertension // Journal of the American College of Surgeons. - 1999. - Vol. 189. - № 5. - P. 483-490. 19. Loffroy R., Guiu B., Cercueil J.P., et al. Transcatheter arterial embolization of splenic artery aneurysms and pseudoaneurysms: short- and long-term results // Annals of Vascular Surgery. - 2008. - Vol. 22, № 5. - P. 618-626.
19. Loffroy R., Guiu B., Cercueil J.P., et al. Transcatheter arterial embolization of splenic artery aneurysms and pseudoaneurysms: short- and long-term results // Annals of Vascular Surgery. - 2008. - Vol. 22, № 5. - P. 618-626. 20. Naganuma M., Matsui H., KoizumiJ., et al. Short-term outcomes following elective transcatheter arterial embolization for splenic artery aneurysms: data from a nationwide administrative database // Acta Radiologica Open. - 2015. - Vol. 4, № 9. - P. 1-5.
20. Naganuma M., Matsui H., KoizumiJ., et al. Short-term outcomes following elective transcatheter arterial embolization for splenic artery aneurysms: data from a nationwide administrative database // Acta Radiologica Open. - 2015. - Vol. 4, № 9. - P. 1-5. 21. O'Brien J., Muscara F., Farghal A., Shaikh I. Haematochezia from a Splenic Artery Pseudoaneurysm Communicating with Transverse Colon: A Case Report and Literature Review // Case Reports in Vascular Medicine - 2016. - Vol. 2016. - Article ID 8461501. - 5 pages. - doi:10.1155/2016/8461501.
21. O'Brien J., Muscara F., Farghal A., Shaikh I. Haematochezia from a Splenic Artery Pseudoaneurysm Communicating with Transverse Colon: A Case Report and Literature Review // Case Reports in Vascular Medicine - 2016. - Vol. 2016. - Article ID 8461501. - 5 pages. - doi:10.1155/2016/8461501. 22. Pejkić S., Tomić I., Opačić D., et al. Splenic Artery Aneurysms: Two Cases of Varied Etiology, Clinical Presentation and Treatment Outcome // Srpski Arhiv Za Celokupno Lekarstvo. - 2015. - Vol. 143, № 5-6. - P. 326-331.
22. Pejkić S., Tomić I., Opačić D., et al. Splenic Artery Aneurysms: Two Cases of Varied Etiology, Clinical Presentation and Treatment Outcome // Srpski Arhiv Za Celokupno Lekarstvo. - 2015. - Vol. 143, № 5-6. - P. 326-331. 23. Pescarus R., Montreuil B., Bendavid Y. Giant splenic artery aneurysms: Case report and review of the literature //Journal of Vascular Surgery. - 2005. - Vol. 42, № 2. - P. 344-347.
23. Pescarus R., Montreuil B., Bendavid Y. Giant splenic artery aneurysms: Case report and review of the literature //Journal of Vascular Surgery. - 2005. - Vol. 42, № 2. - P. 344-347. 24. Srinivasan P.H., Vithon G.E., Dhati K.N.M., Rajendran V.R. Sinister Splenic Artery Pseudoaneursym: A Rare Case of Unidentified Aetiology // Journal of Clinical and Diagnostic Research. - 2016. - Vol. 10, № 4. - P. PD01-PD03.
24. Srinivasan P.H., Vithon G.E., Dhati K.N.M., Rajendran V.R. Sinister Splenic Artery Pseudoaneursym: A Rare Case of Unidentified Aetiology // Journal of Clinical and Diagnostic Research. - 2016. - Vol. 10, № 4. - P. PD01-PD03. 25. Tam T.N., Lai K.H., Tsai Y.T., et al. Huge splenic artery aneurysm after portocaval shunt //Journal of Clinical Gastroenterology. - 1988. - Vol. 10, № 5. - P. 565-568.
25. Tam T.N., Lai K.H., Tsai Y.T., et al. Huge splenic artery aneurysm after portocaval shunt //Journal of Clinical Gastroenterology. - 1988. - Vol. 10, № 5. - P. 565-568. 26. Tessier D.J., Stone W.M., Fowl R.J., et al. Clinical features and management of splenic artery pseudoaneurysms: case series and cumulative review of the literature // Journal of Vascular Surgery. - 2003. - Vol. 38, № 5. - P. 969-974.
26. Tessier D.J., Stone W.M., Fowl R.J., et al. Clinical features and management of splenic artery pseudoaneurysms: case series and cumulative review of the literature // Journal of Vascular Surgery. - 2003. - Vol. 38, № 5. - P. 969-974. 27. Varshney P., Songra B., Mathur S., et al. Splenic Artery Pseudoaneurysm Presenting as Massive Hematemesis: A Diagnostic Dilemma // Case Reports in Surgery. - 2014. - Vol. 2014. - Article ID 501937. - 3 pages. - doi:10.1155/2014/501937.
27. Varshney P., Songra B., Mathur S., et al. Splenic Artery Pseudoaneurysm Presenting as Massive Hematemesis: A Diagnostic Dilemma // Case Reports in Surgery. - 2014. - Vol. 2014. - Article ID 501937. - 3 pages. - doi:10.1155/2014/501937. 28. Zampieri F., Gentile V., Lippolis P.V., et al. Giant aneurysm of the splenic artery in an elderly man. Short report and review of the literature // Annali Italiani di Chirurgia. - 2005. - Vol. 76, № 3. - P. 275-279.
28. Zampieri F., Gentile V., Lippolis P.V., et al. Giant aneurysm of the splenic artery in an elderly man. Short report and review of the literature // Annali Italiani di Chirurgia. - 2005. - Vol. 76, № 3. - P. 275-279.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

