2018 год № 1
Теоретическая и экспериментальная медицина
2Хабаровский филиал ДНЦ ФПД - НИИ охраны материнства и детства, 680022, ул. Воронежская, 49, кор. 1, e-mail: iomid@yandex.ru
Резюме:
Ключевые слова:
2Khabarovsk branch of federal state budgetary institution "Far Eastern Scientific Centre of Physiology and Pathology of Respiration" Research Institute of Maternity and Childhood, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Оксидативный стресс является важным патогенетическим звеном развития злокачественных новообразований [7], патологии нервной [9], сердечно-сосудистой [11] и пищеварительной систем [12]. Это определило широкое использование лекарственных препаратов с антиоксидантной активностью в клинической практике [2]. Вместе с тем, чрезмерное угнетение свободнорадикального окисления нарушает функционирование системы активированных форм кислорода (АФК), как важнейших внутриклеточных мессенджеров. АФК вовлечены в базовые процессы жизнедеятельности клетки: пролиферацию, рост, апоптоз [10]. Известно угнетающее влияние антиоксидантов на клеточную пролиферацию in vitro [6]. Сведения о влиянии антиоксидантов на пролиферацию и белок-синтетическую функцию клеток в условиях целостного организма немногочисленны и противоречивы.
Целью исследования был анализ влияния дигидрокверцетина (ДГК) на процессы пролиферации и количество ядрышек в некоторых клеточных популяциях организма белых крыс.
Материалы и методы
|
 |
 |
В экспериментах использовали 3-месячных самцов белых крыс линии Wistar массой 200-250 г. Животным подопытной группы в течение 5 дней ежесуточно внутрибрюшинно вводили ДГК в дозе 50 мг/кг, животным контрольной группы вводили эквиобъемное количество стерильного 0,9 % раствора хлорида натрия. Через 24 часа после заключительного воздействия, животных взвешивали и выводили из эксперимента путем быстрой декапитации под рауш-наркозом парами хлороформа.
Для морфологического исследования тотчас после эвтаназии извлекали и помещали в 10 % раствор формалина глазное яблоко, левое полушарие головного мозга, фрагменты печени и двенадцатиперстной кишки с головкой поджелудочной железы. Для хемилюминесцентного исследования осуществляли забор крови. С этой же целью, фрагмент печени и правое полушарие головного мозга помещали в жидкий азот с последующим гомогенизированием.
Из глазного яблока по принятой в лаборатории методике готовили тотальные препараты роговицы. На препаратах роговицы, окрашенных гематоксилином Лилли-Майера, изучали митотическую активность переднего эпителия роговицы: определяли митотический индекс (в промилле), соотношение фаз митоза и количество патологических митозов типа "мост" и "отставание хромосом" [1].
Ядрышковый аппарат гепатоцитов, гландулоцитов поджелудочной железы, миоцитов двенадцатиперстной кишки, нейронов II и V слоев неокортекса собственной теменной доли и поля СА1 гиппокампа исследовали в препаратах, окрашенных по методу AgNOR [4]. Подсчитывали среднее количество ядрышек в ядрах клеток, просматривая в каждой исследуемой ткани по 200 клеток.
Для интегральной оценки процессов свободнорадикального окисления в гомогенатах печени и головного мозга, а также в сыворотке крови животных использовали метод хемилюминесценции (ХМЛ), которую осуществляли на люминесцентном спектрометре LS 50B "PERKIN ELMER". Определяли следующие показатели: Ssp - светосумма за 1 минуту спонтанной ХМЛ, величина, которая прямо коррелирует с интенсивностью генерации АФК; h - максимум амплитуды быстрой вспышки Fe2+-индуцированного свечения, свидетельствующий о содержании гидроперекисей липидов; Sind-1 - светосумма за 2 минуты Fe2+-индуцированной ХМЛ, отражающая скорость образования перекисных радикалов, преимущественно липидной природы; Н - максимум амплитуды Н2О2-индуцированного люминол-зависимого свечения, величина которая обратно коррелирует с перекисной резистентностью субстрата; Sind-2 - светосумма за 2 минуты Н2О2-индуцированной люминол-зависимой ХМЛ, величина, которая обратно коррелирует с активностью антиоксидантной системы защиты [3].
В эксперименте было использовано 22 крысы. Статистическая обработка результатов исследования проведена с использованием t-критерия Стьюдента с применением программы Statistica 5.0. Различия между группами считали статистически достоверными при p<0,05. Исследование было проведено на базе ЦНИЛ ДВГМУ.
Результаты и обсуждение
|
 |
 |
Пятикратное введение ДГК не вызывало изменения массы тела животных: контрольный показатель составил 236,25±25,6 г; после введения ДГК - 241,88±20,34 г.
Хемилюминесцентный анализ сыворотки крови подопытных животных выявил антиоксидантный эффект пятикратного введения ДГК: все исследованные параметры ХМЛ были достоверно ниже контрольных показателей (табл. 1).
| Контроль (n=11) | Дигидрокверцетин (n=11) | |
|---|---|---|
| сыворотка крови | ||
| Ssp | 0,196±0,010 | 0,122±0,010* |
| Sind-1 | 0,502±0,039 | 0,317±0,030* |
| h | 0,157±0,008 | 0,129±0,005* |
| Sind-2 | 2,448±0,129 | 2,030±0,131* |
| Н | 1,886±0,120 | 1,258±0,084* |
| гомогенаты печени | ||
| Ssp | 0,089±0,006 | 0,058±0,004* |
| Sind-1 | 0,611±0,039 | 0,431±0,029* |
| h | 0,395±0,024 | 0,385±0,026 |
| Sind-2 | 4,009±0,286 | 3,014±0,179* |
| Н | 3,103±0,273 | 2,020±0,186* |
| гомогенаты головного мозга | ||
| Ssp | 0,131±0,011 | 0,089±0,008* |
| Sind-1 | 0,818±0,070 | 0,623±0,035* |
| h | 0,784±0,049 | 0,427±0,043* |
| Sind-2 | 4,198±0,338 | 3,131±0,299* |
| Н | 3,126±0,283 | 2,214±0,207* |
Примечание. * - р<0,05 по отношению к контролю.
Антиоксидантный эффект ДГК проявлялся и на органном уровне. В гомогенатах печени подопытных животных четыре из пяти показателей ХМЛ у животных, подвергнутых введению ДГК, были достоверно ниже контрольных параметров, а в гомогенатах головного мозга имело место достоверное снижение всех показателей ХМЛ (табл. 1).
Таким образом, введение ДГК половозрелым белым крысам оказывает выраженный антиоксидантный эффект: наблюдается снижение интенсивности генерации АФК и повышение активности антиоксидантной защиты.
При подсчете среднего количества ядрышек в клеточных популяциях пищеварительной системы выявлено, что в ядрах гепатоцитов у животных, получавших ДГК, исследуемый показатель не отличался от контрольного уровня (табл. 2).
| Контроль | Дигидрокверцетин | |
|---|---|---|
| пищеварительный тракт | ||
| Гепатоциты | 2,44±0,09 | 2,36±0,07 |
| Миоциты двенадцатиперстной кишки | 2,06±0,05 | 1,77±0,06* |
| Гландулоциты поджелудочной железы | 2,12±0,07 | 1,71±0,06* |
| головной мозг | ||
| Неокортекс собственной теменной доли, II слой | 1,82 ± 0,04 | 1,79 ± 0,09 |
| Неокортекс собственной теменной доли, V слой | 1,82 ± 0,05 | 1,76 ± 0,05 |
| Поле СА1 гиппокампа | 1,92 ± 0,02 | 1,88 ± 0,07 |
Примечание. * - р<0,05 по отношению к контролю.
В ядрах миоцитов циркулярного слоя мышечной оболочки двенадцатиперстной кишки имело место снижение среднего количества ядрышек на 14 %. В ядрах гландулоцитов поджелудочной железы среднее количество ядрышек было снижено на 19,4 % (табл. 2).
В исследованных структурах головного мозга мы не выявили достоверных изменений среднего количества ядрышек в ядрах нейронов (табл. 2). Вместе с тем, при анализе соотношения субпопуляций ядер с разным количеством ядрышек у животных подопытной группы, было обнаружено достоверное увеличение доли одноядрышковых нейронов во II и V слоях неокортекса, а также достоверное уменьшение доли двухъядрышковых нейронов во II слое неокортекса (рисунок).
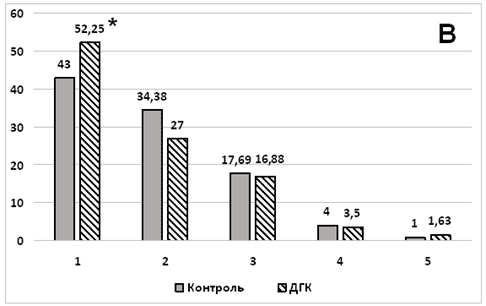
Рис. 1. Гистограмма субпопуляций ядер нейронов с разным количеством ядрышек в неокортексе белых крыс, подвергнутых введению дигидрокверцетина: А - II слой неокортекса собственной теменной доли; В - V слой неокортекса собственной теменной доли
Примечание. * - р<0,05 по отношению к контролю.
Таким образом, в исследованных тканях пищеварительной системы и в головном мозге подопытных животных ДГК снижал активность ядрышкового организатора, что может свидетельствовать об уменьшении белок-синтетической активности клеток.
При анализе митотической активности переднего эпителия роговицы животных, подвергнутых пятикратному введению ДГК, было выявлено существенное (на 45,7 %) уменьшение среднего показателя митотического индекса (табл. 3). При анализе распределения делящихся эпителиоцитов роговицы по фазам митоза было выявлено уменьшение доли метафаз и увеличение доли телофаз. Кроме того, имело место значительное возрастание количества патологических митозов по типу "моста" и "отставания хромосом". Фактором, влияющим на протекание митоза, может быть изменение процесса формирования веретена деления под влиянием биофлавоноида [13].
| Контроль | Дигидрокверцетин | |
|---|---|---|
| Митотический индекс (промилле) | 4,57±0,30 | 2,48±0,37* |
| Профазы (%) | 56,56±2,80 | 58,57±6,02 |
| Метафазы (%) | 22,97±3,04 | 14,11±2,67* |
| Анафазы (%) | 14,21±1,91 | 12,41±2,14 |
| Телофазы (%) | 5,88±0,88 | 13,78±3,44* |
| Патологические митозы, % | 0,380±0,158 | 1,13±0,32* |
Примечание. * - р<0,05 по отношению к контролю.
Результаты проведенного исследования свидетельствуют, что антиоксидантное действие ДГК в условиях in vivo может сопровождаться антипролиферативным и антианаболическим эффектом. Ранее нами были показаны аналогичные эффекты ДГК в первичной культуре пульмональных фибробластов [5].
Выводы
|
 |
 |
1. Пятикратное введение ДГК половозрелым белым крысам в дозе 50 мг/кг оказывает выраженный антиоксидантный эффект: наблюдается снижение интенсивности генерации АФК и повышение активности антиоксидантной защиты в гомогенатах печени и головного мозга, а также в сыворотке крови животных.
2. Пятикратное введение ДГК половозрелым белым крысам приводит к уменьшению количества ядрышек в ядрах миоцитов кишечника и гландулоцитов двенадцатиперстной кишки; в неокортексе собственно теменной доли мозга возрастает доля нейронов с одним ядрышком.
3. У белых крыс, подвергнутых пятикратному введению ДГК, выявлено снижение митотической активности переднего эпителия роговицы и возрастание доли патологических митозов.
Литература |
 |
 1. Алов И.А. Цитофизиология и патология митоза. - Медицина, 1972. - 264 с.
1. Алов И.А. Цитофизиология и патология митоза. - Медицина, 1972. - 264 с.  2. Асташкин Е.И., Глейзер М.Г. Влияние L-карнитина на оксидативный стресс при сердечно-сосудистых заболеваниях // Вопросы неотложной кардиологии. Сборник тезисов IX Всероссийского форума. - Медицинский совет. - 2016. - Т. 10. - С. 104-110.
2. Асташкин Е.И., Глейзер М.Г. Влияние L-карнитина на оксидативный стресс при сердечно-сосудистых заболеваниях // Вопросы неотложной кардиологии. Сборник тезисов IX Всероссийского форума. - Медицинский совет. - 2016. - Т. 10. - С. 104-110. 3. Лебедько О.А., Рыжавский Б.Я., Задворная О.В. Свободнорадикальный статус неокортекса белых крыс и его модификация экзогенными производными тестостерона // Дальневосточный медицинский журнал. - 2011. № 4. - С. 95-99.
3. Лебедько О.А., Рыжавский Б.Я., Задворная О.В. Свободнорадикальный статус неокортекса белых крыс и его модификация экзогенными производными тестостерона // Дальневосточный медицинский журнал. - 2011. № 4. - С. 95-99. 4. Мамаев Н.Н., Мамаева С.Е. Структура и функция ЯОР хромосом: молекулярные, цитологические, клинические аспекты // Цитология. - 1992. - № 10. - С. 3-12.
4. Мамаев Н.Н., Мамаева С.Е. Структура и функция ЯОР хромосом: молекулярные, цитологические, клинические аспекты // Цитология. - 1992. - № 10. - С. 3-12. 5. Сазонова Е.Н., Яковенко Д.В., Лебедько О.А., Мальцева И.М., Тимошин С.С. Цитопротективный эффект дигидрокверцетина в первичной культуре пульмональных фибробластов белых крыс в условиях оксидативного стресса // Дальневосточный медицинский журнал. - 2015. - № 4. - С. 80-83.
5. Сазонова Е.Н., Яковенко Д.В., Лебедько О.А., Мальцева И.М., Тимошин С.С. Цитопротективный эффект дигидрокверцетина в первичной культуре пульмональных фибробластов белых крыс в условиях оксидативного стресса // Дальневосточный медицинский журнал. - 2015. - № 4. - С. 80-83. 6. Chen W., Padilla M.T., Xu X., Desai D., Krzeminski J., Amin S., Lin Y.. Quercetin inhibits multiple pathways involved in interleukin 6 secretion from human lung fibroblasts and activity in bronchial epithelial cell transformation induced by benzo[a]pyrene diol epoxide // Article first published online. - 2015. - Vol. 26. - P. 26-29.
6. Chen W., Padilla M.T., Xu X., Desai D., Krzeminski J., Amin S., Lin Y.. Quercetin inhibits multiple pathways involved in interleukin 6 secretion from human lung fibroblasts and activity in bronchial epithelial cell transformation induced by benzo[a]pyrene diol epoxide // Article first published online. - 2015. - Vol. 26. - P. 26-29. 7. Gupta R.K., Patel A.K., Shah N., Chaudhary A.K., Jha U.K., Yadav U.C., Gupta P.K., Pakuwal U. Oxidative stress and antioxidants in disease and cancer: a review // Asian Pac. J. Cancer Prev. - 2014. - Vol. 15, № 11. - Р. 4405-4409.
7. Gupta R.K., Patel A.K., Shah N., Chaudhary A.K., Jha U.K., Yadav U.C., Gupta P.K., Pakuwal U. Oxidative stress and antioxidants in disease and cancer: a review // Asian Pac. J. Cancer Prev. - 2014. - Vol. 15, № 11. - Р. 4405-4409. 8. Klaunig J.E., Kamendulis L.M. The role of oxidative stress in carcinogenesis // Annu Rev Pharmacol Toxicol. - 2004. - Vol. 44. - P. 239-267.
8. Klaunig J.E., Kamendulis L.M. The role of oxidative stress in carcinogenesis // Annu Rev Pharmacol Toxicol. - 2004. - Vol. 44. - P. 239-267. 9. Matias I., Buosi A.S., Gomes F.C. Functions of flavonoids in the central nervous system: Astrocytes as targets for natural compounds // Neurochem. Int. - 2016. - Vol. 95. - Р. 85-91.
9. Matias I., Buosi A.S., Gomes F.C. Functions of flavonoids in the central nervous system: Astrocytes as targets for natural compounds // Neurochem. Int. - 2016. - Vol. 95. - Р. 85-91.  10. Ray P.D., Huang B.W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling // Cell Signal. - 2012. - Vol. 24, № 5. - P. 981-990.
10. Ray P.D., Huang B.W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling // Cell Signal. - 2012. - Vol. 24, № 5. - P. 981-990.  11. Siti H.N., Kamisah Y., Kamsiah J. The role of oxidative stress, antioxidants and vascular inflammation in cardiovascular disease // Vascul. Pharmacol. - 2015. - Vol. 71. - Р. 40-56.
11. Siti H.N., Kamisah Y., Kamsiah J. The role of oxidative stress, antioxidants and vascular inflammation in cardiovascular disease // Vascul. Pharmacol. - 2015. - Vol. 71. - Р. 40-56.  12. Wang J., Yang X., Zhang J. Bridges between mitochondrial oxidative stress, ER stress and mTOR signaling in pancreatic β cells // Cell Signal. - 2016. - Vol. 28, № 8. - Р. 1099-1104.
12. Wang J., Yang X., Zhang J. Bridges between mitochondrial oxidative stress, ER stress and mTOR signaling in pancreatic β cells // Cell Signal. - 2016. - Vol. 28, № 8. - Р. 1099-1104.  13. Zhou J., Li L.U., Fang L.I., et al. Quercetin reduces cyclin D1 activity and induces G1 phase arrest in HepG2 cells // Oncol. Lett. - 2016. - Vol. 12, № 1. - P. 516-522.
13. Zhou J., Li L.U., Fang L.I., et al. Quercetin reduces cyclin D1 activity and induces G1 phase arrest in HepG2 cells // Oncol. Lett. - 2016. - Vol. 12, № 1. - P. 516-522.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»