2018 год № 2
Хирургия
2ФГБУН "Институт биологических проблем криолитозоны" Сибирского отделения Российской академии наук, 677980, пр. Ленина, 41, тел. 8-(4112)-33-56-90, факс 8-(4112)-33-58-12, e-mail: bio@ibpc.ysn.ru, г. Якутск
Резюме:
Ключевые слова:
2Institute of biological problems of cryolithozone of the Siberian branch of the Russian academy of sciences, Yakutsk
Summary:
Key words:
Введение |
 |
 |
В Республике Саха (Якутия), так же как и во многих других регионах Российской Федерации, острый панкреатит занимает одно из ведущих мест среди ургентной хирургической патологии. В последние годы сохраняется рост частоты развития деструктивных форм с формированием разнообразных осложнений, особенно в группе больных "переживших" фазу панкреатогенного шока и полиорганной дисфункции [1]. Сложившаяся ситуация вызывает тревогу и создает необходимость поиска новых высокоинформативных методов диагностики, а также совершенствования существующих на сегодняшний день принципов и методов консервативного и хирургического лечения. Не стоит также забывать, что тяжелые климатические условия Крайнего Севера создают неблагоприятные условия для нормального функционирования большого числа физиологических процессов в организме, что, несомненно, влечет за собой изменения в характере течения этого заболевания [2, 3].
В последнее десятилетие одним из основных направлений исследований в области патогенеза острого панкреатита является изучение особенностей обменных процессов в клетках поджелудочной железы. Необходимо подчеркнуть, что одним из пусковых механизмов развития аутолитического процесса в тканях железы является дестабилизация клеточной мембраны панкреатоцитов с последующей деструкцией липидного бислоя мембраны клеток. По этой причине, нарушению липидного метаболизма в патогенезе острого панкреатита уделяется все больше внимания. В то же время, тщательный анализ изменений липидного обмена при остром панкреатите, особенно при развитии деструктивного процесса в ткани железы может выявить определенного рода закономерности в плане прогноза неблагоприятных осложнений течения заболевания.
Целью настоящего исследования явилось изучение некоторых особенностей изменений липидного состава крови у больных панкреонекрозом в свете ранней диагностики заболевания.
Материалы и методы
|
 |
 |
Представленная работа основана на анализе результатов комплексного лечения 497 больных с панкреонекрозом в возрасте от 15 до 85 лет, мужчин - 352 (70,8 %), женщин - 145 (29,2 %), находившихся на лечении в хирургических отделениях Республиканской больницы № 2 - Центр экстренной медицинской помощи Республики Саха (Якутия) в период с 2010 по 2017 гг. Диагноз панкреонекроз и его осложнения верифицирован на основании комплексного обследования, включавшего данные физикальных, инструментальных и лабораторных методов исследования. Согласно поставленным задачам, принятой и используемой нами в повседневной практике усовершенствованной классификации панкреонекроза академика РАН и РАМН В.С. Савельева [4], все больные, входящие в группу исследования, были распределены на группы и подгруппы. Первую группу - группа "A", составили больные со стерильными клинико-патоморфологическими формами панкреонекроза - 428 (86,1 %) больных. Вторую группу - группа "B", составили больные с инфицированными клинико-патоморфологическими формами панкреонекроза - 69 (13,9 %). Группа "A" разделена на две подгруппы: подгруппа "a" - больные с ферментативным асцит-перитонитом - 308 (61,9 %) больных, подгруппа "b" - больные с формированием парапанкреатического инфильтрата, морфологическую основу которого составляла "асептическая" флегмона различных отделов забрюшинной клетчатки - 189 (38,1 %) больных. В свою очередь группа "B" разделена на три подгруппы в зависимости от варианта трансформации различных стерильных клинико-патоморфологических форм панкреонекроза в инфицированные: подгруппа "d" - больные с формированием панкреатогенного абсцесса - 17 (24,6 %) больных, подгруппа "e" - больные с формированием инфицированного панкреонекроза - 21 (30,5 %) больных. Подгруппа "f" - больные с формированием инфицированного панкреонекроза в сочетании с панкреатогенным абсцессом - 31 (44,9 %) больных.
Гидролиз и метилирование представленных в исследовании насыщенных (НЖК), ненасыщенных (ННЖК): мононенасыщенных и полиненасыщенных (МНЖК, ПНЖК) жирных кислот (ЖК) производили методом газо-жидкостной хроматографии [8]. Для получения метиловых эфиров жирных кислот использовали метод кислотного гидролиза, 100 мкл сыворотки крови помещали в герметичные контейнеры, добавляли 1 мл 2,5 % метанольного раствора H2SO4 и помещали на один час в термошейкер при 80 °С и 1000 об/мин. После охлаждения до комнатной температуры (20 °С) к полученному раствору добавляли 1 мл 0,9 % раствора NaCI. Далее метиловые эфиры жирных кислот экстрагировали 0,5 мл гексана. Полученную смесь помещали в шейкер на 1 мин., затем центрифугировали 1 мин. при 6,5 g. Метиловые эфиры жирных кислот отбирали декантацией из супернатанта. Для анализа отбирали 200 мкл.
Гексановый экстракт эфиров жирных кислот помещали в автосамплер хроматографа "МАЭСТРО" 7820/5975, построенном на базе газового хроматографа Agilent 7820 и масс-спектрометрического детектора 5975 того же производителя. Для разделения использовали капиллярную колонку HP-INNOWax (30 м, 0,25 мм, 0,25 мкм), скорость газа-носителя (гелий) - 2 мл/мин. Для ввода пробы объемом 10 мкл использовали лайнер без деления потока, температура инжектора - 2700 °С. Температурная программа разделения: 400 °С (5 мин.), 2500 °С (40 мин.). Температура линии соединяющей хроматограф и масс-спектрометр - 2700 °С, температура источника ионов - 2300 °С, температура детектора - 1500 °С. Регистрацию осуществляли по полному ионному току (режим SCAN).
Идентификацию метиловых эфиров жирных кислот проводили с использованием набора стандартов метиловых эфиров жирных кислот фирмы Supelco. 37-Component FAME Mix (кат. номер 18919-1MP) и с применением базы данных NIST. Концентрацию метиловых эфиров жирных кислот определяли по площадям хроматографических пиков соответствующих соединений по методу внутренней нормализации [6]. Общую площадь пиков метиловых эфиров жирных кислот принимали за 100 % и вычисляли процентную концентрацию отдельных жирных кислот по отношение к общему содержанию жирных кислот.
Статистическая обработка материала произведена с использованием статистической программы "StatPlus 2007" для операционной системы Microsoft Office 2007, а также программного пакета IBM.SPSS.Statistiks.v22. При оценке всей совокупности вычислялись средние значения (μ) и стандартное отклонение (σ), коэффициент достоверности отличий (р) двух групп определялся по t-критерию Стьюдента, при оценке большего количества групп наблюдения вводилась поправка Бонферрони. Определение прогностической ценности использования в качестве маркера развития некротического процесса в ткани поджелудочной железы уровень содержания в крови γ-линоленовой кислоты проведено с помощью физико-математической методики - построение ROC-кривых (receiver operating characteristic), так же часто используемой в медицинской аналитике.
Результаты и обсуждение
|
 |
 |
При анализе профиля жирных кислот установлено, что в первые семь суток у неоперированных больных подгрупп "a" и "b" уровень σНЖК значительно превышал контрольные цифры и составлял в плазме крови пациентов подгруппы "a" - 76,22±1,2 %, в основном за счет: пальмитиновой [C 16:0] (55,16±0,8 %), стеариновой [C 18:0] (18,65±0,3 %), миристиновой [С 14:0] (1,65±0,1 %), маргариновой [С 17:0] (0,37±0,5 %) и лауриновой [С 12:0] (0,18±0,1 %); подгруппы "b" - 76,43±1,4 %, за счет: пальмитиновой [C 16:0] (48,17±1,5 %), стеариновой [C 18:0] (21,08±1,1 %), миристиновой [С 14:0] (1,98±0,4 %), маргариновой [С 17:0] (0,57±0,2 %) и лауриновой [С 12:0] (0,21±0,1 %), соответственно. Одновременно с повышением σНЖК снижалось количество σМНЖК - подгруппа "а" (2,04±0,03 %), за счет: миристолеиновой [C 14:1] (0,057±0,01 %), олеиновой [С 18:01Δ9] (1,5±1,5 %); подгруппа "b" (0,10±0,07), за счет: миристолеиновой [C 14:1] (0,021±0,05 %), олеиновой [С 18:01Δ9] (0,9±1,1 %). Наряду с изменениями профиля НЖК и МНЖК изменялся и показатель соотношения σω3-ПНЖК/σω6-ПНЖК, который составлял в подгруппе "а" - 0,009±0,04 ед., подгруппе "b" - 0,005±0,01 ед. Показатель соотношения (для подгруппы "a") уменьшался за счет снижения уровня σω3-ПНЖК (0,20±0,3 %): линоленовой [C 18:3Δ9,12,15] (0,18±0,05 %), цис-5,8,11,14,17-эйкозопентаеновой [С 23:3Δ8,11,14] (0,006±0,1 %) и цис-11,14,17-эйкозатриеновой [С 22:3Δ11,14,17] (0,02±0,1 %). Одновременно отмечалось повышение σω6-ПНЖК в основном за счет арахидоновой кислоты [C 20:4Δ5,8,11,14] (7,07±0,2 %).
В последующие дни значения жирных кислот в крови имели некоторый разброс средних значений, во многом зависящий от эффективности проводимых комплексных лечебных мероприятий. При благоприятном течении заболевания, наряду со снижением σНЖК, повышался уровень σМНЖК и σПНЖК. Напротив, тенденция к снижению содержания σМНЖК и σПНЖК свидетельствовала о неблагоприятном течении заболевания и требовала своевременной коррекции лечения.
Динамика содержания жирных кислот у больных c различными клинико-патоморфологическими формами внутрибрюшных осложнений стерильного панкреонекроза представлен в таблице 1.
| Химический класс | Метиловый эфир ЖК | Подгруппа [а] | Подгруппа [b] | Контроль |
|---|---|---|---|---|
| ω 3-ПНЖК | Линоленовая, [C18:3Δ9,12,15] | 0,18±0,05** | 0,11±0,03** | 0,27±0,02** |
| ω 3-ПНЖК | цис-5,8,11,14,17-Эйкозапентаеновая, [C20:5Δ5,8,11,14,17] | 0,006±0,1* | 0,001±0,7* | 0,032±0,5* |
| ω 3-ПНЖК | цис-11-14-17-Эйкозатриеновая, [C22:3Δ11,14,17] | 0,02±0,1** | 0,01±0,2** | 0,03±0,1** |
| ω 6 ПНЖК | γ-Линоленовая, [C18:3Δ6,9,12] | 0,002±0,03* | 0,0016±0,01* | 0,13±0,01* |
| ω 6 ПНЖК | Линолевая, [C18:2Δ9,12] | 13,39±0,02** | 11,75±0,06** | 16,11±0,05** |
| ω 6 ПНЖК | Арахидоновая, [C20:4Δ5,8,11,14] | 7,07±0,2** | 10,07±0,5** | 3,82±0,04** |
| ω 6 ПНЖК | цис-8,11,14 -Эйкозатриеновая, [C23:3Δ8,11,14] Дигомо-γ-линоленовая | 1,07±0,4** | 1,51±0,1** | 0,94±0,1** |
| ω 6 ПНЖК | цис-13-16-Докозадиеновая, [С22:2Δ13,16] | 0,0042±0,01* | 0,0038±0,08* | 0,02±0,03* |
| ω 6 ПНЖК | цис-11-14-Эйкозадиеновая [С20:2Δ11,14] | 0,008±0,01* | 0,017±0,04* | 0,006±0,02* |
| σω3-ПНЖК | 0,20±0,3** | 0,12±0,1** | 0,33±0,01** | |
| σω6-ПНЖК | 21,54±0,02** | 23,35±0,07** | 21,02±0,02** | |
| σω3-ПНЖК/σω6-ПНЖК, ед. | 0,009±0,04* | 0,005±0,01* | 0,015±0,01* | |
| σ НЖК | 76,22±1,2** | 76,43±1,4** | 72,10±1,0** | |
| σ МНЖК | 2,04±0,03** | 0,10±0,07** | 6,55±0,01** | |
Примечание. * - показатель достоверно отличается от контроля (р<0,05); ** - показатель достоверно отличается от контроля (р<0,01).
У больных с тяжелым течением заболевания, развитием внутрибрюшных осложнений содержание МНЖК и ПНЖК резко снижалось, в то время как уровень НЖК значительно превышал контрольные цифры и составлял в среднем σНЖК (85,36±1,1 %). Высокий их уровень был обусловлен преобладанием пальмитиновой [C 16:0] (59,10±1,4 %), стеариновой [C 18:0] (23,03±0,5 %), миристиновой [С 14:0] (2,1±0,1 %), маргариновой [С 17:0] (0,60±0,1 %) и лауриновой [С 12:0] (0,53±0,2 %) жирных кислот, соответственно, что было значительно выше уровня в группе контроля и у больных без формирования тяжелых внутрибрюшных осложнений.
Проведенная оценка уровня жирных кислот у пациентов с различными вариантами трансформации стерильных форм панкреонекроза в инфицированные - группа "B", показала, что характер сдвигов профиля жирных кислот, так же как и в группе "A", напрямую зависел от распространенности и выраженности гнойно-некротического процесса.
В первые трое суток у больных подгруппы "d" и в первые семь суток у больных подгрупп "e" и "f" уровень НЖК в плазме превышал контрольные цифры в несколько раз (особенно выражено в подгруппах "e" и "f") и составлял в плазме крови подгруппы "e" - σНЖК (78,17±1,4 %), подгруппы "f" - (74,94±1,4 %). В основном за счет: пальмитиновой [C 16:0], стеариновой [C 18:0], миристиновой [С 14:0], маргариновой [С 17:0] и лауриновой [С 12:0].
Представленные значения концентраций НЖК подгрупп "e" и "f", как правило, превышали уровень концентраций НЖК больных подгруппы "d". Высокое их содержание в период исследования было обусловлено, в основном, за счет жирных кислот: пальмитиновой [C 16:0] (50,05±0,1 %), стеариновой [C 18:0] (21,27±0,5 %), миристиновой [С 14:0] (2,91±0,2 %), маргариновой [С 17:0] (1,43±0,5 %) и лауриновой [С 12:0] (0,88±0,1 %).
В послеоперационном периоде значения НЖК, в основном, зависели от эффективности проводимых комплексных лечебных мероприятий. При благоприятном течении послеоперационного периода, наряду со снижением НЖК в плазме крови, отмечалось относительное повышение уровня МНЖК и ПНЖК. Напротив, тенденция к снижению содержания МНЖК и ПНЖК, как и в группе "A", свидетельствовала о декомпенсации органов и систем.
Динамика содержания жирных кислот у оперированных больных c различными клинико-патоморфологическими формами внутрибрюшных осложнений инфицированного панкреонекроза представлена в таблице 2.
Анализ концентраций отдельных ПНЖК показал, что уровень ω3-ПНЖК, таких как цис-5,8,11,14,17-эйкозапентаеновая [C20:5Δ5,8,11,14,17] и цис-11-14-17-эйкозатриеновая [С22:3Δ11,14,17] критически снижался по ходу наблюдения до "следовых" концентраций (0,0004±0,5 %) и (0,008±0,05 %) соответственно, по сравнению с контролем. В то же время отмечено значительное повышение ω6-ПНЖК - арахидоновой [С20:4Δ5,8,11,14] (15,66±0,5 %) по отношению к другим ω6-ПНЖК и контролю (табл. 2).
Таким образом, суммарный уровень ω6-ПНЖК был повышен при остром деструктивном панкреатите с более распространенными и тяжелыми формами, в том числе в стадию инфекционных осложнений, а уменьшение коэффициента ω3-ПНЖК/ω6-ПНЖК за счет цис-5,8,11,14,17-эйкозапентаеновой [C20:5Δ5,8,11,14,17] и цис-11-14-17-эйкозатриеновой [С22:3Δ11,14,17] кислот отмечалось в течение всего периода наблюдения и было особенно выраженным в подгруппах с инфицированными клинико-патоморфологическими формами панкреонекроза. Изменения в ПНЖК характеризовались снижением уровня σω3-ПНЖК по сравнению с контролем. Соотношение σω3-ПНЖК/ω6-ПНЖК достоверно снижалось у больных со стерильными формами панкреонекроза более чем в 2 раза (p<0,05), с инфекционными осложнениями более чем в 10 раз (p<0,05). Приведенные результаты свидетельствуют, что у пациентов с осложненным течением заболевания отмечены более выраженные нарушения жирнокислотного состава сыворотки крови за счет группы жирных кислот ω-3 и ω-6, сохранявшиеся в течение всего периода наблюдения. При этом отмечено увеличение коэффициента НЖК/ННЖК, максимально выраженные в начале наблюдений. Эти изменения связаны, по-видимому, с тем, что при липолизе в первую очередь мобилизуются ННЖК, которые и окисляются первыми [9]. У больных с осложненным течением острого деструктивного панкреатита, по нашим наблюдениям, имеют место быть более выраженные изменения жирнокислотного состава крови.
Считаем необходимым, завершая анализ профиля жирных кислот, остановиться на отдельных наблюдениях, которые в значительной степени повлияли на итог работы. При анализе концентраций отдельных ПНЖК (учитывая тот факт, что исследования проводились как с определением относительных концентраций - %, так и определением абсолютных концентраций - мкг/мл), мы столкнулись с необычным поведением одной из ω6-ПНЖК, которой явилась γ-линоленовая кислота [С 18:3Δ6,9,12].
| Химический класс | Метиловый эфир ЖК | Подгруппа [e] | Подгруппа [f] | Подгруппа [d] | Контроль |
|---|---|---|---|---|---|
| ω3-ПНЖК | Линоленовая, [C18:3Δ9,12,15] | 0,04±0,1** | 0,01±0,01** | 0,21±0,03** | 0,27±0,02** |
| ω3-ПНЖК | цис-5,8,11,14,17-Эйкозапентаеновая, [C20:5Δ5,8,11,14,17] | 0,0009±0,5* | 0,0004±0,5* | 0,001±0,1* | 0,032±0,5* |
| ω3-ПНЖК | цис-11-14-17-Эйкозатриеновая, [C22:3Δ11,14,17] | 0,009±0,01** | 0,008±0,05** | 0,01±0,5** | 0,03±0,1** |
| ω 6 ПНЖК | γ-Линоленовая, [C18:3Δ6,9,12] | 0,00089±0,15* | 0,00037±0,07* | 0,001±0,07* | 0,13±0,01* |
| ω6-ПНЖК | Линолевая, [C18:2Δ9,12] | 7,05±0,01** | 5,75±0,04** | 10,33±0,01** | 16,11±0,05** |
| ω6-ПНЖК | Арахидоновая, [C20:4Δ5,8,11,14] | 12,44±0,3** | 15,66±0,5** | 12,22±0,7** | 3,82±0,04** |
| ω6-ПНЖК | цис-8,11,14 -Эйкозатриеновая, [C23:3Δ8,11,14] Дигомо-γ-линоленовая | 2,21±0,1** | 3,59±0,6** | 1,55±0,1** | 0,94±0,1** |
| ω6-ПНЖК | цис-13-16-Докозадиеновая, [С22:2Δ13,16] | 0,0015±0,07* | 0,0011±0,01* | 0,0019±0,05* | 0,02±0,03* |
| ω6-ПНЖК | цис-11-14-Эйкозадиеновая [С20:2Δ11,14] | 0,015±0,03* | 0,019±0,01* | 0,009±0,03* | 0,006±0,02* |
| σω3-ПНЖК | 0,04±0,1** | 0,01±0,9** | 0,22±1,1** | 0,33±0,01** | |
| σω6-ПНЖК | 21,71±0,05** | 25,02±0,01** | 24,11±0,02** | 21,02±0,02** | |
| σω3-ПНЖК/σω6-ПНЖК, ед. | 0,001±0,01* | 0,0004±0,06* | 0,009±0,03* | 0,015±0,01* | |
| σ НЖК | 78,17±1,4** | 74,94±1,1** | 74,56±1,8** | 72,10±1,0** | |
| σ МНЖК | 0,08±0,04** | 0,03±0,01** | 1,11±0,03** | 6,55±0,01** | |
Примечание. * - показатель достоверно отличается от контроля (р<0,05); ** - показатель достоверно отличается от контроля (р<0,01).
Наши наблюдения выявили, что при применении методики определения концентраций жирных кислот в мкг/мл, начиная с первых суток от момента поступления больного в стационар, наблюдалось полное отсутствие в крови γ-линоленовой кислоты. При этом пороговое значение (при котором достоверно верифицируется панкреонекроз) составляет 0,1 мгк/мл. Лишь на 10-е сутки при благоприятном течении заболевания и объективном улучшении состояния пациента отмечено появление γ-линоленовой кислоты в абсолютных значениях - 0,2-0,5 мкг/мл. При этом чувствительность представленного показателя составляет 94 %, специфичность 95 %. Этот факт позволял нам практически безошибочно верифицировать развитие некротического процесса уже в первые 24 часа, тогда как достоверные признаки некроза ткани поджелудочной железы (по данным РКТ) фиксировались по истечению 72-96 часов. Достоверное обнаружение зон некроза по данным РКТ (временные рамки) подтверждается рядом исследователей [7] и является на сегодняшний день неоспоримым фактом.
Поведение же других жирных кислот, в том числе из групп НЖК, МНЖК, ПНЖК не отличалось такой строгой закономерностью, что, по нашему мнению, обусловлено уникальностью этой ω6-ПНЖК, которая во многом, по-видимому, зависит от ее местоположения (I ступень) в каскаде биосинтеза непредельных жирных кислот, и в частности, линолевой кислоты (рисунок 1), также отводя ей регуляторную роль. Данный механизм косвенно подтверждается рядом исследователей [5, 10].
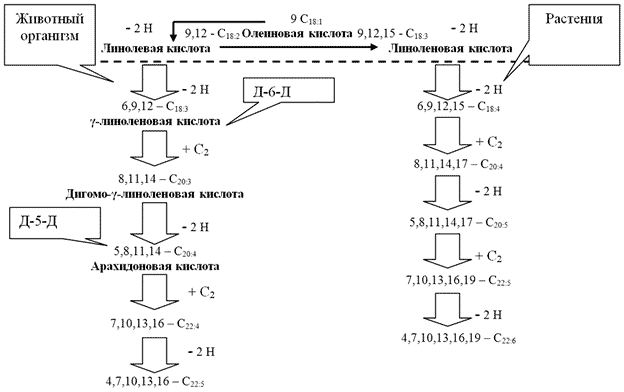
Рис. 1. Схема биосинтеза непредельных жирных кислот в животных и растительных клетках на примере линолевой кислоты [C 18:2Δ9,12]
Кроме того из литературных данных известно [10], что γ-линоленовая кислота самостоятельно образуется в человеческом организме из линолевой кислоты [С 18:2Δ9,12] (рисунок), которая относится к незаменимым ω6-ПНЖК. Этот процесс протекает медленно, поскольку он нуждается в ферменте дельта-6-десатураза, активность которого нередко подавляется в результате избыточного содержания в крови сахара (что часто наблюдается при остром деструктивном панкреатите). Учитывая данный факт, стоит предполагать, что во время развития некротического процесса в ткани поджелудочной железы отмечается резкое снижение уровня инсулина и повышение уровня сахара крови, что в конечном итоге, приводит к блокированию фермента дельта-6-десатуразы, с последующим критическим снижением концентрации в крови γ-линоленовой кислоты.
Также необходимо учесть тот факт, что одной из важнейшей функции ПНЖК (в том числе γ-линоленовой кислоты), является участие в синтезе простагландинов (эйкозаноидов) [10]. Различные простагландины, являясь тканевыми регуляторами, обладают разноплановым действием, на ткани, зачастую прямо противоположным. В ходе превращения линолевой кислоты в арахидоновую и, в конечном итоге, в простагландины есть две основные ступени, контролируемые ферментами. Первая, ключевая стадия, контролируется ферментом дельта-6-десатуразой (Д-6-Д), а вторая ступень, другим ферментом - дельта-5-десатуразой (Д-5-Д). При повышении в крови сахара происходит инактивация или угнетение фермента дельта-6-десатуразы, в результате нарушается синтез промежуточных метаболитов на ступенях каскада (линолевая - γ-линоленовая - дигомо-γ-линоленовая - арахидоновая кислоты - простагландины), необходимых для получения противовоспалительных простагландинов. В то же время происходит активация фермента дельта-5-десатуразы, что приводит к образованию простагландинов других видов, обладающих провоспалительным эффектом.
Некоторыми исследователями доказано [10], что введение в организм терапевтических доз γ-линоленовой кислоты (порядка 10-50 мг/сут.), способно прервать механизм угнетения дельта-6-десатуразы и направить биосинтез в нужном направлении, что в конечном итоге обеспечит образование противовоспалительных простагландинов и благоприятно скажется на состоянии метаболизма у пациента. Учитывая данное обстоятельство, использование лекарственных препаратов и биологически активных добавок, содержащих γ-линоленовую кислоту, является перспективным направлением в лечении разного рода воспалительных процессов, в том числе, по-видимому, и острого панкреатита.
Выводы
|
 |
 |
- Наблюдения показали, что суммарный уровень жирных кислот при остром деструктивном панкреатите был повышен в 5-7 раз (p<0,01) относительно контроля. При этом значения коэффициента соотношения σω3-ПНЖК/ω6-ПНЖК достоверно снижалось у больных со стерильными клинико-патоморфологическими формами панкреонекроза более чем в 2 раза (p<0,05), а с инфекционными осложнениями более чем в 10 раз (p<0,05).
- Результаты исследований наглядно свидетельствуют, что у пациентов с осложненным течением заболевания наблюдаются более выраженные нарушения жирнокислотного состава сыворотки крови за счет группы жирных кислот ω-3 и ω-6, сохраняющиеся в течение всего периода острой фазы заболевания. При этом, отмечается увеличение коэффициента НЖК/ННЖК. Эти изменения связаны, по-видимому, с тем, что при липолизе в первую очередь мобилизуются ННЖК, которые и окисляются первыми.
- Наиболее значимым показателем в дифференциальной диагностике некротического панкреатита от интерстициального является достоверное (чувствительность - 94 %, специфичность - 95 %) снижение уже в ранние сроки (до 24 часов) развития некротического процесса содержания в крови γ-линоленовой кислоты ниже 0,1 мкг/мл
Литература |
 |
 1. Винокуров М.М., Аммосов В.Г., Савельев В.В., Гоголев Н.М. Острый деструктивный панкреатит. Оптимизация хирургической лечебной тактики. - Якутск: Издательский дом СВФУ, 2016. - 136 с.
1. Винокуров М.М., Аммосов В.Г., Савельев В.В., Гоголев Н.М. Острый деструктивный панкреатит. Оптимизация хирургической лечебной тактики. - Якутск: Издательский дом СВФУ, 2016. - 136 с. 2. Емельянова Э.А., Сафонова С.Л., Васильева Т.Я., Копылова Д.В. Распространенность болезней органов пищеварения среди взрослого населения Якутии за 2005-2009 гг. // Материалы Межрегиональной научно-практической конференции "Актуальные вопросы гастроэнтерологии и диетологии". - Якутск, 2011. - С. 138-143.
2. Емельянова Э.А., Сафонова С.Л., Васильева Т.Я., Копылова Д.В. Распространенность болезней органов пищеварения среди взрослого населения Якутии за 2005-2009 гг. // Материалы Межрегиональной научно-практической конференции "Актуальные вопросы гастроэнтерологии и диетологии". - Якутск, 2011. - С. 138-143. 3. Петрова П.Г., Кершенгольц Б.М., Колосова О.Н., Мельцер И.М. Влияние нарушений экологических равновесий на здоровье населения Севера на примере Республики Саха (Якутия) // Дальневосточный медицинский журнал. - 2001. - № 4. - С. 5-10.
3. Петрова П.Г., Кершенгольц Б.М., Колосова О.Н., Мельцер И.М. Влияние нарушений экологических равновесий на здоровье населения Севера на примере Республики Саха (Якутия) // Дальневосточный медицинский журнал. - 2001. - № 4. - С. 5-10. 4. Савельев В.С., Кириенко А.И. Клиническая хирургия: нац. рук.: в 3 т. / под ред. В.С. Савельев, А.И. Кириенко. - М.: Издательство ГЭОТАР-Медиа, 2009. - Т. II. - 832 с.
4. Савельев В.С., Кириенко А.И. Клиническая хирургия: нац. рук.: в 3 т. / под ред. В.С. Савельев, А.И. Кириенко. - М.: Издательство ГЭОТАР-Медиа, 2009. - Т. II. - 832 с. 5. Титов В.Н., Лисицын Д.М. Иные представления об образовании кетоновых тел, кинетике β-окисления жирных кислот в патогенезе кетоацидоза // Клиническая лабораторная диагностика. - 2005. - № 3. - С. 3-9.
5. Титов В.Н., Лисицын Д.М. Иные представления об образовании кетоновых тел, кинетике β-окисления жирных кислот в патогенезе кетоацидоза // Клиническая лабораторная диагностика. - 2005. - № 3. - С. 3-9. 6. Шаповалова Е.Н., Пирогов А.В. Хроматографические методы анализа: метод. пособие / под ред. О.А. Шпигуна. - М.: Издательство МГУ, 2007. - 109 с.
6. Шаповалова Е.Н., Пирогов А.В. Хроматографические методы анализа: метод. пособие / под ред. О.А. Шпигуна. - М.: Издательство МГУ, 2007. - 109 с. 7. Balthazar E.J. Acute pancreatitis: assessment of severity with clinical and CT evaluation // J. Radiology. - 2002. - Vol. 223, № 3. - P. 603-613.
7. Balthazar E.J. Acute pancreatitis: assessment of severity with clinical and CT evaluation // J. Radiology. - 2002. - Vol. 223, № 3. - P. 603-613. 8. Ullah R., Murphy B., Dorich B., Richter B., Srinivasan K. Fat extraction from acid- and base-hydrolyzed food samples using accelerated solvent extraction // J. Agric. Food Chem. - 2011. - Vol. 59. - P. 2169-2174.
8. Ullah R., Murphy B., Dorich B., Richter B., Srinivasan K. Fat extraction from acid- and base-hydrolyzed food samples using accelerated solvent extraction // J. Agric. Food Chem. - 2011. - Vol. 59. - P. 2169-2174. 9. Vege S.S., Gardner T.B., Chari S.T., et al. Low mortality and high morbidity in severe acute pancreatitis without organ failure: a case for revising the Atlanta classification to include "moderately severe acute pancreatitis" // Amer. J. Gastroenterol. - 2009. - Vol. 104. - P. 710-715.
9. Vege S.S., Gardner T.B., Chari S.T., et al. Low mortality and high morbidity in severe acute pancreatitis without organ failure: a case for revising the Atlanta classification to include "moderately severe acute pancreatitis" // Amer. J. Gastroenterol. - 2009. - Vol. 104. - P. 710-715. 10. Zintl F. Fatty acid compositions of lymphocyte membrane phospholipids in children with acute leukemia // Alternative Medicine Review. - 2004. - Vol. 9, № 1. - P. 70.
10. Zintl F. Fatty acid compositions of lymphocyte membrane phospholipids in children with acute leukemia // Alternative Medicine Review. - 2004. - Vol. 9, № 1. - P. 70.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»