2019 год № 3
Теоретическая и экспериментальная медицина
2Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел./факс 8-(4212)-30-53-11, e-mail: nauka@mail.fesmu.ru;
3Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук, 690022, пр. 100 лет Владивостоку, 159, тел./факс 8-(423)-231-40-50, г. Владивосток
Резюме:
Ключевые слова:
2Far Eastern State Medical University, Khabarovsk
3G.B. Elyakov Pacific Institute of Bioorganic Chemistry, FEB RAS, Vladivostok
Summary:
Key words:
Введение |
 |
 |
Интерстициальные болезни легких (ИБЛ), основным патофизиологическим механизмом которых является фиброзное ремоделирование, представляют собой сложную проблему детской пульмонологии. Хроническое прогрессирующее течение ИБЛ, нередко приводящее к инвалидизации, и резистентность к имеющейся на данный момент терапии диктуют необходимость поиска новых лекарственных средств. Молекулярной основой формирования легочного фиброза является оксидативный стресс, вызывающий нарушение редокс-сенситивной регуляции процессов пролиферации, апоптоза, дифференцировки, миграции мезенхимальных и эпителиальных клеток [12]. Эхинохром А (2,3,5,6,8-пента-гидрокси-7-этил-1,4-нафтохинон) - хиноидный пигмент морских беспозвоночных, обладающий выраженными антиоксидантными антирадикальными свойствами [11, 13]. В настоящее время на его основе разрабатывается пероральная лекарственная форма. Ранее на экспериментальной модели блеомицин-индуцированного пневмофиброза нами был выявлена способность эхинохрома А снижать выраженность оксидативного стресса в легких, предотвращать развитие гипертрофии межальвеолярной соединительной ткани и лимфоидной перибронхиальной инфильтрации, нормализовать соотношение удельного объема межальвеолярных перегородок и просветов альвеол [3, 4].
Известно, что оксидативный стресс приводит к накоплению в тканях и биологических жидкостях токсических веществ - продуктов окислительной деструкции белков, липидов, карбогидратов и ДНК,- которые относят к эндотоксинам [14]. При этом проявления эндотоксикоза как типичного патологического процесса определяются как на органном, так и на системном уровнях.
В связи с чем, целью работы явилась оценка эффективности влияния антиоксиданта эхинохрома А на некоторые показатели эндогенной интоксикации в легких и крови при блеомицин-индуцированном пневмофиброзе у белых крыс на раннем этапе постнатального онтогенеза.
Материалы и методы
|
 |
 |
Эксперимент поставлен на крысах линии Вистар. Животные были разделены на три группы. Первая группа - "блеомицин" - введение блеомицина крысам в возрасте 30 дней, однократное, в/брюшинное, в дозе 1 мг/кг (8 крыс). Вторая группа "блеомицин+эхинохром" - введение блеомицина, как и в первой группе, а также введение эхинохрома А через желудочный зонд в форме водного раствора, приготовленного ex tempore, в дозе 10 мг/кг в течение 5 суток (в день введения блеомицина, а также на 2-, 3-, 4- и 5-е сутки после этого - 9 крыс). Третья группа - "контроль" - однократное, в/введение 30-дневным крысам физраствора в эквиобъемных блеомицину дозах (8 крыс). Все животные содержались в условиях одного вивария, корм и воду получали ad libitum. Эвтаназию крыс проводили в возрасте 45 дней, декапитацией.
Легкие фиксировали в жидкости Карнуа, заливали по стандартной методике в парафин. Готовили срезы толщиной 7 мкм, окрашивали их гематоксилином и эозином. Препараты подвергались обзорному изучению. В гомогенатах легких и плазме крови определяли интегральные показатели, отражающие тяжесть эндогенной интоксикации: интенсивность свободнорадикальных процессов, уровень молекул средней массы (МСМ).
Активность свободнорадикального окисления исследовали методом хемилюминесценции (ХМЛ) на люминесцентном спектрометре LS 50B ("PERKIN ELMER",USA) по методикам, описанным ранее [2]. Регистрировали параметры спонтанного и активированного свечения: Ssp - светосумму за 1 минуту спонтанной ХМЛ, величина которой прямо коррелирует с интенсивностью процессинга свободных радикалов; h - максимум амплитуды быстрой вспышки Fe2+ - индуцированного свечения, свидетельствующий о содержании гидроперекисей липидов; Sind1 - светосумму за 2 минуты Fe2+ - индуцированной ХМЛ, отражающую скорость образования перекисных радикалов; Sluc - светосумму за 1 минутy люцигенин-зависимой ХМЛ, свидетельствующую о продукции супероксид-анион радикалов; Н - максимум амплитуды Н2О2-индуцированного люминол-зависимого свечения, величина которого обратно коррелирует с перекисной резистентностью субстрата; Sind2 - светосумму за 2 минуты Н2О2-индуцированной люминол-зависимой ХМЛ, величина которой обратно коррелирует с активностью антиоксидантной антирадикальной системы защиты. Интенсивность ХМЛ, измеренную в милливольтах, рассчитывали на 1 мг ткани или на 1 мл плазмы крови и выражали в относительных единицах.
Анализ содержания МСМ при λ-280 нм и λ-254 нм осуществляли по методике [1] на UV-спектрофотометре ("SHIMADZU", Japan). При λ- 280 нм оценивали ароматическую фракцию (ароматические аминокислоты) МСМ, при и λ-254 нм - токсическую фракцию (гидрофобные токсины, продукты неполного распада белков) МСМ. Коэффициент распределения молекул средней массы рассчитывали по формуле: К=МСМ λ-280 / МСМ λ-254.
Статистическую обработку результатов проводили с помощью t критерия Стьюдента в программе Statistica 6.0. Различия между группами считали достоверными при p<0,05.
Результаты и обсуждение
|
 |
 |
Как и в ранее проведенных экспериментальных исследованиях [3, 4] нами было установлено, что в дорепродуктивном периоде даже однократное воздействие блеомицина вызывало в легких белых крыс патоморфологические изменения, свидетельствующие о развитии пневмофиброза (рисунок).
Оценка ХМЛ параметров свободнорадикального статуса легких и крови животных группы "блеомицин" продемонстрировала наличие оксидативного стресса, более выраженного на органном уровне (табл. 1). В сравнении с аналогичными показателями группы "контроль" зарегистрировано увеличение: Ssp в 2,6- и 1,9 раза, Sind1 в 3,2- и 2,5 раза, h в 3,1- и 2,3 раза, Sind2 в 3,4- и 2,6 раза, H в 3,2- и 2,5 раза в легких и крови, соответственно. Генерация суперок-сид- анион радикалов (Sluc) - запускающих цепь цито- и генотоксических эффектов блеомицина [7] возросла в легких в 2,8 раз, в крови - в 2,1раза. Поскольку в развитии эндогенной интоксикации важную роль играют процессы деградации макромолекул, обусловленные гиперактивацией свободнорадикального окисления [5], закономерным является зарегистрированное нами изменение содержания МСМ в легких и крови крыс, подвергнутых воздействию блеомицина.
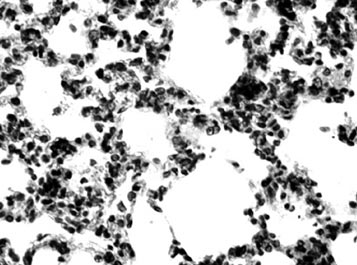
Рис. Гипертрофия интерстициальной межальвеолярной соединительной ткани легкого крысы группы "блеомицин". Окраска гематоксилином и эозином. Ув. 40×10
| Показатель | Группа "контроль" | Группа "блеомицин" | Группа "блеомицин + эхинохром А" |
|---|---|---|---|
| Гомогенаты легких | |||
| Ssp | 0,094±0,006 | 0,246±0,015* | 0,130±0,009*,** |
| Sind1 | 0,80±0,05 | 2,62±0,14* | 1,41±0,08*,** |
| h | 0,61±0,04 | 1,93±0,12* | 1,00±0,08*,** |
| Sind2 | 2,18±0,12 | 7,36±0,25* | 3,14±0,14*,** |
| H | 1,33±0,11 | 4,68±0,17* | 2,30±0,12*,** |
| Sluc | 0,075±0,005 | 0,214±0,012* | 0,108±0,007*,** |
| Плазма крови | |||
| Ssp | 0,138±0,010 | 0,268±0,012* | 0,153±0,009** |
| Sind1 | 0,362±0,027 | 0,901±0,046* | 0,421±0,034** |
| h | 0,146±0,009 | 0,340±0,010* | 0,165±0,011** |
| Sind2 | 2,330±0,125 | 6,011±0,277* | 2,509±0,130** |
| H | 1,544±0,090 | 3,920±0,154* | 1,710±0,084** |
| Sluc | 0,119±0,008 | 0,255±0,010* | 0,132±0,009** |
Примечание. * - p<0,05 - по отношению к группе "контроль"; ** - p<0,05 - по отношению к группе "блеомицин".
На фоне развития локального и системного оксидативного стресса, в сравнении с контрольными уровнями содержание молекул средней массы (МСМλ-254 и МСМλ-280) в легких крыс группы "блеомицин" было повышено на 230- и 82 %, соответственно, в плазме крови - увеличено на 109- и 27 %, соответственно (табл. 2). Изменение величины Кλ-280/λ-254 свидетельствовало о смещении в спектре МСМ в сторону токсической фракции, и этот процесс был более значимо представлен на органном уровне (в легких снижение Кλ-280/λ-254 на 46 %, в плазме крови - на 39 %).
Таким образом, при блеомицин-индуцированном пневмофиброзе имели место локальные и системные проявления эндогенной интоксикации: наблюдались соответствующие изменения исследуемых показателей, наиболее выраженные в органе-мишени - в легких. Последнее обстоятельство также подтверждает характеристику блеомицина как пневмотоксического агента прооксидантного действия [6, 10] на фоне низкого уровня экспрессии гена блеомицин-гидролазы и, соответственно, низкого уровня активности этого фермента в легких, по сравнению с другими органами [8].
| Показатель | Группа "контроль" | Группа "блеомицин" | Группа "блеомицин + эхинохром А" |
|---|---|---|---|
| Гомогенаты легких | |||
| МСМλ-254 | 0,189+0,014 | 0,624+0,021* | 0,318+0,018*,** |
| МСМλ-280 | 0,107+0,008 | 0,195+0,010* | 0,154+0,011*,** |
| Кλ-280/λ-254 | 0,57+0,019 | 0,31+0,015* | 0,48+0,022*,** |
| Плазма крови | |||
| МСМλ-254 | 0,203+0,008 | 0,424+0,012* | 0,224+0,006** |
| МСМλ-280 | 0,249+0,010 | 0,317+0,009* | 0,262+0,011** |
| Кλ-280/λ-254 | 1,24+0,033 | 0,76+0,023* | 1,16+0,027** |
Примечание. * - p<0,05 - по отношению к группе "контроль", ** - p<0,05 - по отношению к группе "блеомицин".
Введение эхинохрома А снизило выраженность оксидативного стресса в легких крыс, получивших инъекцию блеомицина: величины Ssp, Sluc, Sind1, h, Sind2, H, в группе "блеомицин+эхинохром" были достоверно меньше, чем в группе "блеомицин" - в 1,9-, 2,0-, 1,9-, 2,0-, 2,4-, 2,3 раза, соответственно, но сохраняли свое отличие от контроля. На системном уровне эхинохром А действовал более эффективно: все исследуемые ХМЛ-показатели плазмы крови не имели достоверных отличий от контрольных величин (табл. 1).
Уровни молекул средней массы продемонстрировали аналогичную реакцию на введение эхинохрома А. В легких крыс группы "блеомицин+эхинохром" содержание МСМ не достигло контрольных цифр, но значительно снизилось в сравнении с аналогичными величинами группы "блеомицин": МСМλ-254 на 49 %, МСМλ-280 на 21 %, что соответствующим образом отразилось на коэффициенте распределения. Кλ-280/λ-254 увеличился на 55 %. Следовательно, эхинохром А в большей степени снижал токсическую фракцию МСМ, чем ту, в которую входят ароматические аминиокислоты, приближая тем самым соотношение этих фракций к физиологическому. В плазме крови концентрация МСМλ-254 и МСМλ-280, величина Кλ-280/λ-254 у животных группы "блеомицин+эхинохром" соответствовали контрольным показателям (табл. 2).
На фоне коррекции локальных и системных метаболических проявлений эндотоксикоза животные группы "блеомицин+эхинохром" по морфологическим показателям легких не имели достоверных отличий от крыс контрольной группы.
Известно, что Эхинохром А, в отличие от основных эндогенных антиоксидантов, способен одновременно блокировать ряд звеньев свободнорадикального окисления. Эхинохром А является перехватчиком активных форм кислорода, в т. ч. супероксид-анион радикалов, хелатором ионов переменно-валентных металлов, нейтрализует перекисные радикалы липидной природы, ингибирует перекисное окисление липидов, следовательно участвует в регуляции редокс-сенситивных процессов клеточного цикла и клеточного метаболизма [11, 13].
Полученные нами данные о протективных свойствах эхинорома А представляют интерес и с перспективы возможности его применения как метода сопровождения противоопухолевой химиотерапии (с использованием блеомицина) у детей. Одним из грозных осложнений подобной терапии является индуцированный блеомицином интерстициальный пульмонит с исходом в пневмофиброз [9]. Интересно, что один из структурных аналогов эхинохрома А - спинохром D - in vitro продемонстрировал протективный эффект в отношении выживаемости кардиомицитов линии АС16, подвергнутых воздействию противоопухолевого антибиотика доксорубицина, известного своими кардиотоксичными свойствами. Механизм протективного действия спинохрома D включал снижение выраженности оксидативного стресса, коррекцию метаболизма глутатиона, увеличение продукции АТФ [15].
Таким образом, на модели блеомицин-индуцированного пневмофиброза, развивающегося на раннем этапе постнатального онтогенеза, установлено, что при введении per os эхинохром А (2,3,5,6,8-пента-гидрокси-7-этил-1,4-нафтохинон) эффективно корригирует проявления эндотоксикоза как на органном (в легких), так и на системном уровнях.
Выводы
|
 |
 |
1. В легких и крови 45-суточных крыс с блеомицин-индуцированным пневмофиброзом (вследствие однократного введения блеомицина в возрасте 30-суток), наблюдалось развитие оксидативного стресса, повышение уровня МСМ, сдвиг соотношения К λ-280/ λ-254 в сторону токсического пула МСМ. Все эти метаболические процессы, характеризующие эндогенную интоксикацию, были более выражены на органном (в легких), чем на системном (в крови) уровне.
2. Введение Эхинохрома А крысам per os (однократно, ежесуточно, в возрасте с 30 по 34 сутки), подвергнутым воздействию блеомицина, предотвратило развитие пневмофиброза, значительно ослабило метаболические проявления эндотоксикоза в легких и полностью нивелировало - в крови животных.
Работа поддержана грантом 18-4-037 программы "Приоритетные научные исследования в интересах комплексного развития Дальневосточного отделения РАН".
Литература |
 |
 1. Габриэлян Н.И., Левицкий Э.Р., Дмитриев А. А. и др. Скрининговый метод определения средних молекул в биологических жидкостях: метод, рекомендации. - М., 1985. - 18 с.
1. Габриэлян Н.И., Левицкий Э.Р., Дмитриев А. А. и др. Скрининговый метод определения средних молекул в биологических жидкостях: метод, рекомендации. - М., 1985. - 18 с. 2. Лебедько О.А., Рыжавский Б.Я., Задворная О.В. Свободнорадикальный статус неокортекса белых крыс и его модификация экзогенными производными тестостерона // Дальневосточный медицинский журнал. - 2011. - № 4. - С. 95-99.
2. Лебедько О.А., Рыжавский Б.Я., Задворная О.В. Свободнорадикальный статус неокортекса белых крыс и его модификация экзогенными производными тестостерона // Дальневосточный медицинский журнал. - 2011. - № 4. - С. 95-99.  3. Лебедько О.А., Рыжавский Б.Я., Демидова О.В. Влияние антиоксиданта эхинохрома А на блеомицин-индуцированный пневмофиброз // Бюллетень экспериментальной биологии и медицины. - 2015. - Т. 159, № 3. - С. 329-332.
3. Лебедько О.А., Рыжавский Б.Я., Демидова О.В. Влияние антиоксиданта эхинохрома А на блеомицин-индуцированный пневмофиброз // Бюллетень экспериментальной биологии и медицины. - 2015. - Т. 159, № 3. - С. 329-332.  4. Лебедько О.А., Рыжавский Б.Я., Ткач О.В., Кузнецова М.С., Гусева О.Е.Влияние перорального введения эхинохрома А на структурно-метаболические нарушения, индуцированные блеомицином в легких крыс, на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2016. - № 3. - С. 92-96.
4. Лебедько О.А., Рыжавский Б.Я., Ткач О.В., Кузнецова М.С., Гусева О.Е.Влияние перорального введения эхинохрома А на структурно-метаболические нарушения, индуцированные блеомицином в легких крыс, на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2016. - № 3. - С. 92-96.  5. Лужников Е.А., Суходолова Г.Н. Острые отравления у взрослых и детей. - М.: Эксмо, 2009. - 560 с.
5. Лужников Е.А., Суходолова Г.Н. Острые отравления у взрослых и детей. - М.: Эксмо, 2009. - 560 с.  6. Allawzi A., Elajaili H., Redente E.F., Nozik-Grayck E. Oxidative toxicology of bleomycin: role of the extracellular redox environment // Curr. Opin. Toxicol. - 2019. - Vol. 13. - P. 68-73.
6. Allawzi A., Elajaili H., Redente E.F., Nozik-Grayck E. Oxidative toxicology of bleomycin: role of the extracellular redox environment // Curr. Opin. Toxicol. - 2019. - Vol. 13. - P. 68-73.  7. Bolzán AD, Bianchi MS. DNA and chromosome damage induced by bleomycin in mammalian cells: An update // Mutat. Res. - 2018. - Vol. 775. - P. 51-62.
7. Bolzán AD, Bianchi MS. DNA and chromosome damage induced by bleomycin in mammalian cells: An update // Mutat. Res. - 2018. - Vol. 775. - P. 51-62.  8. Crnovcic I.,Gan F., Yang D., Dong L.B., Schultz P.G., Shen B. Activities of recombinant human bleomycin hydrolase on bleomycins and engineered analogues revealing new opportunities to overcome bleomycin-induced pulmonary toxicity // Bioorg. Med. Chem. Lett. - 2018. - Vol. 28 (16). - P. 2670-2674.
8. Crnovcic I.,Gan F., Yang D., Dong L.B., Schultz P.G., Shen B. Activities of recombinant human bleomycin hydrolase on bleomycins and engineered analogues revealing new opportunities to overcome bleomycin-induced pulmonary toxicity // Bioorg. Med. Chem. Lett. - 2018. - Vol. 28 (16). - P. 2670-2674.  9. De A., Guryev I., LaRiviere A., Kato R., Wee C.P., Mascarenhas L., Keens T.G., Venkatramani R. Pulmonary function abnormalities in childhood cancer survivors treated with bleomycin // Pediatr. Blood Cancer. - 2014. - Vol. 61 (9). - P. 1679-1684.
9. De A., Guryev I., LaRiviere A., Kato R., Wee C.P., Mascarenhas L., Keens T.G., Venkatramani R. Pulmonary function abnormalities in childhood cancer survivors treated with bleomycin // Pediatr. Blood Cancer. - 2014. - Vol. 61 (9). - P. 1679-1684.  10. Della Latta V., Cecchettini A., Del Ry S., Morales M.A. Bleomycin in the setting of lung fibrosis induction: From biological mechanisms to counteractions // Pharmacol. Res. - 2015. - Vol. 97. - P. 122-130.
10. Della Latta V., Cecchettini A., Del Ry S., Morales M.A. Bleomycin in the setting of lung fibrosis induction: From biological mechanisms to counteractions // Pharmacol. Res. - 2015. - Vol. 97. - P. 122-130. 11. Fedoreyev S.A., Krylova N.V., Mishchenko N.P., Vasileva E.A., Pislyagin E.A., Iunikhina O.V., Lavrov V.F., Svitich O.A., Ebralidze L.K., Leonova G.N. Antiviral and Antioxidant Properties of Echinochrome A // Mar. Drugs. - 2018. - Vol. 16 (12). - P. 509 (1-10). doi:10.3390/md16120509.
11. Fedoreyev S.A., Krylova N.V., Mishchenko N.P., Vasileva E.A., Pislyagin E.A., Iunikhina O.V., Lavrov V.F., Svitich O.A., Ebralidze L.K., Leonova G.N. Antiviral and Antioxidant Properties of Echinochrome A // Mar. Drugs. - 2018. - Vol. 16 (12). - P. 509 (1-10). doi:10.3390/md16120509.  12. Gonzalez-Gonzalez F.J., Chandel N.S., Jain M., Budinger G.R.S. Reactive oxygen species as signaling molecules in the development of lung fibrosis // Transl. Res. - 2017. - Vol. 190. - P. 61-68.
12. Gonzalez-Gonzalez F.J., Chandel N.S., Jain M., Budinger G.R.S. Reactive oxygen species as signaling molecules in the development of lung fibrosis // Transl. Res. - 2017. - Vol. 190. - P. 61-68.  13. Lebedev A.V., Ivanova M.V., Levitsky D.O. Echinochrome A naturally occurring iron chelator and free radical scavenger in artificial and natural membrane systems // Life Science. - 2005. - Vol. 76 (8). - Р. 863-875.
13. Lebedev A.V., Ivanova M.V., Levitsky D.O. Echinochrome A naturally occurring iron chelator and free radical scavenger in artificial and natural membrane systems // Life Science. - 2005. - Vol. 76 (8). - Р. 863-875.  14. Valko M., Jomova K., Rhodes C.J., Kuča K., Musílek K. Redox- and non-redox-metal-induced formation of free radicals and their role in human disease // Arch. Toxicol. - 2016. - Vol. 90 (1). - P. 1-37.
14. Valko M., Jomova K., Rhodes C.J., Kuča K., Musílek K. Redox- and non-redox-metal-induced formation of free radicals and their role in human disease // Arch. Toxicol. - 2016. - Vol. 90 (1). - P. 1-37. 15. Yoon C.S., Kim H.K., Mishchenko N.P., Vasileva E.A., Fedoreyev S.A., Stonik V.A., Han J. Spinochrome D attenuates doxorubicin-induced cardiomyocyte death via improving glutathione metabolism and attenuating oxidative stress // Mar. Drugs. - 2018. - Vol. 17 (1). - P. 2 (1-20). doi: 10.3390/md17010002.
15. Yoon C.S., Kim H.K., Mishchenko N.P., Vasileva E.A., Fedoreyev S.A., Stonik V.A., Han J. Spinochrome D attenuates doxorubicin-induced cardiomyocyte death via improving glutathione metabolism and attenuating oxidative stress // Mar. Drugs. - 2018. - Vol. 17 (1). - P. 2 (1-20). doi: 10.3390/md17010002.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Выводы |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»