2019 год № 4
Теоретическая и экспериментальная медицина
Резюме:
Ключевые слова:
Summary:
Key words:
Введение |
 |
 |
Нейроны и глиоциты головного мозга (ГМ) способны синтезировать de novo из холестерина стероиды, получившие название нейростероиды. К ним относятся прогестерон, дегидроэпиандростерон, дегидроэпиандростерон-сульфат, андростендион, прегнегалон, эстрадиол и ряд других соединений [1, 2, 9, 11, 13, 14, 15]. Их синтез осуществляется с участием ряда ферментов, ключевым из которых является 3β- гидроксистероиддегидрогеназа (ГСДГ), катализирующая превращение прегненолона в прогестерон [5, 11, 13, 14, 15]. Выявление данного фермента используется для маркировки клеток, продуцирующих нейростероиды. При этом обычно применяются методы гибридизации in situ, иммуногистохимии [9, 10, 11, 12, 13, 14, 15]. В то же время, выявление таких клеток возможно при помощи гистохимической реакции на ГСДГ, причем она позволяет судить как о принадлежности клеток к стероидпродуцирующим, так и о степени активности энзима, оцениваемой методом цитоспектрофотометрии. Данный подход применялся в наших работах при изучении нейронов ряда локализаций, а также клеток эпендимной глии [6, 7]. Сопоставление результатов показало их совпадение при исследованиях с применением гистохимического метода с полученными ранее данными, основанными на методах гибридизации in situ и иммуногистохимии. В частности, были подтверждены [6] данные о высокой интенсивности реакции на ГСДГ в клетках Пуркинье, считающихся наиболее активными продуцентами нейростероидов [14, 15]. Настоящая работа является продолжением исследований ГСДГ в ГМ, в частности, в нейронах ретикулярной формации продолговатого и среднего мозга, гистохимическим методом.
Материалы и методы
|
 |
 |
Исследовалась активность ГСДГ в головном мозге 5 взрослых (возраст - 7-8 мес.) интактных крыс-самок линии Вистар (n=5). Животные содержались в условиях одного вивария, получали в свободном доступе воду и разнообразный корм ad libitum. Экспериментальное исследование было проведено в соответствии с принципами "Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях". Тотчас после эвтаназии животных выделяли фрагмент мозга, включавший в себя продолговатый мозг, мост и мозжечок, помещали его на охлажденный блок криостата Leica. Готовили коронарные срезы толщиной 20 мкм, проходившие через ствол ГМ и мозжечок в области ромбовидной ямки. При этом делали не менее 10 срезов из зоны, относящейся к продолговатому мозгу и не менее 10 - относящейся к мосту. Часть полученных из разных отделов ствола мозга срезов окрашивали метиленовым синим. Для определения активности ГСДГ срезы монтировались на покровные стекла, на них наносили инкубационный раствор, приготовленный по прописи [3], с использованием дегидроэпиандростерона в качестве субстрата, НАД и нитросинего тетразолия (все реактивы производства "Sigma") и помещали в термостат (температура 37 °С) на 30 минут. Заключение препаратов осуществляли в глицерин-желатину и в канадский бальзам. Определение исследуемых зон ствола ГМ проводили по [12]. Для количественной цитоспектрофотометрической оценки активности ГСДГ препараты фотографировали цифровой фотокамерой с использованием светофильтра (λ=560-580 нм), снимки импортировали в компьютер и изучали с использованием программы ВидеоТест5. Об активности ГСДГ судили по оптической плотности продуктов реакции в цитоплазме: 1) клеток гигантоклеточного ядра продолговатого мозга; 2) нейронов, расположенных между ядрами продолговатого мозга; 3) клеток Пуркинье коры мозжечка. Клетки Пуркинье в работе использовали в качестве объекта сравнения, характеризующегося особенно высокой интенсивностью нейростероидогенеза [6, 13, 14, 15]. В каждом случае измерения проводили в 25 клетках каждой локализации. Используя программу ВидеоТест5, измеряли также размеры перикарионов наиболее крупных и мелких ГСДГ-позитивных нейронов в составе ядер и в межъядерных зонах. Статистическую обработку проводили в программе Statistica 6, с использованием опции Дескриптивный анализ.
Результаты и обсуждение
|
 |
 |
Сопоставление препаратов одинаковых зон ствола мозга, окрашенных метиленовым синим, как и представленных в атласе G. Paxinos, C. Watson [12], с полученными при проведении реакции на ГСДГ, показывало, что число клеток, выявляемых гистохимической реакцией, существенно меньше. При реакции на ГСДГ, во-первых, нейроны только некоторых ядер ствола мозга были ГСДГ-позитивными. Во-вторых, количество ГСДГ-позитивных нейронов, расположенных "дискретно" между ядрами, было значительно меньшим, чем на препаратах, окрашенных метиленовым синим. Это свидетельствует о том, что лишь часть нейронов в исследованных участках ствола ГМ являются ГСДГ-позитивными.
При этом в бульбарном отделе ствола мозга ГСДГ-позитивные нейроны выявлялись почти исключительно в его вентральной и средней зоне. В частности, они были локализованы в гигантоклеточном и парагигантоклеточном ядрах. Кроме того, такие нейроны в небольшом количестве находились вне ядер, располагаясь "дискретно" преимущественно в средней части парамедиальной зоны продолговатого мозга (рис. 1, 2). В мосте такие нейроны также обнаруживались в гигантоклеточном ядре, а также в составе промежуточного ретикулярного, медиального вестибулярного ядер. Между ядрами, как и в продолговатом мозге, выявлялись межъядерные ГСДГ-позитивные нейроны.
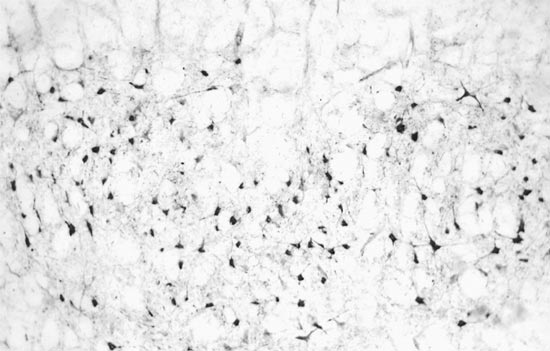
Рис. 1. Гигантоклеточное ядро продолговатого мозга. Реакция на ГСДГ. Увеличение 10*15
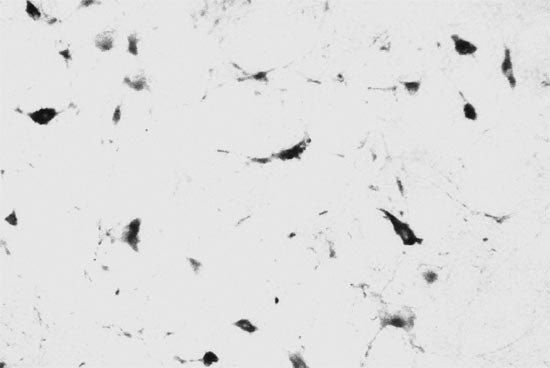
Рис. 2. Межъядерные нейроны продолговатого мозга. Реакция на ГСДГ. Увеличение 40*15
ГСДГ-позитивные нейроны, локализованные в составе ядер, имели размеры перикарионов от 12-15 мкм до 40-50 мкм (рис. 3, 4). При этом содержание крупных нейронов было большим в гигантоклеточном и парагигантоклеточном ядрах, чем в других ядрах. Вместе с тем, и в них имелось значительное число ГСДГ-позитивных клеток среднего и небольшое - нейронов малого размеров. Клетки, дававшие положительную реакцию на ГСДГ, имели отростки, присущие изодендритическим нейронам [4]. Их перикарионы характеризовались треугольной, полигональной, звездчатой, веретеновидной формой. ГСДГ-позитивные нейроны, расположенные между ядрами, имели преимущественно небольшие, реже - средние размеры; их форма чаще всего была веретеновидной или треугольной. Активность ГСДГ в нейронах ядер и расположенных в межъядерных зонах проявлялась окраской цитоплазмы в фиолетово-синий цвет разной интенсивности, в ядрах клеток продукты реакции не выявлялись (рис. 1-4). При визуальной оценке не обнаруживалось закономерных отличий интенсивности реакции, обусловленных размерами или формой нейронов, расположенных как в ядрах ствола мозга, так и между ядрами.
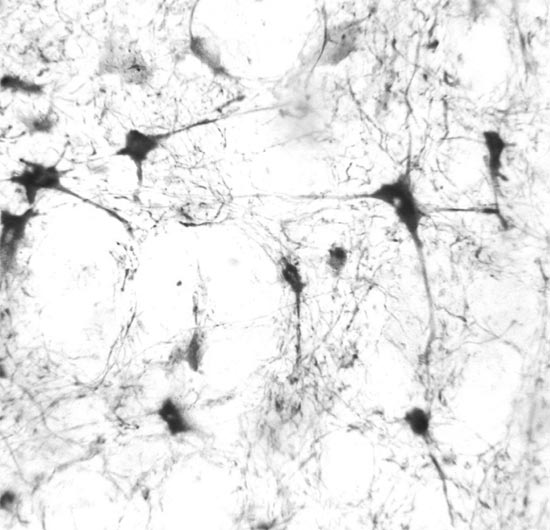
Рис. 3. Нейроны гигантоклеточного ядра продолговатого мозга. Реакция на ГСДГ. Увеличение 40*15
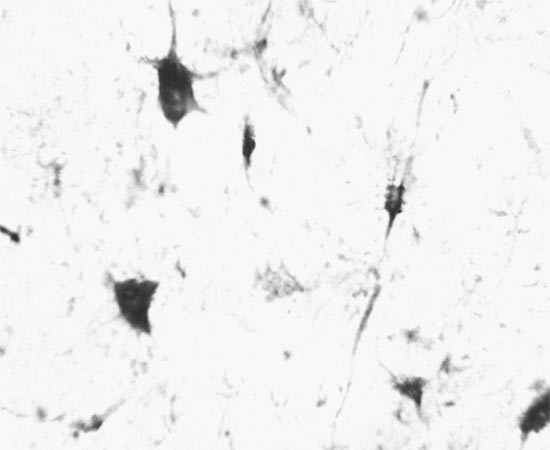
Рис. 4. Нейроны гигантоклеточного ядра моста. Реакция на ГСДГ. Увеличение 40*15
Как сказано выше, данные литературы свидетельствуют о том, что в ГМ наиболее высокая стероидогенная активность присуща клеткам Пуркинье [6, 11, 14, 15]. Однако, уже при визуальном изучении реакции ГСДГ-позитивных нейронов ствола ГМ (рис. 1-4) и клеток Пуркинье (рис. 5), расположенных в одних и тех же срезах, обнаруживалось, что в нейронах продолговатого и среднего мозга интенсивность реакции в клетках ствола не уступает таковой в клетках Пуркинье или даже превосходит ее. Цитофотометрическое изучение оптической плотности продуктов реакции в цитоплазме ГСДГ-позитивных нейронов показало, что в нейронах гигантоклеточного ядра она составляет 0,556±0,037 усл. ед., в нейронах, расположенных между ядрами - 0,444±0,022 усл. ед., в клетках Пуркинье - 0,449±0,019 усл. ед., то есть в нейронах гигантоклеточного ядра продолговатого мозга интенсивность реакции была достоверно выше, чем как в межъядерных нейронах, так и в клетках Пуркинье (P<0,05). Таким образом, было установлено, что ГСДГ-позитивные нейроны изученных ядер ствола ГМ обладают в среднем более высокой активностью фермента, чем ганглиозные нейроны коры мозжечка. В связи с этим представляет интерес сопоставление полученных результатов с данными о том, что активность ГСДГ в клетках Пуркинье близка к таковой в стероидпродуцирующих клетках коры надпочечников и гонад [6]. Оно свидетельствует, что ГСДГ-позитивные нейроны ствола ГМ также сопоставимы по активности ГСДГ с адренокортикоцитами, текоцитами, клетками Лейдига. В то же время, оценивая полученные результаты, следует сказать, что они не являются достаточными для доказательства того, что в нейронах гигантоклеточного ядра синтез нейростероидов более интенсивен, чем в клетках Пуркинье, считающихся по данным многих исследователей, наиболее активными продуцентами этих соединений [11, 14, 15]. Причина этого заключается в том, что образование стероидных гормонов является многоступенчатым процессом [5, 10, 13], в связи с чем количество образующихся гормонов в клетке определяется активностью не одного, а целого ряда ферментов. При этом следует учитывать также предположения о том, что синтез нейростероидов, может осуществляться при взаимодействии нескольких клеток (нейронов и/или глиоцитов) [13].
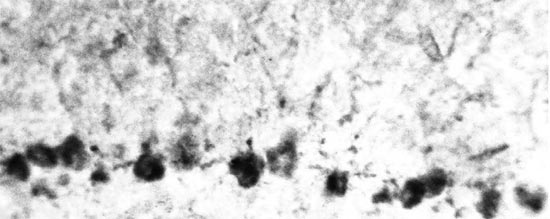
Рис. 5. Клетки Пуркинье коры мозжечка. Реакция на ГСДГ. Увеличение 40*15
Таким образом, в работе впервые гистохимическим методом выявлены и описаны ГСДГ-позитивные нейроны, относящиеся к ретикулярной формации [4, 8], расположенные в стволе ГМ - продолговатом мозге и мосте, показано, что они расположены как в их ядрах, так и вне ядер, проведена количественная оценка активности ГСДГ в этих нейронах. Учитывая, что нейростероиды, синтезирующиеся клетках нервной системы, оказывают аутокринный, паракринный эффекты, а также выступают в роли модуляторов в интернейрональных синапсах [1, 2, 11], можно предполагать, что вырабатываемые здесь нейрогормоны могут воздействовать на функционирование расположенных в данных зонах нейронов, в том числе, относящихся к ретикулярной формации и оказывающих разнообразные влияния на различные отделы ГМ, регуляцию функционирования сердечно-сосудистой, дыхательной и других систем организма [4, 8], а гистохимическое изучение состояния ГСДГ-позитивных нейронов может быть применено при анализе механизмов развития патологии ГМ и систем организма, в регуляции которых велика роль ретикулярной формации продолговатого мозга и моста.
Литература |
 |
 1. Балашов А.М. Нейростероиды при аддиктивной патологии // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2010. - Т. 110, № 6. - С. 106-111.
1. Балашов А.М. Нейростероиды при аддиктивной патологии // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2010. - Т. 110, № 6. - С. 106-111. 2. Гончаров Н.П., Кация Г.В., Нижник А.Н. Нейростероиды и их биологическое значение // Успехи физиологических наук. - 2004. - Т. 35, № 4. - С. 3-10.
2. Гончаров Н.П., Кация Г.В., Нижник А.Н. Нейростероиды и их биологическое значение // Успехи физиологических наук. - 2004. - Т. 35, № 4. - С. 3-10. 3. Лойда З., Госсрау Р., Шиблер Т. Гистохимия ферментов. Лабораторные методы. - М.: Мир. - 272 с.
3. Лойда З., Госсрау Р., Шиблер Т. Гистохимия ферментов. Лабораторные методы. - М.: Мир. - 272 с. 4. Мотавкин П.А. Введение в нейробиологию. - Владивосток: Медицина ДВ, 2003. - 251 с.
4. Мотавкин П.А. Введение в нейробиологию. - Владивосток: Медицина ДВ, 2003. - 251 с.  5. Розен В.Б. Основы эндокринологии. - М.: Изд-во Моск. ун-та, 1994. - 383 с.
5. Розен В.Б. Основы эндокринологии. - М.: Изд-во Моск. ун-та, 1994. - 383 с. 6. Рыжавский Б.Я., Демидова О.В., Литвинцева Е.М., Ткач О.В. Сравнительная оценка стероидогенной активности клеток мозга, продуцирующих стероиды, и клеток эндокринных желез // Дальневосточный медицинский журнал. - 2015. - № 4. - С. 72-75.
6. Рыжавский Б.Я., Демидова О.В., Литвинцева Е.М., Ткач О.В. Сравнительная оценка стероидогенной активности клеток мозга, продуцирующих стероиды, и клеток эндокринных желез // Дальневосточный медицинский журнал. - 2015. - № 4. - С. 72-75. 7. Рыжавский Б.Я., Задворная О.В. 3бета-гидроксистероиддегидрогеназа в эпендимоцитах выстилки боковых желудочков мозга и ворсинках сосудистого сплетения у крыс разного возраста // Морфология. - 2012. - № 5. - С. 26-29.
7. Рыжавский Б.Я., Задворная О.В. 3бета-гидроксистероиддегидрогеназа в эпендимоцитах выстилки боковых желудочков мозга и ворсинках сосудистого сплетения у крыс разного возраста // Морфология. - 2012. - № 5. - С. 26-29. 8. Черток В.М., Коцюба А.Е. Структурная организация бульбарного отдела сердечно-сосудистого центра. - Владивосток: Медицина ДВ. - 2013. - 163 с.
8. Черток В.М., Коцюба А.Е. Структурная организация бульбарного отдела сердечно-сосудистого центра. - Владивосток: Медицина ДВ. - 2013. - 163 с. 9. Dupont E., Simard J., Luu-The V., Labrie F., Pelletier G. Localization of 3beta-hydroxysteroid dehydrogenase in rat brain as studied by in situ hybridization // Mol. Cell. Neurosci. - 1994. - № 5 (2). - P. 119-123.
9. Dupont E., Simard J., Luu-The V., Labrie F., Pelletier G. Localization of 3beta-hydroxysteroid dehydrogenase in rat brain as studied by in situ hybridization // Mol. Cell. Neurosci. - 1994. - № 5 (2). - P. 119-123. 10. Gennoun R., Fiddes R.J., Gouézou M., Lombès M., Baulieu E.E. A key enzyme in the biosynthesis of neurosteroids, 3 beta-hydroxysteroid dehydrogenase/delta 5-delta 4-isomerase (3 beta-HSD), is expressed in rat brain // Brain Res. Mol. Brain Res. - 1995. - Vol. 30, № 2. - P. 287-300.
10. Gennoun R., Fiddes R.J., Gouézou M., Lombès M., Baulieu E.E. A key enzyme in the biosynthesis of neurosteroids, 3 beta-hydroxysteroid dehydrogenase/delta 5-delta 4-isomerase (3 beta-HSD), is expressed in rat brain // Brain Res. Mol. Brain Res. - 1995. - Vol. 30, № 2. - P. 287-300. 11. Mellon S.H., Griffi n L.D., Compagnone N.A. Biosynthesis and action of neurosteroids. Novel brain function: biosynthesis and actions of neurosteroids in neurons // Brain Res Rev. - 2001. - Vol. 37, № 1-3. - P. 3-12.
11. Mellon S.H., Griffi n L.D., Compagnone N.A. Biosynthesis and action of neurosteroids. Novel brain function: biosynthesis and actions of neurosteroids in neurons // Brain Res Rev. - 2001. - Vol. 37, № 1-3. - P. 3-12. 12. Paxinos G., Watson C. The rat brain in Stereotaxic Coordinates. 6th Edition. Academic press. - 2006. - 456 p.
12. Paxinos G., Watson C. The rat brain in Stereotaxic Coordinates. 6th Edition. Academic press. - 2006. - 456 p. 13. Pelletier G. Steroidogenic enzymes in the brain: morphological aspects // Prog. Brain Res. - 2010. - Vol. 181. - P. 193-207.
13. Pelletier G. Steroidogenic enzymes in the brain: morphological aspects // Prog. Brain Res. - 2010. - Vol. 181. - P. 193-207. 14. Sakamoto H., Ukena K., Kawata M., et al. Expression, localization and possible actions of 25-Dx, a membraneassociated putative progesterone-binding protein, in the developing Purkinje cell of the cerebellum: a new insight into the biosynthesis, metabolism and multiple actions of progesterone as a neurosteroid // Cerebellum. - 2008. - Vol. 7, № 1. - P. 18-25.
14. Sakamoto H., Ukena K., Kawata M., et al. Expression, localization and possible actions of 25-Dx, a membraneassociated putative progesterone-binding protein, in the developing Purkinje cell of the cerebellum: a new insight into the biosynthesis, metabolism and multiple actions of progesterone as a neurosteroid // Cerebellum. - 2008. - Vol. 7, № 1. - P. 18-25. 15. Tsutsui К., Sakamoto H., Ukena К. A novel aspect of the cerebellum: biosynthesis of neurosteroids in the Purkinje cell // Cerebellum. - 2003. - Vol. 2, № 3. - P. 215-222.
15. Tsutsui К., Sakamoto H., Ukena К. A novel aspect of the cerebellum: biosynthesis of neurosteroids in the Purkinje cell // Cerebellum. - 2003. - Vol. 2, № 3. - P. 215-222.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»