2020 год № 1
Внутренние болезни
2Краевой клинический центр онкологии, 680000, Воронежское шоссе, 164, тел. 8-(4212)-41-06-45, е-mail: info@kkco.khv.ru;
3Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел. 8-(4212)-76-13-96, e-mail: nauka@mail.fesmu.ru;
4 301 Военный клинический госпиталь, 680000, ул. Серышева, 1, тел. 8-(4212)-39-77-41, г. Хабаровск
Резюме:
Ключевые слова:
2Center of oncology;
3Far Eastern State Medical University;
4Military Clinical Hospital № 301, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
В последние годы в результате совершенствования техники и повышения доступности ультразвукового исследования (УЗИ) врачи столкнулись с лавинообразным увеличением частоты узлового зоба: если при пальпации узловые образования щитовидной железы (ЩЖ) выявляют у 4-7 % взрослых людей, то при проведении УЗИ - в 7-9 раз чаще [1, 2, 3]. На сегодняшний день "золотым" стандартом в определении доброкачественности или злокачественности узла является тонкоигольная аспирационная биопсия (ТАБ) [4, 5]. Современные технические возможности позволяют выполнять ТАБ ЩЖ при размерах образований от 2-3 мм. Однако возникает вопрос: есть ли необходимость в инвазивной диагностике абсолютно всех выявленных образований ЩЖ?
Дело в том, что подавляющее большинство (90-95 %) узлов ЩЖ, в том числе случайно выявленных (managing incidental thyroid nodules), по своей этиологии и патогенезу не-опухоли и никогда ими не станут. Злокачественными оказываются от 2 до 5 % узлов ЩЖ, причем более 90 % из них относятся к высокодифференцированному раку из фолликулярного эпителия, чаще папиллярному, являющегося самым "безопасным" из всех раков (10-летняя выживаемость находится на уровне 93 %) [6, 7, 8, 9, 10, 11, 12, 13, 14, 15]. Интересно отметить, что папиллярный рак ЩЖ распространен крайне широко: папиллярная микрокарцинома встречается у 5-24 % умерших, не имевших признаков заболевания ЩЖ [16].
Международный опыт, в первую очередь Южной Кореи, показывает, что, несмотря на быстрый рост числа зарегистрированных случаев рака ЩЖ, являющегося результатом УЗИ скрининга и биопсии всех выявленных образований ЩЖ, увеличения смертности от него нет; рост диагностики и лечения рака ЩЖ не сопровождается соразмерным улучшением в долгосрочной перспективе [1, 7, 9]. Эти данные говорят о том, что ТАБ небольших образований ЩЖ приводит к выявлению клинически незначимых опухолей ЩЖ, представленных в большинстве своем папиллярной карциномой.
Из всех существующих на сегодняшний день рекомендаций по определению показаний к ТАБ узлов ЩЖ, российские являются самыми "жесткими". Согласно им, ТАБ ЩЖ показана при размерах узлов от 1 см и выше, а если есть данные личного и семейного анамнеза, свидетельствующие о высоком риске агрессивных форм рака ЩЖ (возраст моложе 20 лет, повышение уровня кальцитонина, семейные случаи рака ЩЖ, узлы, случайно выявленные при проведении позитронно-эмиссионной томографии), то это повод для проведения ТАБ узлов и меньшего размера [17].
Зарубежные рекомендации по ведению пациентов с узлами ЩЖ принципиально отличаются от российских. Накопленный опыт сопоставления данных УЗИ и морфологии узлов позволяют еще на этапе УЗИ с высокой степенью достоверности оценить риск злокачественности, и соответственно, более дифференцировано подойти к определению показаний для ТАБ, а также снизить количество неоправданных биопсий при заведомо доброкачественных узлах [18-49].
Обсуждение
|
 |
 |
В настоящее время существуют несколько ультразвуковых классификаций, позволяющих сузить группу узлов ЩЖ, подозрительных на злокачественные. В последние годы широко используется классификация TIRADS (Thyroid Imaging Reportin gand Data Systema), которая была разработана Американской коллегией радиологов (American Colege of Radiology; ACR) на основании сопоставления более 10 тысяч результатов УЗИ и цитологического исследования биоптатов узлов ЩЖ [50]. Эта классификация за последние годы претерпела ряд модификаций, направленных на повышение удобства ее применения в клинической практике [51, 52, 53, 54, 55, 56, 57, 58].
В соответствии с классификацией (шкалой) TIRADS различные по эхографической картине узлы ЩЖ, объединяют в группы в зависимости от риска злокачественности:
TIRADS 1 - нормальная щитовидная железа;
TIRADS 2 - доброкачественные изменения ЩЖ (риск малигнизации - 0 %):
o коллоидный узел 1-го типа (простая киста): анэхогенное образование с гиперэхогенным включением "хвост кометы", неваскуляризированное (рис. 1);
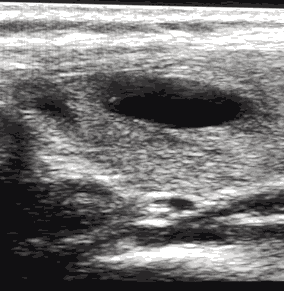
Рис. 1. Анэхогенное образование, неваскуляризированное - простая киста. TIRADS 2
o коллоидный узел 2-го типа: без капсулы, с четкими контурами, смешанной структуры, нерастяжимый (non-expansile), "губчатый" узел;
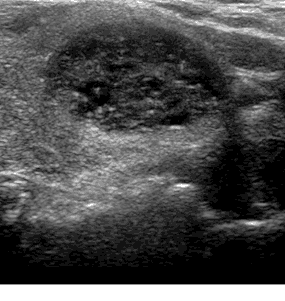
Рис. 2. Узел гипоэхогенный губчатый с четким контуром. TIRADS 2
o коллоидный узел 3 типа: гетеро- или изоэхогенный, растяжимый (expansile) с периферической васкуляризацией (рис. 2, 3, 4);
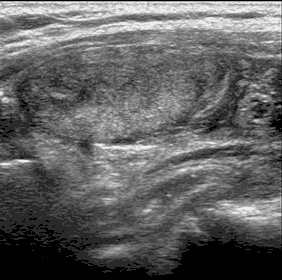
Рис. 3. Узел изоэхогенный с четким контуром с гетерогенной внутренней структурой. TIRADS 2
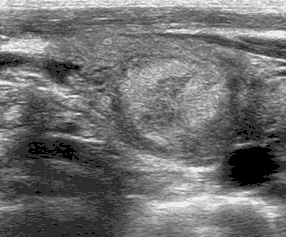
Рис. 4. Узел гиперэхогенный с четким несколько неровным контуром с гетерогенной внутренней структурой. TIRADS 2
TIRADS 3 - вероятно доброкачественные изменения ЩЖ (риск малигнизации менее - 5 %):
o гипер-, изо-, гипоэхогенный узел, частично инкапсулированный, с периферической васкуляризацией, чаще визуализирующийся на фоне аутоиммунного тиреоидита (псевдоузел Хашимото) (рис. 5);
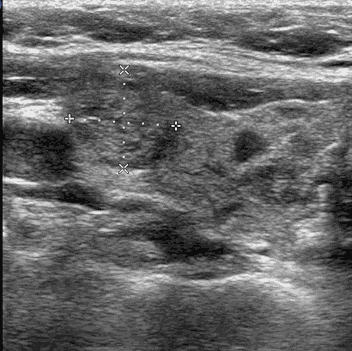
Рис. 5. Псевдоузел на фоне аутоиммунного тиреоидита. TIRADS 3
Градация узлов в следующих категориях шкалы TIRADS (TIRADS 4 и TIRADS 5) определяется пятью характерными для злокачественных процессов сонографическими признаками, таким как:
1) солидный компонент;
2) выраженная гипоэхогенность узла;
3) микродольчатые и неровные контуры;
4) микрокальцинаты;
5) вертикальная ориентированность узла (выше, чем шире).
TIRADS 4 - подозрительные на злокачественные изменения ЩЖ.
TIRADS 4а - 1 признак (риск малигнизации - 5-10 %).
TIRADS 4б - 2 признака (риск малигнизации - 10-80 %).
TIRADS 4с - 3 признака (риск малигнизации - 10-80 %) (рис. 6).
TIRADS 5 - все 5 признаков (риск малигнизации - более 80 %).
TIRADS 6 - предшествующая биопсия доказала - злокачественность.
Классификация достаточно удобна в клиническом применении, хотя не совсем понятно, для чего была выделена категория TIRADS 1 (нормальная ЩЖ), а также TIRADS 6 (сонографические характеристики TIRADS 5 и TIRADS 6 совпадают).
На основании этой классификации Американской тиреоидологической ассоциацией (American Thyroid Association; ATA) были предложены следующие показания для проведения ТАБ узлов (табл. 1).
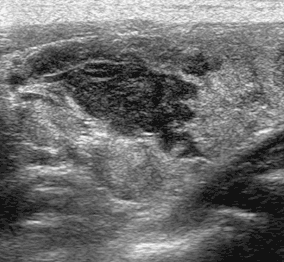
Рис. 6. Узел выраженно гипоэхогенный с солидным компонентом, неровными нечеткими контурами, прерывистой капсулой. TIRADS 4с
| Категория по шкале TIRADS | Вероятность злокачественности | Рекомендации |
|---|---|---|
| TIRADS 1 | 0 % | Наблюдение; ТАБ не показана |
| TIRADS 2 | 0 % | кистозный узел без солидного компонента - наблюдение; ТАБ не показана губчатый (спонгиформный) или частично кистозный узел без признаков, подозрительных на злокачественность, описанных выше - ТАБ при размере узла более 2,0 см |
| TIRADS 3 | менее 5 % | ТАБ при размере узла 1,5 см и более |
| TIRADS 4а | 5-10 % | ТАБ при размере узла 1,0 см |
| TIRADS 4б | 10-80 % | ТАБ при размере узла 1,0 см |
| TIRADS 4с | 10-80 % | ТАБ при размере узла 1,0 см |
| TIRADS 5 | более 80 % | ТАБ при размере узла 1,0 см |
Необходимо отметить, что признаки поражения региональных лимфоузлов даже при "неплохих" ультразвуковых характеристиках самого образования ЩЖ заставляют отнести его к категории TIRADS 4с. Если узел ЩЖ менее 1,0 см, то проводят ТАБ только лимфоузла и берут смыв с иглы на тиреоглобулин, чтобы доказать, что его изменения имеют отношение к ЩЖ. Если узел ЩЖ 1,0 см и более, то проводят ТАБ и этого узла, и измененного лимфоузла, а также берут смыв иглы на тиреоглобулин.
Клинический пример
Пациентка П., 42 г., жалобы на объемное образование на боковой поверхности шеи, которое обнаружила случайно.
Гормоны щитовидной железы и кальцитонин в норме.
Данные УЗИ: размеры щитовидной железы в норме. Эхогенность средняя. В верхнем полюсе правой доли узел до 1,0 см, умеренно гипоэхогенный, с четкими контурами, микрокальцинатами, активным кровотоком. Справа, у внутренней яремной вены образование (лимфоузел?) размером до 2,0 см, с нечеткими неровными контурами, микрокальцинатами, активным кровотоком.
Заключение: Узел правой доли щитовидной железы. TIRADS 4с.
Показана ТАБ узла щитовидной железы и лимфоузла. Результат ТАБ: папиллярная карцинома. Исследование смыва иглы на тиреоглобулин: значительное повышение его уровня.
Лечение: тиреоидэктомия с центральной и боковой лимфодиссекцией шеи.
Результаты гистологического исследования: папиллярная карцинома фолликулярный вариант, мультифокальный тип роста с доминантным узлом 0,8, с инвазией капсулы доли менее 500 мкм; в 2 из 11 л/узлов метастазы папиллярной карциномы.
Нельзя забывать, что медуллярный рак не имеет типичных признаков злокачественности, поэтому система TIRADS в этом случае не работает. Медуллярный рак - редкая (менее 4 % всех карцином ЩЖ), но очень агрессивная патология, поэтому согласно российским рекомендациям всем пациентам с образованиями ЩЖ показано определение кальцитонина, который является ранним маркером этого заболевания.
В 2017 г. АCR опубликовала новую версию TIRADS, еще более приближенную к практическому применению [59]. Опираясь на широкую доказательную базу, комитет АCR TIRADS предложил более высокие пороговые значения размеров узлов для проведения ТАБ в случае невысокой вероятности малигнизации. В новой модели при описании тех же ультразвуковых характеристик проводится подсчет баллов с последующим их суммированием. В отличие от предыдущей версии, новая модель классификации не основывается на группировке ультразвуковых признаков по определенным жестким шаблонам и не включает субкатегории TIRADS 4a-TIRADS 4c.
Дополнительная информация:
o если ободковые кальцинаты затрудняют полную визуализацию узла, узел следует расценивать, как солидный, изоэхогенный;
o если контуры достоверно не определяются, то их следует расценивать, как нечеткие;
o если эхогенность достоверно не определяется, то узел следует расценивать, как изоэхогенный;
o если структура достоверно не определяется, то ее следует расценивать, как солидную.
Как можно заметить, узел АCR TIRADS 1 (0 баллов) - это простая киста и ничего больше, потому что узелок, который имеет кистозно-солидную структуру (1 балл) также получает хотя бы 1 балл при оценке эхогенности тканевого компонента. После определения категории узлов определяются показания для проведения ТАБ с учетом их размеров.
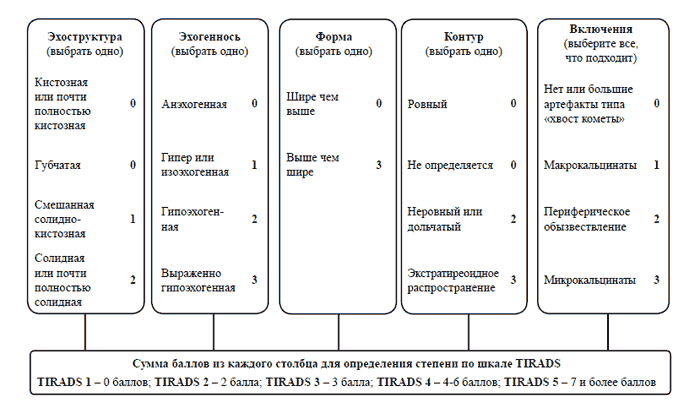
Рис. 7. Определение категории узлов по шкале АCR TIRADS
| Количество баллов | TIRADS | Интерпретация | ТАБ |
|---|---|---|---|
| 0 | TIRADS 1 | доброкачественные изменения ЩЖ | не показана |
| 2 | TIRADS 2 | вероятно, доброкачественные изменения ЩЖ | не показана |
| 3 | TIRADS 3 | вероятно, доброкачественные изменения ЩЖ | при размере узла ≥1,5 см повторные исследования (УЗИ) при размере узла ≥2,5 см рекомендована ТАБ Повторные исследования через 1, 3, 5 лет |
| 4-6 | TIRADS 4 | подозрительные на злокачественные изменения ЩЖ | при размере узла ≥1,0 см повторные исследования (УЗИ) при размере узла ≥1,5 см рекомендована ТАБ повторные исследования через 1, 2, 3 и 5 лет |
| 7 и более | TIRADS 5 | вероятно, злокачественные изменения ЩЖ | при размере узла ≥0,5 см повторные исследования (УЗИ) при размере узла ≥1,0 см рекомендована ТАБ повторные исследования каждый год в течение 5 лет |
Дополнительная информация:
o если имеются множество узлов, то для оценки выбираются не два самых больших узла, а два узла с наиболее высокими признаками злокачественности по TIRADS;
o увеличение узла в размерах считается значительным, если при проведении повторных УЗИ узел увеличился на 20 % или на 2 мм по одному из размеров или на 50 % в объеме.
В литературе существует мало рекомендаций относительно интервала между УЗИ у пациентов с доброкачественными узлами. В российском консенсусе по узловому зобу таким пациентам предлагается проведение УЗИ ЩЖ 1 раз в 1-2 года (рекомендация 6.1) [5]. Если же образование имеет подозрительные ультразвуковые признаки, но менее 1 см, и пациент не входит в группу риска развития агрессивных форм рака ЩЖ, периодичность УЗИ ЩЖ составляет 1-2 раза в год. Проведение ТАБ узлов менее 1 см даже при наличии подозрительных ультразвуковых признаков не рекомендуется. Она показана при увеличении образования до 1 см и более или при появлении симптомов агрессивности рака ЩЖ.
По мнению комитета ACR, интервал между УЗИ менее года неоправдан, а через 5 лет наблюдения, если узел не растет и не меняет свои сонографические характеристики, исследования вообще можно прекратить, так как стабильность в течение такого временного промежутка достоверно указывает на доброкачественный характер узла. Единственным поводом для проведения УЗИ чаще, чем раз в год, по рекомендациям ACR, являются доказанные случаи рака у пациентов, находящихся под активным наблюдением.
Таким образом, рассмотренные ультразвуковые классификации отражают дифференцировку узлов ЩЖ в зависимости от онкологического риска, что позволяет четко определить показания к проведению инвазивной диагностики (ТАБ), а в дальнейшем - тактику наблюдения и/или лечения и сократить число необоснованных оперативных вмешательств на ЩЖ. Отметим, что рекомендации не стоит рассматривать как жесткие стандарты. Решение о проведении ТАБ принимается лечащим врачом с учетом предпочтений пациента, его тревожности, факторов риска развития рака ЩЖ, наличия сопутствующих заболеваний и прочих факторов.
Литература |
 |
 |
 1. Диагностика и лечение (много) узлового зоба у взрослых. Клинические рекомендации Российской Ассоциации эндокринологов. - 2016.
1. Диагностика и лечение (много) узлового зоба у взрослых. Клинические рекомендации Российской Ассоциации эндокринологов. - 2016.  2. American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer // Thyroid. - 2016 Jan. - Vol. 26 (1). - Р. 1-133.
2. American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer // Thyroid. - 2016 Jan. - Vol. 26 (1). - Р. 1-133. 3. Ahn H.S., Kim H.J., Welch H.G. Korea's thyroid-cancer "epidemic" - screening and overdiagnosis // N. Engl. J. Med. - 2014. - № 371. - Р. 1765-1767.
3. Ahn H.S., Kim H.J., Welch H.G. Korea's thyroid-cancer "epidemic" - screening and overdiagnosis // N. Engl. J. Med. - 2014. - № 371. - Р. 1765-1767.  4. Ahuja A.T., Ying M., Ho S.Y., et al. Ultrasound of malignant cervical lymph nodes // Cancer Imaging 2008. - № 8. - Р. 48-56.
4. Ahuja A.T., Ying M., Ho S.Y., et al. Ultrasound of malignant cervical lymph nodes // Cancer Imaging 2008. - № 8. - Р. 48-56.  5. AIUM practice parameter for the performance of a thyroid and parathyroid ultrasound examination // J Ultrasound Med. - 2016. - № 35. - Р. 1-11.
5. AIUM practice parameter for the performance of a thyroid and parathyroid ultrasound examination // J Ultrasound Med. - 2016. - № 35. - Р. 1-11.  6. Arpaci D., Ozdemir D., Cuhaci N., et al. Evaluation of cytopathological findings in thyroid nodules with macrocalcification: macrocalcification is not innocent as it seems // Arq Bras Endocrinol Metabol. - 2014. - № 58. - Р. 939-945.
6. Arpaci D., Ozdemir D., Cuhaci N., et al. Evaluation of cytopathological findings in thyroid nodules with macrocalcification: macrocalcification is not innocent as it seems // Arq Bras Endocrinol Metabol. - 2014. - № 58. - Р. 939-945. 7. Bachar G., Buda I., Cohen M., et al. Size discrepancy between sonographic and pathological evaluation of solitary papillary thyroid carcinoma // Eur J Radiol. - 2013. - № 82. - Р. 1899-1903.
7. Bachar G., Buda I., Cohen M., et al. Size discrepancy between sonographic and pathological evaluation of solitary papillary thyroid carcinoma // Eur J Radiol. - 2013. - № 82. - Р. 1899-1903. 8. Bonavita J.A., Mayo J., Babb J., et al. Pattern recognition of benign nodules at ultrasound of the thyroid: which nodules can be left alone? // AJR Am J Roentgenol. - 2009. - № 193. - Р. 207-213.
8. Bonavita J.A., Mayo J., Babb J., et al. Pattern recognition of benign nodules at ultrasound of the thyroid: which nodules can be left alone? // AJR Am J Roentgenol. - 2009. - № 193. - Р. 207-213. 9. Brito J.P., Hay I.D., Morris J.C. Low risk papillary thyroid cancer // BMJ. - 2014. - № 348. - Р. 3045.
9. Brito J.P., Hay I.D., Morris J.C. Low risk papillary thyroid cancer // BMJ. - 2014. - № 348. - Р. 3045.  10. Burch H.B., Burman K.D., Cooper D.S., Hennessey J.V., Vietor N.O. A 2015 survey of clinical practice patterns in the management of thyroid nodules // J Clin Endocrinol Metab. - 2016. - № 101. - Р. 2853-2862.
10. Burch H.B., Burman K.D., Cooper D.S., Hennessey J.V., Vietor N.O. A 2015 survey of clinical practice patterns in the management of thyroid nodules // J Clin Endocrinol Metab. - 2016. - № 101. - Р. 2853-2862.  11. Choi Y.J., Baek J.H., Hong M.J., Lee J.H. Inter-observer variation in ultrasound measurement of the volume and diameter of thyroid nodules // Korean J Radiol. - 2015. - № 16. - Р. 560-565.
11. Choi Y.J., Baek J.H., Hong M.J., Lee J.H. Inter-observer variation in ultrasound measurement of the volume and diameter of thyroid nodules // Korean J Radiol. - 2015. - № 16. - Р. 560-565.  12. Davies L., Welch H.G. Current thyroid cancer trends in the United States // JAMA Otolaryngol Head Neck Surg. - 2014. - № 140. - Р. 317-322.
12. Davies L., Welch H.G. Current thyroid cancer trends in the United States // JAMA Otolaryngol Head Neck Surg. - 2014. - № 140. - Р. 317-322.  13. Durante C., Costante G., Lucisano G., et al. The natural history of benign thyroid nodules // JAMA. - 2015. - № 313. - Р. 926-935.
13. Durante C., Costante G., Lucisano G., et al. The natural history of benign thyroid nodules // JAMA. - 2015. - № 313. - Р. 926-935.  14. Ferris R.L., Baloch Z., Bernet V., Chen A., Fahey T.J., Ganly I., Hodak S.P., Kebebew E., Patel K.N., Shaha A., Steward D.L., Tufano R.P., Wiseman S.M., Carty S.E. and for the American Thyroid Association Surgical Affairs Committee. American Thyroid Association Statement on Surgical Application of Molecular Profiling for Thyroid Nodules: Current Impact on Perioperative Decision Making // Thyroid. July 2015. - Vol. 25 (7). - Р. 760-768.
14. Ferris R.L., Baloch Z., Bernet V., Chen A., Fahey T.J., Ganly I., Hodak S.P., Kebebew E., Patel K.N., Shaha A., Steward D.L., Tufano R.P., Wiseman S.M., Carty S.E. and for the American Thyroid Association Surgical Affairs Committee. American Thyroid Association Statement on Surgical Application of Molecular Profiling for Thyroid Nodules: Current Impact on Perioperative Decision Making // Thyroid. July 2015. - Vol. 25 (7). - Р. 760-768. 15. Grant E.G., Tessler F.N., Hoang J.K., et al. Thyroid ultrasound reporting lexicon: white paper of the ACR Thyroid Imaging, Reporting and Data System (TIRADS) Committee // J Am Coll Radiol. - 2015. - № 12. - Р. 1272-1279.
15. Grant E.G., Tessler F.N., Hoang J.K., et al. Thyroid ultrasound reporting lexicon: white paper of the ACR Thyroid Imaging, Reporting and Data System (TIRADS) Committee // J Am Coll Radiol. - 2015. - № 12. - Р. 1272-1279.  16. Hay I.D., Johnson T.R., Thompson G.B., Sebo T.J., Reinalda M.S. Minimal extrathyroid extension in papillary thyroid carcinoma does not result in increased rates of either cause-specific mortality or postoperative tumor recurrence // Surgery. - 2016. - № 159. - Р. 11-19.
16. Hay I.D., Johnson T.R., Thompson G.B., Sebo T.J., Reinalda M.S. Minimal extrathyroid extension in papillary thyroid carcinoma does not result in increased rates of either cause-specific mortality or postoperative tumor recurrence // Surgery. - 2016. - № 159. - Р. 11-19.  17. Hoang J.K., Langer J.E., Middleton W.D., et al. Managing incidental thyroid nodules detected on imaging white paper of ACR Incidental Thyroid Finding Committee // J. Am. CollRadiol. - 2015. - № 12. - Р. 143-507.
17. Hoang J.K., Langer J.E., Middleton W.D., et al. Managing incidental thyroid nodules detected on imaging white paper of ACR Incidental Thyroid Finding Committee // J. Am. CollRadiol. - 2015. - № 12. - Р. 143-507. 18. Horvath E., Majlis S., et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management // J. Clin. Endocrinol. Metab. - 2009. - № 94 (5). - Р. 1748-1751.
18. Horvath E., Majlis S., et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management // J. Clin. Endocrinol. Metab. - 2009. - № 94 (5). - Р. 1748-1751.  19. Hundahl S.A., Fleming I.D., Fremgen A.M., et al. A national cancer data base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995 // Cancer. - 2004. - Vol. 83, № 12. - P. 2638-2648.
19. Hundahl S.A., Fleming I.D., Fremgen A.M., et al. A national cancer data base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995 // Cancer. - 2004. - Vol. 83, № 12. - P. 2638-2648. 20. Ito Y., Miyauchi A., Inoue H., et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients // World J Surg. - 2010. - № 34. - Р. 28-35.
20. Ito Y., Miyauchi A., Inoue H., et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients // World J Surg. - 2010. - № 34. - Р. 28-35.  21. Ito Y., Miyauchi A. Nonoperative management of low-risk differentiated thyroid carcinoma // Curr Opin Oncol. - 2015. - № 27. - Р. 15-20.
21. Ito Y., Miyauchi A. Nonoperative management of low-risk differentiated thyroid carcinoma // Curr Opin Oncol. - 2015. - № 27. - Р. 15-20. 22. Kamaya A., Tahvildari A.M., Patel B.N., Willmann J.K., Jeffrey R.B., Desser T.S. Sonographic detection of extracapsular extension in papillary thyroid cancer // J Ultrasound Med. - 2015. - № 34. - Р. 2225-2230.
22. Kamaya A., Tahvildari A.M., Patel B.N., Willmann J.K., Jeffrey R.B., Desser T.S. Sonographic detection of extracapsular extension in papillary thyroid cancer // J Ultrasound Med. - 2015. - № 34. - Р. 2225-2230.  23. Katoh H., Yamashita K., Enomoto T., Watanabe M. Classification and General Considerations of Thyroid Cancer // Ann Clin Pathol. - 2015. - Vol. 3 (1). - Р. 1045.
23. Katoh H., Yamashita K., Enomoto T., Watanabe M. Classification and General Considerations of Thyroid Cancer // Ann Clin Pathol. - 2015. - Vol. 3 (1). - Р. 1045. 24. Kim D.W., Lee E.J., In H.S., Kim S.J. Sonographic differentiation of partially cystic thyroid nodules: a prospective study // AJNR Am J Neuroradiol. - 2010. - № 31. - Р. 1961-1966.
24. Kim D.W., Lee E.J., In H.S., Kim S.J. Sonographic differentiation of partially cystic thyroid nodules: a prospective study // AJNR Am J Neuroradiol. - 2010. - № 31. - Р. 1961-1966.  25. Kim D.W., Park J.S., In H.S., Choo H.J., Ryu J.H., Jung S.J. Ultrasoundbased diagnostic classification for solid and partially cystic thyroid nodules // AJNR Am J Neuroradiol. - 2012. - № 33. - Р. 1144-1149.
25. Kim D.W., Park J.S., In H.S., Choo H.J., Ryu J.H., Jung S.J. Ultrasoundbased diagnostic classification for solid and partially cystic thyroid nodules // AJNR Am J Neuroradiol. - 2012. - № 33. - Р. 1144-1149. 26. Kim H., Kim J.A., Son E.J., et al. Preoperative prediction of the extrathyroidal extension of papillary thyroid carcinoma with ultrasonography versus MRI: a retrospective cohort study // Int J Surg. - 2014. - № 12. - Р. 544-548.
26. Kim H., Kim J.A., Son E.J., et al. Preoperative prediction of the extrathyroidal extension of papillary thyroid carcinoma with ultrasonography versus MRI: a retrospective cohort study // Int J Surg. - 2014. - № 12. - Р. 544-548.  27. Kim M.J., Kim E.K., Kwak J.Y., et al. Differentiation of thyroid nodules with macrocalcifications: role of suspicious sonographic findings // J Ultrasound Med. - 2008. - № 27. - Р. 1179-1184.
27. Kim M.J., Kim E.K., Kwak J.Y., et al. Differentiation of thyroid nodules with macrocalcifications: role of suspicious sonographic findings // J Ultrasound Med. - 2008. - № 27. - Р. 1179-1184.  28. Kwak J.Y., Han K.H., Yoon J.H., et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk // Radiology. - 2011. - № 260. - Р. 892-899.
28. Kwak J.Y., Han K.H., Yoon J.H., et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk // Radiology. - 2011. - № 260. - Р. 892-899.  29. Leboulleux S., Girard E., Rose M., et al. Ultrasound criteria of malignancy for cervical lymph nodes in patients followed up for differentiated thyroid cancer // J Clin Endocrinol Metab. - 2007. - № 92. - Р. 3590-3594.
29. Leboulleux S., Girard E., Rose M., et al. Ultrasound criteria of malignancy for cervical lymph nodes in patients followed up for differentiated thyroid cancer // J Clin Endocrinol Metab. - 2007. - № 92. - Р. 3590-3594.  30. Leboulleux S., Tuttle R.M., Pacini F., Schlumberger M. Papillary thyroid microcarcinoma: time to shift from surgery to active surveillance? Lancet Diabetes Endocrinol. - 2016. - № 4. - Р. 933-942.
30. Leboulleux S., Tuttle R.M., Pacini F., Schlumberger M. Papillary thyroid microcarcinoma: time to shift from surgery to active surveillance? Lancet Diabetes Endocrinol. - 2016. - № 4. - Р. 933-942.  31. Lee M.J., Kim E.K., Kwak J.Y., Kim M.J. Partially cystic thyroid nodules on ultrasound: probability of malignancy and sonographic differentiation // Thyroid. - 2009. - № 19. - Р. 341-346.
31. Lee M.J., Kim E.K., Kwak J.Y., Kim M.J. Partially cystic thyroid nodules on ultrasound: probability of malignancy and sonographic differentiation // Thyroid. - 2009. - № 19. - Р. 341-346.  32. Magister M.J., Chaikhoutdinov I., Schaefer E., Williams N., Saunders B., Goldenberg D. Association of thyroid nodule size and bethesda class with rate of malignant disease // JAMA Otolaryngol Head Neck Surg. - 2015. - 141. - Р. 1089-95.
32. Magister M.J., Chaikhoutdinov I., Schaefer E., Williams N., Saunders B., Goldenberg D. Association of thyroid nodule size and bethesda class with rate of malignant disease // JAMA Otolaryngol Head Neck Surg. - 2015. - 141. - Р. 1089-95. 33. Malhi H., Beland M.D., Cen S.Y., et al. Echogenic foci in thyroid nodules: significance of posterior acoustic artifacts // AJR Am J Roentgenol. - 2014. - № 203. - Р. 1310-1316.
33. Malhi H., Beland M.D., Cen S.Y., et al. Echogenic foci in thyroid nodules: significance of posterior acoustic artifacts // AJR Am J Roentgenol. - 2014. - № 203. - Р. 1310-1316. 34. Martinez-Tello F., Martinez-Cabruja R., Fernaizdez-Martin I., et al. Occult carcinoma of the thyroid. A systematic autopsy study from Spain of two series performed with two different methods // Cancer. - Vol. 71. - № 12. - P. 4022-4029.
34. Martinez-Tello F., Martinez-Cabruja R., Fernaizdez-Martin I., et al. Occult carcinoma of the thyroid. A systematic autopsy study from Spain of two series performed with two different methods // Cancer. - Vol. 71. - № 12. - P. 4022-4029.  35. Middleton W.D., Teefey S.A., Reading C., et al. Multi-institutional analysis of thyroid nodule risk stratification using the American College of Radiology Thyroid Imaging, Reporting and Data System // AJR Am J Roentgenol. In press.
35. Middleton W.D., Teefey S.A., Reading C., et al. Multi-institutional analysis of thyroid nodule risk stratification using the American College of Radiology Thyroid Imaging, Reporting and Data System // AJR Am J Roentgenol. In press.  36. Na D.G., Baek J.H., Sung J.Y., et al. Thyroid imaging reporting and data system risk stratification of thyroid nodules: categorization based on solidity and echogenicity // Thyroid. - 2016. - № 26. - Р. 562-572.
36. Na D.G., Baek J.H., Sung J.Y., et al. Thyroid imaging reporting and data system risk stratification of thyroid nodules: categorization based on solidity and echogenicity // Thyroid. - 2016. - № 26. - Р. 562-572.  37. Na D.G., Kim D.S., Kim S.J., Ryoo J.W., Jung S.L. Thyroid nodules with isolated macrocalcification: malignancy risk and diagnostic efficacy of fine-needle aspiration and core needle biopsy // Ultrasonography. - 2016. - № 35. - Р. 212-219.
37. Na D.G., Kim D.S., Kim S.J., Ryoo J.W., Jung S.L. Thyroid nodules with isolated macrocalcification: malignancy risk and diagnostic efficacy of fine-needle aspiration and core needle biopsy // Ultrasonography. - 2016. - № 35. - Р. 212-219.  38. Nakamura H., Hirokawa M., Ota H., Kihara M., Miya A., Miyauchi A. Is an increase in thyroid nodule volume a risk factor for malignancy? // Thyroid. - 2015. - № 25. - Р. 804-811.
38. Nakamura H., Hirokawa M., Ota H., Kihara M., Miya A., Miyauchi A. Is an increase in thyroid nodule volume a risk factor for malignancy? // Thyroid. - 2015. - № 25. - Р. 804-811. 39. Nguyen X.V., Choudhury K.R., Eastwood J.D., et al. Incidental thyroid nodules on CT: evaluation of 2 risk-categorization methods for workup of nodules // AJNR Am J Neuroradiol. - 2013. - № 34. - Р. 1812-1817.
39. Nguyen X.V., Choudhury K.R., Eastwood J.D., et al. Incidental thyroid nodules on CT: evaluation of 2 risk-categorization methods for workup of nodules // AJNR Am J Neuroradiol. - 2013. - № 34. - Р. 1812-1817.  40. Park J.M., Choi Y., Kwag H.J. Partially cystic thyroid nodules: ultrasound findings of malignancy // Korean J Radiol. - 2012. - № 13. - Р. 530-535.
40. Park J.M., Choi Y., Kwag H.J. Partially cystic thyroid nodules: ultrasound findings of malignancy // Korean J Radiol. - 2012. - № 13. - Р. 530-535.  41. Park J.Y., Lee H.J., Jang H.W., et al. A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma // Thyroid. - 2009. - № 19. - 1257-1264.
41. Park J.Y., Lee H.J., Jang H.W., et al. A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma // Thyroid. - 2009. - № 19. - 1257-1264.  42. Park V.Y., Kim E.K., Kwak J.Y., Yoon J.H., Kim M.J., Moon H.J. Thyroid imaging reporting and data system and ultrasound elastography: diagnostic accuracy as a tool in recommending repeat fine-needle aspiration for solid thyroid nodules with non-diagnostic fine-needle aspiration cytology // Ultrasound Med Biol. - 2016. - № 42. - Р. 399-406.
42. Park V.Y., Kim E.K., Kwak J.Y., Yoon J.H., Kim M.J., Moon H.J. Thyroid imaging reporting and data system and ultrasound elastography: diagnostic accuracy as a tool in recommending repeat fine-needle aspiration for solid thyroid nodules with non-diagnostic fine-needle aspiration cytology // Ultrasound Med Biol. - 2016. - № 42. - Р. 399-406.  43. Park Y.J., Kim J.A., Son E.J., et al. Thyroid nodules with macrocalcification: sonographic findings predictive of malignancy // Yonsei Med J. - 2014. - № 55. - Р. 339-344.
43. Park Y.J., Kim J.A., Son E.J., et al. Thyroid nodules with macrocalcification: sonographic findings predictive of malignancy // Yonsei Med J. - 2014. - № 55. - Р. 339-344. 44. Patel N.U., McKinney K., Kreidler S.M., et al. Ultrasound-based clinical prediction rule model for detecting papillary thyroid cancer in cervical lymph nodes: a pilot study // J Clin Ultrasonography.
44. Patel N.U., McKinney K., Kreidler S.M., et al. Ultrasound-based clinical prediction rule model for detecting papillary thyroid cancer in cervical lymph nodes: a pilot study // J Clin Ultrasonography. 45. Reading C.C., Charboneau J.W., Hay I.D., Sebo T.J. Sonography of thyroid nodules: a "classic pattern" diagnostic approach // Ultrasound Q. - 2005. - № 21. - Р. 157-165.
45. Reading C.C., Charboneau J.W., Hay I.D., Sebo T.J. Sonography of thyroid nodules: a "classic pattern" diagnostic approach // Ultrasound Q. - 2005. - № 21. - Р. 157-165.  46. Rosario P.W., Silva A.L., Borges M.A., Calsolari M.R. Is Doppler ultrasound of additional value to gray-scale ultrasound in differentiating malignant and benign thyroid nodules? // Arch Endocrinol Metab. - 2015. - № 59. - Р. 79-83.
46. Rosario P.W., Silva A.L., Borges M.A., Calsolari M.R. Is Doppler ultrasound of additional value to gray-scale ultrasound in differentiating malignant and benign thyroid nodules? // Arch Endocrinol Metab. - 2015. - № 59. - Р. 79-83.  47. Russ G. Risk stratification of thyroid nodules on ultrasonography with the French TI-RADS: description and reflections. Ultrasonography. - 2016. - № 35. - Р. 25-38.
47. Russ G. Risk stratification of thyroid nodules on ultrasonography with the French TI-RADS: description and reflections. Ultrasonography. - 2016. - № 35. - Р. 25-38.  48. Shin J.H., Baek J.H., Chung J., et al. Ultrasonography Diagnosis and Imaging-Based Management of Thyroid Nodules: Revised Korean Society of Thyroid Radiology Consensus Statement and Recommendations // Korean J Radiol. - 2016. - № 17. - Р. 370-395.
48. Shin J.H., Baek J.H., Chung J., et al. Ultrasonography Diagnosis and Imaging-Based Management of Thyroid Nodules: Revised Korean Society of Thyroid Radiology Consensus Statement and Recommendations // Korean J Radiol. - 2016. - № 17. - Р. 370-395. 49. Shin J.H., Ha T.K., Park H.K., et al. Implication of minimal extrathyroidal extension as a prognostic factor in papillary thyroid carcinoma // Int J Surg. - 2013. - № 11. - Р. 944-947.
49. Shin J.H., Ha T.K., Park H.K., et al. Implication of minimal extrathyroidal extension as a prognostic factor in papillary thyroid carcinoma // Int J Surg. - 2013. - № 11. - Р. 944-947.  50. Singh Ospina N., Brito J.P., Maraka S., et al. Diagnostic accuracy of ultrasound-guided fine needle aspiration biopsy for thyroid malignancy: systematic review and meta-analysis // Endocrine. - 2016. - № 53. - Р. 651-661.
50. Singh Ospina N., Brito J.P., Maraka S., et al. Diagnostic accuracy of ultrasound-guided fine needle aspiration biopsy for thyroid malignancy: systematic review and meta-analysis // Endocrine. - 2016. - № 53. - Р. 651-661.  51. Smith-Bindman R., Lebda P., Feldstein V.A., et al. Risk of thyroid cancer based on thyroid ultrasound imaging characteristics: results of a population-based study // JAMA Intern Med. - 2013. - № 173. - Р. 1788-1796.
51. Smith-Bindman R., Lebda P., Feldstein V.A., et al. Risk of thyroid cancer based on thyroid ultrasound imaging characteristics: results of a population-based study // JAMA Intern Med. - 2013. - № 173. - Р. 1788-1796.  52. Spencer C.A., Lopresti J.S. Measuring thyroglobulin and thyroglobulin autoantibody in patients with differentiated thyroid cancer // Nat Clin Pract Endocrinol Metab. - 2008. - Vol. 4 (4). - Р. 223.
52. Spencer C.A., Lopresti J.S. Measuring thyroglobulin and thyroglobulin autoantibody in patients with differentiated thyroid cancer // Nat Clin Pract Endocrinol Metab. - 2008. - Vol. 4 (4). - Р. 223. 53. Su H.K., Wenig B.M., Haser G.C., et al. Inter-observer variation in the pathologic identification of minimal extrathyroidal extension in papillary thyroid carcinoma // Thyroid. - 2016. - № 26. - Р. 512-517.
53. Su H.K., Wenig B.M., Haser G.C., et al. Inter-observer variation in the pathologic identification of minimal extrathyroidal extension in papillary thyroid carcinoma // Thyroid. - 2016. - № 26. - Р. 512-517.  54. Su H.K., Wenig B.M., Haser G.C., et al. Inter-observer variation in the pathologic identification of minimal extrathyroidal extension in papillary thyroid carcinoma // Thyroid. - 2016. - № 26. - Р. 512-517.
54. Su H.K., Wenig B.M., Haser G.C., et al. Inter-observer variation in the pathologic identification of minimal extrathyroidal extension in papillary thyroid carcinoma // Thyroid. - 2016. - № 26. - Р. 512-517.  55. Tessler F.N., Middleton W.D., Grant E.G., et al. ACR Thyroid Imaging, Reporting and Data System (TI-RADS):White Paper of the ACR TI-RADS Committee // J Am CollRadiol. In press; 2017. doi. org: 10.1016/ j.jacr.2017.01.046.
55. Tessler F.N., Middleton W.D., Grant E.G., et al. ACR Thyroid Imaging, Reporting and Data System (TI-RADS):White Paper of the ACR TI-RADS Committee // J Am CollRadiol. In press; 2017. doi. org: 10.1016/ j.jacr.2017.01.046.  56. Vaccarella S., Franceschi S., Bray F., Wild C.P., Plummer M. Worldwide thyroid-cancer epidemic? The increasing impact of overdiagnosis // N. Engl. J. Med. - 2016. - № 375. - Р. 614-617.
56. Vaccarella S., Franceschi S., Bray F., Wild C.P., Plummer M. Worldwide thyroid-cancer epidemic? The increasing impact of overdiagnosis // N. Engl. J. Med. - 2016. - № 375. - Р. 614-617.  57. Virmani V., Hammond I. Sonographic patterns of benign thyroid nodules: verification at our institution // AJR Am J Roentgenol. - 2011. - № 196. - Р. 891-895.
57. Virmani V., Hammond I. Sonographic patterns of benign thyroid nodules: verification at our institution // AJR Am J Roentgenol. - 2011. - № 196. - Р. 891-895.  58. Yoon J.H., Lee H.S., Kim E.K., Moon H.J., Kwak J.Y. Malignancy risk stratification of thyroid nodules: comparison between the Thyroid Imaging Reporting and Data System and the 2014 American Thyroid Association management guidelines // Radiology. - 2016. - № 278. - Р. 917-924.
58. Yoon J.H., Lee H.S., Kim E.K., Moon H.J., Kwak J.Y. Malignancy risk stratification of thyroid nodules: comparison between the Thyroid Imaging Reporting and Data System and the 2014 American Thyroid Association management guidelines // Radiology. - 2016. - № 278. - Р. 917-924. 59. Zayadeen A.R., Abu-Yousef M., Berbaum K. Retrospective evaluation of ultrasound features of thyroid nodules to assess malignancy risk: a step toward TIRADS // AJR Am J Roentgenol. - 2016. - № 207. - Р. 460-469.
59. Zayadeen A.R., Abu-Yousef M., Berbaum K. Retrospective evaluation of ultrasound features of thyroid nodules to assess malignancy risk: a step toward TIRADS // AJR Am J Roentgenol. - 2016. - № 207. - Р. 460-469.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

