2020 год № 4
Медико-биологические науки
2Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел. 8-(4212)-30-53-11, e-mail: nauka@mail.fesmu.ru, г. Хабаровск
Резюме:
Ключевые слова:
2Far Eastern State Medical university, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Высокая распространенность патологии дыхательной системы, недостаточная эффективность терапии этих заболеваний обусловливают поиск новых средств их лечения. Одним из направлений этого поиска является изучение веществ природного происхождения. К ним относится, в частности, эхинохром А (Эх), выделенный из тканей морских ежей, обладающий выраженной способностью ингибировать свободнорадикальное окисление (СРО), степень повреждения биологических мембран при его активации [15]. Установлено также, что Эх и препарат, содержащий Эх, токоферол и аскорбиновую кислоту, уменьшает интенсивность СРО, альтерации, склерозирования в легких неполовозрелых крыс, подвергшихся воздействию блеомицина, липополисахарида (ЛПС) [5, 6, 14]. ЛПС являются активными индукторами воспаления, приводят к увеличению образования свободных радикалов, усилению выработки цитокинов, активации иммунных клеток, выбросу медиаторов воспаления. При этом тяжесть повреждений, развивающихся под их влиянием особенно ярко выражена в легких, в связи с чем они могут служить "маркером" тяжести последствий воздействия ЛПС [3, 4, 13]. Настоящая работа является продолжением исследований влияния Эх на последствия действия агентов, активирующих СРО. Она посвящена изучению влияния Эх на легкие взрослых крыс, подвергнутых введению ЛПС.
Материалы и методы
|
 |
 |
Экспериментальное исследование проведено в соответствии с принципами "Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях". Оно выполнено на взрослых 6-8-месячных крысах линии Вистар, разделенных из 3 группы. Животным опытной группы (n=6) интрагастрально был введен препарат, состоящий из Эх, токоферола и аскорбиновой кислоты (из расчета 10 мг/кг Эх), и затем, через 30 минут, внутрибрюшинно, ЛПС Coli 026:B6 (2,5 мг/кг). Животным контрольной группы (n=6) был введен только ЛПС в той же дозе. 3-я группа состояла из интактных крыс (n=6). Животные всех групп содержались одновременно в условиях одного вивария, корм и воду получали в свободном доступе adlibitum. Эвтаназия проводилась декапитацией под легким эфирным наркозом. Для морфологического исследования легкие фиксировали в жидкости Карнуа, заливали в парафин, срезы толщиной 7 мкм окрашивали гематоксилином и эозином. На криостатных срезах толщиной 10 мкм проводили реакцию на НАДН-дегидрогеназу (НАДН-Д) по [7]. Время реакции составляло 30 минут. На этих же срезах проводили методом точечного счета [1] определение соотношения площади среза, занимаемой межальвеолярными перегородками и просветами альвеол, а также объемную плотность НАДН-Д-позитивных макрофагов в межальвеолярных перегородках. Результаты морфометрии обрабатывались на программе Statictica c использованием опции "Дескриптивная статистика". Подсчитывались средний арифметический показатель, стандартная ошибка среднего показателя. Различия между группами оценивались по t-критерию Стьюдента. Межгрупповые различия считали достоверными при р<0,05.
Результаты и обсуждение
|
 |
 |
Введение крысам ЛПС (контрольная группа) привело к значительным изменениям как в воздухоносном, так и в респираторном отделах легких. Они проявлялись, во-первых, выраженной лимфоидной инфильтрацией стенок бронхов. Некоторые из них были окружены по всему периметру "муфтой" из лимфоидной ткани. Ее толщина в отдельных участках превышала 500 мкм (рис. 1). Во-вторых, в межальвеолярной соединительной ткани наблюдались многочисленные очаги периваскулярного отека и инфильтрации, содержащие макрофаги, лимфоциты, нейтрофилы. Кроме того, имелись участки органа со значительным утолщением межальвеолярных перегородок, уменьшенными размерами просветов альвеол (рис. 1, 2).
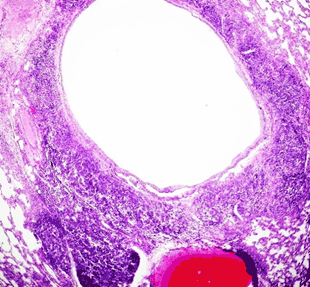
Рис. 1. Легкое крысы контрольной группы (введение ЛПС). Выраженная лимфоидная инфильтрация по всему периметру бронха. Окраска гематоксилином-эозином. Увеличение 15×15
При обзорном изучении криостатных срезов, на которых проводилась реакция на НАДН-Д, выявлялось, что в группе животных, которым вводили ЛПС, в респираторных отделах легкого имелось увеличение относительного объема межальвеолярных перегородок и уменьшение - просветов альвеол (рис. 4). Морфометрическое исследование показало, что отношение межальвеолярные перегородки/просветы альвеол при этом возрастало с 1,05±0,12 до 1,42±0,11 (P<0,05).
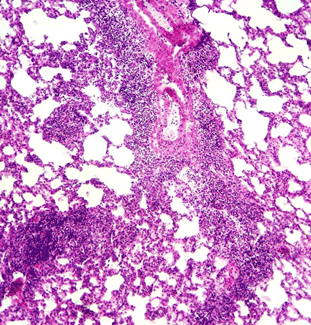
Рис. 2. Легкое крысы контрольной группы (введение ЛПС). Утолщение межальвеолярных перегородок, их лейкоцитарная инфильтрация. Окраска гематоксилином-эозином. Увеличение 15×15
Изучение реакции на НАДН-Д, отражающей интенсивность внутримитохондриального окисления [12], показало, что большинство клеток соединительной ткани, расположенных в стенках бронхов, артерий и вен, имели слабую активность фермента. В противоположность этому, в межальвеолярных перегородках, а также в просветах альвеол обнаруживается значительное число макрофагов, дающих интенсивную реакцию на этот фермент. Они обычно имели размеры 9-12 мкм, преимущественно угловатую, полигональную или отростчатую форму, округлое или бобовидное, не окрашенное продуктом реакции, ядро (рис 3, 4). Данные литературы свидетельствуют о том, что на долю этих клеток, имеющих костномозговое, моноцитарное происхождение, приходится 10-15 % от всех клеток межальвеолярных перегородок и 77-96 % клеток бронхоальвеолярной жидкости [10]. Высокая активность в них НАДН-Д объясняется тем, что в макрофагах на долю митохондрий приходится значительная часть объема цитоплазмы - более 30 % [10]. Благодаря высокой активности фермента в макрофагах они ярко маркировались при примененной гистохимической реакции на НАДН-Д. Как отмечено выше, межальвеолярные перегородки у крыс контрольной группы были утолщены, а их объемная плотность увеличена. Морфометрическое изучение показало, что объемная плотность макрофагов в межальвеолярных перегородках крыс контрольной группы была близка к таковой у интактных крыс (45±8,9% и 46±8,8 % соответственно). Поскольку отношение межальвеолярные перегородки/просветы альвеол у животных, которым был инъецирован ЛПС, было увеличено, суммарное количество макрофагов в интерстициальной ткани в легких животных контрольной группы возрастало. Данное изменение легких под воздействием ЛПС заслуживает внимания в связи с тем, что эти клетки обладают секреторной активностью, способностью к участию в иммунных процессах и их регуляции [8, 10]. Эти изменения, развившиеся под влиянием ЛПС, представляют интерес и в связи с тем, что митохондрии, в которых происходят НАДН-Д-зависимые процессы биологического окисления [12], являются продуцентами активных форм кислорода, участвующих в регуляции иммунных реакций, с одной стороны, и способных оказывать повреждающее действие на различные структуры тканей, с другой [9].
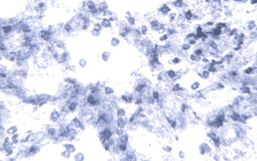
Рис. 3. Легкое крысы, подвергнутой введению ЛПС (контрольной группы). Реакция на НАДН-Д. Макрофаги в межальвеолярных перегородках и просветах альвеол. Увеличение 40×15
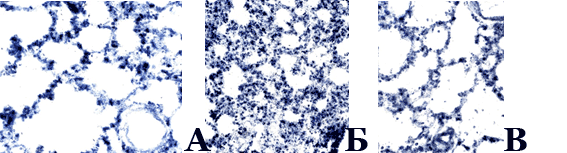
Рис. 4. Легкое крыс: интактной (А), получавшей ЛПС (контрольной группы) (Б), и ЛПС и препарат (В). Реакция на НАДН-Д. Увеличение 20×15. В утолщенных межальвеолярных перегородках крысы контрольной группы увеличенное число НАДН-Д-позитивных макрофагов. Увеличение 20×15
Введение препарата, содержавшего Эх, оказало влияние на легкие крыс, которым был инъецирован ЛПС. В отличие, от контроля, в них не обнаруживались массивные перибронхиальные лимфоидные инфильтраты, реже наблюдались периваскулярные лейкоцитарные инфильтраты в межальвеолярных перегородках. При этом они имели меньшие, чем в контроле, размеры (рис. 5). Морфометрическое изучение отношения межальвеолярные перегородки/просветы альвеол показало, что оно было близко к таковому у интактных животных и достоверно меньше, чем в контроле (0,95±0,12 против 1,42±0,11, P<0,05), что обусловливалось отсутствием утолщения межальвеолярных перегородок (рис. 4, 5). Объемная плотность макрофагов в них при этом не имела существенных отличий от наблюдавшейся у животных контрольной группы (50±3,4 % против 45±8,9 %). Поскольку удельный объем межальвеолярных перегородок в легких крыс данной группы был меньше, чем в контрольной, можно полагать, что суммарное число макрофагов в легких животных опытной группы было меньше такового в легких крыс контрольной группы. Оценивая эти факты, можно предполагать, что введение препарата, содержавшего Эх, уменьшало миграцию в легкие предшественников макрофагов, возрастающую при действии ЛПС, оказывающих влияние на различные системы организма [2, 4, 11].
Таким образом, однократное внутрибрюшинное введение взрослым крысам ЛПС Coli026:B6 привело через одни сутки к выраженным морфологическим изменениям легких. Они обнаруживались как в бронхах, которые окружались массивными лимфоидными инфильтратами, так и в респираторном отделе - стенках альвеол, межальвеолярных перегородках, проявляясь их утолщением, лейкоцитарной инфильтрацией, большим количеством макрофагов. Предшествующее инъекции ЛПС введение крысам препарата, содержавшего Эх, токоферол и аскорбиновую кислоту, существенно уменьшило степень перечисленных патологических изменений легких у подопытных животных. Эти результаты, вместе с полученными ранее данными [5, 6, 14], позволяют считать, что исследованный препарат, содержащий Эх, обладает способностью значительно уменьшать действие повреждающих легкие агентов как у неполовозрелых, так и у взрослых животных.
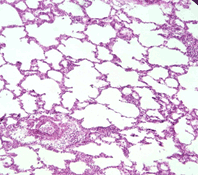
Рис. 5. Легкое крысы, подвергнутой введению ЛПС и препарата. Периваскулярная лейкоцитарная инфильтрация, небольшие участки утолщения межальвеолярных перегородок. Окраска гематоксилином - эозином. Увеличение 15×15
Литература |
 |
 1. Автандилов Г.Г. Медицинская морфометрия. - М.: Медицина, 1990. - 384 с.
1. Автандилов Г.Г. Медицинская морфометрия. - М.: Медицина, 1990. - 384 с.  2. Галазян Н.М., Белая О.Ф., Малов В.А. и соавт. Липополисахариды - эндотоксины грамотрицательных бактерий: роль в развитии интоксикации // Эпидемиология и инфекционные болезни. - 2014. - № 2. - С. 11-16.
2. Галазян Н.М., Белая О.Ф., Малов В.А. и соавт. Липополисахариды - эндотоксины грамотрицательных бактерий: роль в развитии интоксикации // Эпидемиология и инфекционные болезни. - 2014. - № 2. - С. 11-16.  3. Калашникова С.А., Полякова Л.В. Использование бактериального липополисахарида для моделирования патологических процессов в медико-биологических исследованиях (обзор литературы) // Вестник новых медицинских технологий. - 2017. - № 2. - С. 209-219.
3. Калашникова С.А., Полякова Л.В. Использование бактериального липополисахарида для моделирования патологических процессов в медико-биологических исследованиях (обзор литературы) // Вестник новых медицинских технологий. - 2017. - № 2. - С. 209-219.  4. Косырева А.М., Диатроптов М.Е. Морфологические проявления системного воспалительного ответа в печени и легких в разные фазы эстрального цикла // Иммунология. - 2013. - Т. 34, № 2. - С. 111-114.
4. Косырева А.М., Диатроптов М.Е. Морфологические проявления системного воспалительного ответа в печени и легких в разные фазы эстрального цикла // Иммунология. - 2013. - Т. 34, № 2. - С. 111-114. 5. Лебедько О.А., Рыжавский Б.Я., Кузнецова М.С. и соавт. Влияние эхинохрома А на показатели эндогенной интоксикации при блеомицин-индуцированном пневмофиброзе у белых крыс на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2019. - № 3. - С. 65-70.
5. Лебедько О.А., Рыжавский Б.Я., Кузнецова М.С. и соавт. Влияние эхинохрома А на показатели эндогенной интоксикации при блеомицин-индуцированном пневмофиброзе у белых крыс на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2019. - № 3. - С. 65-70. 6. Лебедько О.А., Рыжавский Б.Я., Ткач О.В. и соавт. Влияние перорального введения Эхинохрома А на структурно-метаболические нарушения, индуцированные блеомицином в легких крыс, на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2016. - № 3. - С. 92-96.
6. Лебедько О.А., Рыжавский Б.Я., Ткач О.В. и соавт. Влияние перорального введения Эхинохрома А на структурно-метаболические нарушения, индуцированные блеомицином в легких крыс, на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2016. - № 3. - С. 92-96.  7. Лойда З., Госсрау Р., Шиблер Т. Гистохимия ферментов. - М.: Мир, 1982. - 270 с.
7. Лойда З., Госсрау Р., Шиблер Т. Гистохимия ферментов. - М.: Мир, 1982. - 270 с. 8. Никонова А.А., Хаитов М.Р., Хаитов Р.М. Характеристика и роль различных популяций макрофагов в патогенезе острых и хронических заболеваний легких // Медицинская иммунология. - 2017. - № 6. - С. 657-672.
8. Никонова А.А., Хаитов М.Р., Хаитов Р.М. Характеристика и роль различных популяций макрофагов в патогенезе острых и хронических заболеваний легких // Медицинская иммунология. - 2017. - № 6. - С. 657-672. 9. Пинегин Б.В., Воробьева Н.В., Пащенков М.В., Черняк Б.В. Роль митохондриальных активных форм кислорода в активации врожденного иммунитета // Иммунология 2018. - № 4. - С. 221-229.
9. Пинегин Б.В., Воробьева Н.В., Пащенков М.В., Черняк Б.В. Роль митохондриальных активных форм кислорода в активации врожденного иммунитета // Иммунология 2018. - № 4. - С. 221-229. 10. Руководство по гистологии. Т. 1-2 / Под редакцией Р.К. Данилова. - СПб.: СпецЛит, 2011. - 510 с.
10. Руководство по гистологии. Т. 1-2 / Под редакцией Р.К. Данилова. - СПб.: СпецЛит, 2011. - 510 с. 11. Рыжавский Б.Я., Лебедько О.А., Лазинская О.В. и соавт. Морфологические изменения головного мозга одномесячных крыс под влиянием липополисахарида // Дальневосточный медицинский журнал. - 2017. - № 4. - С. 69-73.
11. Рыжавский Б.Я., Лебедько О.А., Лазинская О.В. и соавт. Морфологические изменения головного мозга одномесячных крыс под влиянием липополисахарида // Дальневосточный медицинский журнал. - 2017. - № 4. - С. 69-73. 12. Страйер Л. Биохимия: Т. 2. - М.: Мир, 1985. - 312 с.
12. Страйер Л. Биохимия: Т. 2. - М.: Мир, 1985. - 312 с. 13. Чайлахян Р.К., Аверьянов А.В., Забозлаев Ф.Г. и соавт. Сравнительное исследование эффективности трансплантации мультипотентныхмезенхимальныхстромальных клеток костного мозга, культивированных в условиях нормоксии и гипоксии, и их кондиционированных сред на модели острого повреждения легких // Клеточные технологии в биологии и медицине. - 2014. - № 1. - С. 25-32.
13. Чайлахян Р.К., Аверьянов А.В., Забозлаев Ф.Г. и соавт. Сравнительное исследование эффективности трансплантации мультипотентныхмезенхимальныхстромальных клеток костного мозга, культивированных в условиях нормоксии и гипоксии, и их кондиционированных сред на модели острого повреждения легких // Клеточные технологии в биологии и медицине. - 2014. - № 1. - С. 25-32. 14. Kuznetsova M., Lebed'ko O., Ryzhavskii B., Mishchenko N. Effect of oral administration of echinochrome on lipopolysaccharide-induced lung injury in the immature Wistar rats // European Respiratory Journal. - 2019. - Vol. 54 (suppl. 63).
14. Kuznetsova M., Lebed'ko O., Ryzhavskii B., Mishchenko N. Effect of oral administration of echinochrome on lipopolysaccharide-induced lung injury in the immature Wistar rats // European Respiratory Journal. - 2019. - Vol. 54 (suppl. 63). 15. Lebedev A.V., Ivanova M.V., Levitsky D.O. Echinochrome, a naturally occurring iron chelator and free radical scavenger in artificial and natural membrane systems // Life Sci. - 2005. - № 76 (8). - P. 863-875.
15. Lebedev A.V., Ivanova M.V., Levitsky D.O. Echinochrome, a naturally occurring iron chelator and free radical scavenger in artificial and natural membrane systems // Life Sci. - 2005. - № 76 (8). - P. 863-875.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»