2021 год № 2
Медико-биологические науки
2Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел. 8-(4212)-30-53-11, e-mail: nauka@mail.fesmu.ru, г. Хабаровск
Резюме:
Ключевые слова:
2Far Eastern State Medical University, Khabarovsk
Abstract:
Key words:
Введение |
 |
 |
Синдром дыхательных расстройств является ведущей причиной неонатальной смертности у новорожденных при недоношенности [1, 2, 6]. Его важнейшими морфологическими проявлениями в легких служат ателектазы, кровоизлияния, а также нарушения микроциркуляции, повреждения альвеолярного и бронхиолярного эпителия. Часто наблюдающимися и существенно влияющими на эффективность газообмена при этом являются гиалиновые мембраны, имеющие различную морфологию - типичных пристеночных, или обтурирующих просветы альвеол в зонах врожденных ателектазов [1, 2, 6, 11]. В связи с высокой практической значимостью синдрома дыхательных расстройств у новорожденных ведется интенсивный поиск средств, способных предупредить его или снизить тяжесть данной патологии. Ранее нами была предложена модель, в которой многие морфологические изменения легких новорожденных недоношенных детей при синдроме дыхательных расстройств воспроизводились введением новорожденным крысам блеомицина - антибиотика с цитостатическими свойствами, обладающего способностью вызывать альтерацию различных структур легких, индуцировать пневмофиброз [4, 9]. Настоящая работа посвящена изучению влияния на патологические изменения в легких новорожденных, индуцированные введением блеомицина, введением препарата (Пр), созданного на основе эхинохрома А - соединения, выделенного из тканей морских ежей, обладающего выраженной способностью ингибировать свободнорадикальное окисление [9, 12].
Материалы и методы
|
 |
 |
Экспериментальное исследование было проведено в соответствии с принципами "Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях". Изучались легкие крыс, разделенных на 3 группы. Животным 1-й группы (опыт, n=10) в возрасте 1, 2, 3 суток внутрибрюшинно был введен блеомицин (1 мг/кг массы тела), растворенный в 0,1 мл физраствора. Непосредственно перед каждым инъецированием блеомицина животным этой группы per os вводилась субстанция (Суб), содержащая эхинохром А (Эх А), токоферол и аскорбиновую кислоту (10 мг/кг массы тела в расчете на ЭхА, 2,4 мг токоферола, 10,3 мг аскорбиновой кислоты), разведенная в дистиллированной воде (объем - 0,05 мл). Животным 2-й группы (контроль, n=12) вводился блеомицин в той же дозе, как и в 1-й, и per os - 0,05 мл дистиллированной воды. 3-ю группу составили интактные крысы (n=6). Животные всех групп являлись потомством интактных самцов и самок, содержались одновременно в условиях одного вивария. Забой животных сравниваемых групп производился при достижении ими возраста 5 суток, декапитацией. Легкие фиксировали в жидкости Карнуа, заливали в парафин, готовили срезы толщиной 7 мкм, окрашивали их гематоксилином и эозином. При их изучении полуколичественно, в баллах (от 0 до 3) оценивали те показатели, которые изменяются под влиянием блеомицина: наличие и выраженность гиалиновых мембран, гипертрофию межальвеолярных перегородок, наличие макрофагов в просветах альвеол, кровоизлияний, а также клеточного детрита в просветах бронхов и бронхиол. В легких крыс интактной группы перечисленные альтеративные изменения не выявлялись. У крыс 1-й (опыт) и 2-й (контроль) групп они проявлялись в разной степени. Отсутствие каждого из этих патологических изменений легких оценивалось в 0 баллов. Выявляемые при изучении среза легкого, проходящего через его долю, единичные гиалиновые мембраны или кровоизлияния размером до 50 мкм, наличие клеточного детрита, занимающего не более четверти их просвета в просвете бронхиол, единичные макрофаги в просветах отдельных альвеол, единичные утолщения интерстициальной ткани межальвеолярных перегородок - в 1 балл. Каждое из этих изменений, наблюдаемых в срезе во многих местах - в 2 балла. Наличие очагов кровоизлияний размером более 100 мкм, большой объем детрита в просветах бронхиол, бронхов, занимающий половину и более площади их просветов, очаги гипертрофии интерстициальной ткани размером более 100 мкм, наличие макрофагов в просветах большинства альвеол оценивались в 3 балла. Измерения размеров патологических очагов проводились окулярмикрометром.
На криостатных срезах толщиной 20 мкм проводили реакцию на НАДН-дегидрогеназу (НАДН-Д) по [5]. При длине волны 560-580 нм производили фотографирование препаратов, микрофотографии импортировали в программу Видеотест 5. Активность фермента определяли в этой программе на основании цитофотометрии продукта реакции в цитоплазме не менее 25 НАДН-Д-позитивных макрофагов в легком каждого животного. Полученные при балльной оценке данные, а также результаты цитоспектрофотометрии обрабатывали в программе Statistica, используя опцию Дескриптивная статистика. Определяли среднюю арифметическую и ее стандартную ошибку (М±м). Межгрупповые различия считали статистически значимыми при P<0,05.
Результаты и обсуждение
|
 |
 |
Изучение препаратов легких животных контрольной группы выявило изменения, описанные нами ранее [9]. Они включали в себя гиалиновые мембраны в альвеолах, детрит в воздухоносных путях, очаговую гипертрофию интерстициальной ткани, кровоизлияния в альвеолы и интерстициальную ткань (рис. 1). Кроме того, при этом наблюдалось значительное число макрофагов в межальвеолярных перегородках и просветах альвеол (рис. 2). При изучении реакции на НАДН-Д выявлялось увеличенное количество макрофагов, маркировавшихся высокой активностью этого фермента (рис. 3). Цитоспектрофотометрическое изучение интенсивности реакции на НАДН-Д показало ее достоверное увеличение в цитоплазме макрофагов по сравнению с наблюдавшейся у интактных животных (0,652±0,018 усл. ед. против 0,559±0,026 усл. ед.). Таким образом, введение блеомицина по-видимому активировало поступление предшественников макрофагов из костного мозга в легкие [8] и обусловливало в них повышенную интенсивность реакции на НАДН-Д, отражающую активность внутримитохондриального окисления [9]. Эти данные представляют интерес в связи с тем, что макрофаги являются многочисленной группой клеток в интерстициальной ткани легких, составляющей 10-15 % от всех клеток межальвеолярных перегородок и 77-96 % клеток бронхоальвеолярной жидкости. При этом в цитоплазме макрофагов на долю митохондрий приходится более 30 % объема [8]. В бронхиолах и бронхах выявлялись детрит, некротизированные клетки, форменные элементы крови. Таким образом, введение блеомицина новорожденным крысам обусловило развитие в легких изменений, характерных для синдрома дыхательных расстройств у недоношенных новорожденных детей [1, 2]. При этом описанные патоморфологические изменения, различаясь по интенсивности, наблюдались в легких всех крыс контрольной группы.
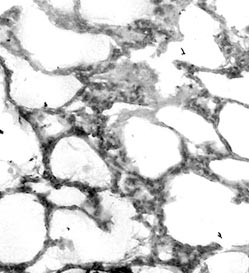
Рис. 1. Легкое крысы контрольной группы. Гиалиновые мембраны в альвеолах. Окраска гематоксилином и эозином. Увеличение 15×20
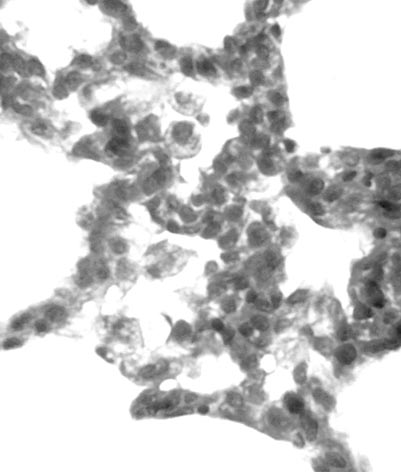
Рис. 2. Легкое крысы контрольной группы. Макрофаги в просветах альвеол. Окраска гематоксилином и эозином. Увеличение 15×100
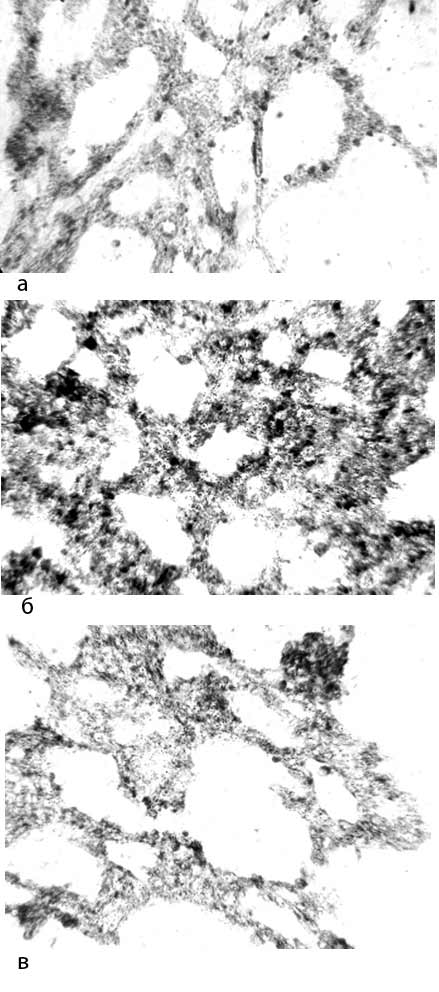
Рис. 3. Легкие крыс из интактной (а), контрольной (б) и опытной групп (в). Реакция на НАДН-Д. Увеличение 15×20. В межальвеолярных перегородках легкого крысы опытной группы меньшее, чем у контрольной, количество НАДН-Д-позитивных макрофагов
Введение перед инъекцией блеомицина животным опытной группы Суб значительно уменьшило выраженность описанных изменений. Они наблюдались лишь у части крыс этой группы и были менее выражены, чем у животных контрольной группы. Полуколичественная оценка развившихся в легких крыс опытной и контрольной групп патологических изменений органа показала статистически достоверное и значительное уменьшение выраженности всех их в легких крыс данной группы (таблица).
При этом введение Суб, уменьшившее частоту нахождения макрофагов в просветах альвеол, предотвратило и повышение активности НАДН-Д в этих клетках (таблица). Она была достоверно ниже, чем в контроле (0,577±0,017 усл. ед. против 0,652±0,018 усл. ед.) и была близка к данному показателю у интактных крыс (0,559±0,026 усл. ед). В связи с этим можно предположить, что одним из механизмов действия Пр, уменьшившего тяжесть альтерации в легких, является снижение количества поступающих в них клеток-предшественников макрофагов и активации в них внутримитохондриального окисления. Выявленные изменения, развившиеся под влиянием блеомицина и значительно уменьшенные при введении Суб, заслуживает внимания и в связи с тем, что митохондрии, в которых происходят НАДН-Д-зависимые процессы биологического окисления [10], являются продуцентами активных форм кислорода, участвующих в регуляции иммунных реакций, с одной стороны, и повреждающих различные структуры органов, с другой [7].
| Группа | Блеомицин + препарат (опыт) | Блеомицин (контроль) |
|---|---|---|
| Показатели | ||
| Гиалиновые мембраны | 0,56±0,17 | 2,09±0,31 |
| Гипертрофия интерстициальной ткани | 1,0±0,16 | 1,73±0,24 |
| Кровоизлияния | 0,44±0,08 | 1,09±0,28 |
| Клеточный детрит в просветах бронхов | 0,33±0.17 | 1,09±0,16 |
| Макрофаги в просветах альвеол | 0.67±0,17 | 1,82±0,26 |
| Активность НАДН-Д в макрофагах межальвеолярных перегородок | 0,577±0,017 | 0,652±0,018 |
Примечание. * - все межгрупповые различия статистически достоверны (P<0,05).
Таким образом, на предложенной ранее модели было показано, что патоморфологические изменения, развивающиеся в легких новорожденных крыс под влиянием блеомицина и воспроизводящей важные изменения в органе при синдроме дыхательных расстройств у недоношенных новорожденных детей, существенно уменьшаются при введении Суб, созданной на основе эхинохрома А. Данные литературы позволяют предполагать, что эффект введения Суб обусловлен высокой способностью ингибировать свободнорадикальное окисление [9,12], являющееся важным механизмом повреждения тканей легкого.
Способность Суб уменьшать степень альтерации легких, число макрофагов в их интерстициальной ткани было показано и в экспериментах на взрослых крысах, подвергнутых воздействию липополисахарида [3]. Таким образом, действие Суб было сходным с выявленным в настоящей работе, хотя эксперименты были поставлены на животных различного возраста, а повреждающие легкие агенты были разными - блеомицин и липополисахарид. Это позволяет предполагать, что Суб, содержащая эхинохром А, токоферол и аскорбиновую кислоту, обладая выраженной способностью подавлять свободнорадикальное окисление [4, 12], может при действии исследованных повреждающих легкие агентов, влиять и на интенсивность миграции из красного костного мозга в этот орган предшественников макрофагов и предотвращать активацию в них внутримитохондриального окисления. Проверка этого предположения заслуживают, по нашему мнению, дальнейшего детального изучения, в том числе, при действии других факторов, повреждающих легкие.
Литература |
 |
 1. Глуховец Б.И., Гайворонский И.В., Белоусова Н.А., Пахаленко Д.В. Патогенетические особенности синдрома дыхательных расстройств у новорожденных с экстремально низкой массой тела // Архив патологии. - 2005. - Т. 67, № 4. - С. 3-5.
1. Глуховец Б.И., Гайворонский И.В., Белоусова Н.А., Пахаленко Д.В. Патогенетические особенности синдрома дыхательных расстройств у новорожденных с экстремально низкой массой тела // Архив патологии. - 2005. - Т. 67, № 4. - С. 3-5.  2. Игнатьева А.В., Гаймоленко И.Н., Баранчугова Л.М., Панченко А.С. Патоморфология легких при бронхолегочной дисплазии // Дальневосточный медицинский журнал. - 2012. - № 4. - С. 63-66.
2. Игнатьева А.В., Гаймоленко И.Н., Баранчугова Л.М., Панченко А.С. Патоморфология легких при бронхолегочной дисплазии // Дальневосточный медицинский журнал. - 2012. - № 4. - С. 63-66.  3. Лебедько О.А., Рыжавский Б.Я., Жильников Д.И. Влияние препарата, содержащего эхинохром А, токоферол и аскорбиновую кислоту, на легкие крыс, подвергнутых введению липополисахарида // Дальневосточный медицинский журнал. - 2020. - № 4. - С. 60-64.
3. Лебедько О.А., Рыжавский Б.Я., Жильников Д.И. Влияние препарата, содержащего эхинохром А, токоферол и аскорбиновую кислоту, на легкие крыс, подвергнутых введению липополисахарида // Дальневосточный медицинский журнал. - 2020. - № 4. - С. 60-64.  4. Лебедько О.А., Рыжавский Б.Я., Ткач О.В., Кузнецова М.С., Гусева О.Е. Влияние перорального введения эхинохрома А на структурно-метаболические нарушения, индуцированные блеомицином в легких крыс, на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2015. - № 3. - С. 92-96.
4. Лебедько О.А., Рыжавский Б.Я., Ткач О.В., Кузнецова М.С., Гусева О.Е. Влияние перорального введения эхинохрома А на структурно-метаболические нарушения, индуцированные блеомицином в легких крыс, на раннем этапе постнатального онтогенеза // Дальневосточный медицинский журнал. - 2015. - № 3. - С. 92-96.  5. Лойда З., Госсрау Р., Шиблер Т. Гистохимия ферментов. - М.: Мир, 1982. - 270 с.
5. Лойда З., Госсрау Р., Шиблер Т. Гистохимия ферментов. - М.: Мир, 1982. - 270 с.  6. Мороз В.В., Голубев А.М., Перепелица С.А., Смердова Е.Ф. Перепелица С.А., Авакьян Ю.М., Качигурова С.В., Яковцев В.Н. Изменения легких у недоношенных новорожденных с болезнью гиалиновых мембран // Общая реаниматология. - 2009. - Т. 5, № 2. - С. 5-11.
6. Мороз В.В., Голубев А.М., Перепелица С.А., Смердова Е.Ф. Перепелица С.А., Авакьян Ю.М., Качигурова С.В., Яковцев В.Н. Изменения легких у недоношенных новорожденных с болезнью гиалиновых мембран // Общая реаниматология. - 2009. - Т. 5, № 2. - С. 5-11. 7. Пинегин Б.В., Воробьева Н.В., Пащенков М.В., Черняк Б.В. Роль Митохондриальных активных форм кислорода в активации врождённого иммунитета // Иммунология. - 2018. - № 4. - С. 221-229.
7. Пинегин Б.В., Воробьева Н.В., Пащенков М.В., Черняк Б.В. Роль Митохондриальных активных форм кислорода в активации врождённого иммунитета // Иммунология. - 2018. - № 4. - С. 221-229.  8. Руководство по гистологии. Т. 1, 2 / Под редакцией Р.К. Данилова. - СПб.: СпецЛит, 2011.
8. Руководство по гистологии. Т. 1, 2 / Под редакцией Р.К. Данилова. - СПб.: СпецЛит, 2011.  9. Рыжавский Б.Я., Лебедько О.А. Формирование гиалиновых мембран в легких белых крыс как результат воздействия блеомицина в неонатальном периоде // Бюллетень экспериментальной биологии и медицины. - 2015. - № 9. - С. 379-383.
9. Рыжавский Б.Я., Лебедько О.А. Формирование гиалиновых мембран в легких белых крыс как результат воздействия блеомицина в неонатальном периоде // Бюллетень экспериментальной биологии и медицины. - 2015. - № 9. - С. 379-383. 10. Страйер Л. Биохимия: В 3 т. Т. 2. - М.: Мир, 1985. - 312 с.
10. Страйер Л. Биохимия: В 3 т. Т. 2. - М.: Мир, 1985. - 312 с. 11. Della Latta V., Cecchettini A., Del Ry S., Morales M.A. Bleomycin in the setting of lung fibrosis induction: From biological mechanisms to counteractions // Pharmacol. Res. - 2015. - Vol. 97. - P. 122-130.
11. Della Latta V., Cecchettini A., Del Ry S., Morales M.A. Bleomycin in the setting of lung fibrosis induction: From biological mechanisms to counteractions // Pharmacol. Res. - 2015. - Vol. 97. - P. 122-130. 12. Mishenko N.P., Vasileva E.A., Fedoreyev S.А., Lebedko O.A., Ryzhavskii B.Ya., Kuznetsova M.S. Antioxidant composition of echinochrome, ascorbic acid and αtocopherol for treating inflammatory processes in lungs // Vestnik FEB RAS. - 2018. - № 6 Supplement. - Р. 163-167.
12. Mishenko N.P., Vasileva E.A., Fedoreyev S.А., Lebedko O.A., Ryzhavskii B.Ya., Kuznetsova M.S. Antioxidant composition of echinochrome, ascorbic acid and αtocopherol for treating inflammatory processes in lungs // Vestnik FEB RAS. - 2018. - № 6 Supplement. - Р. 163-167.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Материалы и методы |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»