2021 год № 3
Клиническая медицина
2Клиническая больница "РЖД-медицина", 680013, ул. Воронежская, 49;
3 301 Военный клинический госпиталь, 680028, ул. Серышева, 1, г. Хабаровск
Резюме:
Ключевые слова:
2Clinical Hospital "Russian Railways Medicine";
3 301 Military Clinical Hospital, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Пандемия COVID-19 потребовала создания и экстренного внедрения в клиническую практику новых иммунобиологических препаратов (вакцин). К апрелю 2021 года 13 вакцин прошли национальные процедуры регистрации, и в мире уже введено свыше 800 млн доз. Особую актуальность приобретает накопление и анализ клинического опыта по оценке эффективности и безопасности полученных препаратов. Безопасность вакцин характеризуется частотой нежелательных явлений (НЯ), включающих все изменения состояния здоровья реципиента, возникшие в поствакцинальном периоде. При их анализе оценивается степень тяжести [9], серьезность (влияние на здоровье и отдаленные последствия), а также причинно-следственная связь с вакцинацией [25].
Результаты и обсуждение
|
 |
 |
Классификация ВОЗ подразделяет НЯ на обычные и редкие; отдельно учитываются тяжелые, серьезные НЯ и вакцинассоциированные заболевания. Обычные НЯ, системные и местные, - часть иммунного ответа на вакцину, проходят без лечения и не имеют отдаленных последствий. В целом, местные реакции (боль, отек и гиперемия в месте инъекции) встречаются от 5 до 50 % случаев, системные НЯ (лихорадка, мышечные и головные боли, другие неспецифические симптомы) - от 1 до 60 %. Частота серьезных НЯ, включающих анафилаксию, судороги, гипотензивно-гипореспонсивный синдром, тромбоцитопению и другие, зависит от вида вакцины и составляет от 1 до 1 000 случаев на 1 млн доз [25].
Мишенью для выработки вакцинального иммунитета к SARS-CoV-2 служит спайк-протеин вируса, обеспечивающий связь с рецепторами восприимчивых клеток. Помимо общих проблем безопасности, специфической задачей создания вакцины против коронавируса является преодоление возможного феномена антитело-зависимого усиления инфекции (АЗУИ), описанного для РНК-вирусов и для коронавирусов [29]. Возможной причиной этого феномена является антигенная изменчивость S-белка, поэтому антитела, выработанные на вакцинный штамм вируса, могут иметь меньшую аффинность и образовывать менее стабильные комплексы с новыми штаммами "дикого" вируса при реальной инфекции. В результате комплекс антитело-вирус может выступать в роли "троянского коня", помогая вирусу проникнуть в моноциты или макрофаги хозяина, где он распадается, освобождая вирус и запуская в этих клетках инфекционный процесс [24].
В основе одобренных вакцин против SARS-CoV-2 - 4 разные технологические платформы, каждая из которых имеет свои преимущества и недостатки [22].
Инактивированные цельновирионные вакцины получают путем выращивания вируса в культуре клеток и последующей химической инактивации: CoronaVac, Sinopharm, BBIBP-CorV (Китай), Covaxin (Индия) и КовиВак (Центр Чумакова, Россия) [30, 26, 27, 11].
Векторные нереплицируемые вакцины основаны на другом вирусе, который служит для экспрессии спайк-протеина коронавируса, и сам не способен к репликации. Векторный вирус проникает в клетки реципиента и экспрессирует спайковый протеин, на который вырабатывается клеточный и гуморальный иммунитет. В качестве вектора в зарегистрированных вакцинах использованы аденовирусы человека 26-го (COVID-19 Vaccine Janssen (Ad26.COV2.S), Нидерланды/США) и 5-го типов (Convidicea, Китай; Гам-КОВИД-Вак (Спутник V), НИЦЭМ им Н.Ф. Гамалеи, Россия - 26+5 типы) и аденовирус шимпанзе (ChAdOx1 nCoV-19 (AZD1222), Швеция/Великобритания) [17, 31, 16, 23].
РНК-вакцины содержат информацию об аминокислотной последовательности белков вируса и способны направлять синтез этих белков в организме вакцинированного. Для эффективной доставки и стабилизации вирусной РНК используются липидные нано-частицы или полимерные материалы: Comirnaty Pfizer/BionTech (США/Германия) и Moderna (США) [4, 18].
В рекомбинантных белковых вакцинах используют S-белок коронавируса или рецептор-связывающий домен, полученные в экспрессионных системах: ZF2001 (Китай) и ЭпиВакКорона (Центр "Вектор", Россия) [28].
Отчеты о клинических испытаниях (КИ) разных фаз показывают сравнительно более низкую реактогенность инактивированных цельновирионных вакцин (таблица). При этом результаты КИ 1-2 фазы, с небольшим числом здоровых участников, не позволяют судить о частоте тяжелых и редких НЯ, возрастающей по мере увеличения количества примененных доз. Так, феномен АЗУИ впервые проявился только при большом мультицентровом исследовании инактивированной вакцины против респираторно-синцитиального вируса [19].
| Вакцина | Фаза КИ | Количество участников, возраст, лет | НЯ 1-2 степени, % | Тяжелые НЯ, % | Серьезные НЯ, % | |
|---|---|---|---|---|---|---|
| системные | местные | |||||
| Инактивированные вакцины | ||||||
| Sinopharm, Китай | 1-2 | 320, 18-59 | 12-25 | - | - | |
| BBIBP-CorV, Китай | 1-2 | 480, 18-80 | 23-29 | 0,2 | - | |
| CoronaVac, Китай | 1-2 | 743, 18-59 | 29-38 | - | - | |
| Covaxin BBV152, Индия | 1 | 375, 18-55 | 17 | - | - | |
| Векторные вакцины | ||||||
| Janssen COVID-19 Vaccine, Нидерланды/США | 3 | 21 895, ≥18 | 45,3-61,5 | 35,4-59,8 | 0,9-2,3 | <0,1 |
| AZD1222, Швеция/Великобритания | 2/3-3 | 23 848, ≥18 | 55-88 | 43-86 | 1-5 | - |
| Гам-КОВИД-Вак, Россия | 3 | 16 501, ≥18 | 48 | - | - | |
| Convidicea, Китай | 2 | 508, ≥18 | 32-42 | 57 | 9 | - |
| РНК-вакцины | ||||||
| Pfizer/BionTech, США/Германия | 3 | 21 720, ≥16 | 39-59 | 66-83 | 2,3 | 0,02 |
| Moderna, США | 3 | 15 210, ≥18 | 54,9-79,4 | 84,2-88,6 | 1,5 | 0,6 |
| Рекомбинантные белковые вакцины | ||||||
| ZF2001, Китай | 1-2 | 600, 18-59 | 29-48 | 1-3 | - | |
Отчеты о КИ 3 фазы (РНК и векторные препараты) с включением нескольких тысяч участников разного возраста, в том числе имеющих стабильные хронические заболевания, свидетельствуют о достаточно высокой реактогенности (большом количестве системных и местных НЯ), но приемлемой безопасности (редких тяжелых и серьезных НЯ). В них не было отмечено никаких доказательств ассоциированного с вакцинами АЗУИ [4, 18]. Тяжесть и длительность системных НЯ увеличивалась после второй дозы вакцины Moderna с ростом доли событий 2 и 3 степени. Местные и системные НЯ чаще наблюдались у реципиентов младше 65 лет и реже встречались у вакцинированных, исходно имевших антитела к SARS-CoV-2, чем у серонегативных лиц [4]. Векторные вакцины ChAdOx1 nCoV-19 и Janssen Ad26.COV2.S имели более низкий профиль реактогенности у лиц старше 65 лет, чем у молодых. Повторная вакцинации ChAdOx1 nCoV-19 вызывала меньше побочных эффектов, чем первичная [13, 18].
Анафилаксия после использования РНК вакцин Moderna и Pfizer/BionTech встречалась с частотой 2,5-11,1 на 1 млн доз, что в 10 раз чаще, чем после других вакцин, в основном у лиц с отягощенным аллергологическим анамнезом [21, 2]. Полагают [7], что данные реакции в большей степени связаны с неиммунологической активацией тучных клеток и комплемента, возникающей в ответ на вспомогательные компоненты (полиэтиленгликоль - ПЭГ 2000 или липосомальные носители). При этом ПЭГ-подобную структуру и свойства имеет полисорбат 80, входящий в состав COVID-19 Vaccine Janssen, ChAdOx1 nCoV-19 (AZD1222) и Гам-КОВИД-Вак. Поэтому пациентам с анафилаксией после получения BioNTech/Pfizer или вакцины Moderna следует избегать всех препаратов, содержащих ПЭГ 2000 или полисорбат 80, пока проводятся дальнейшие исследования [7]. Так, из 64 900 участников, получивших 1 дозу вакцин PfizerBioNTech (60 %) и Moderna (40 %), зарегистрировано 2,1 % острых аллергических реакций, из них 16 (0,025 %) случаев анафилаксии (94 % женщин, средний возраст - 41 год, 63 % из них имели аллергию и 31 % анафилаксию в анамнезе). Среднее время до развития симптомов анафилаксии составило 17 минут, все случаи закончились выздоровлением [6].
Baden L.R. и соавт. [4] сообщают об отсроченных реакциях в месте инъекции в виде выраженного уплотнения с гиперемией и болезненностью у 0,8 % участников после первой и у 0,2 % после второй дозы вакцины Moderna в 3 фазе КИ. Аналогичные данные приводят Kimberly G. Blumenthal, et al., которые при оценке биоптатов кожи выявили признаки гиперчувствительности замедленного типа, опосредованной Т-клетками. Лечение антигистаминными препаратами, местными и/или пероральными глюкокортикоидами приводило к полному разрешению симптомов, в среднем, через 6 дней. В дальнейшем все пациенты получили вторую дозу, при этом у половины наблюдались повторные местные реакции аналогичной или меньшей степени [5].
Lee E.J. и соавт. сообщали о случаях иммунной тромбоцитопении и кровотечений, наблюдавшихся после применения вакцин Moderna и Pfizer-BioNTech [14]. В марте 2021 г. с ростом числа вакцинированных в ЕЭС и Великобритании появились сообщения с описанием синдрома, характеризующегося тромбозом и тромбоцитопенией, которые развились через 5-24 дня после первоначальной вакцинации ChAdOx1 (AstraZeneca). Европейское медицинское агентство сообщило о 169 случаях тромбоза церебральных венозных синусов (ЦВС) и 53 случаях тромбоза мезентериальных вен среди 34 миллионов реципиентов вакцины ChAdOx1 [3]. Описано 35 случаев тромбоза ЦВС среди 54 миллионов реципиентов мРНК-вакцины Pfizer-BioNTech и 5 возможных (но не подтвержденных) случаев среди 4 миллионов реципиентов мРНК-вакцины Moderna [8]. В США были зарегистрированы 12 случаев тромбоза ЦВС (с тромбозом мезентериальных вен или без него) среди более 7 миллионов реципиентов аденовирусной векторной вакцины Johnson & Johnson/Janssen Ad26.COV2. [20]. Это редкое тяжелое осложнение развивалось чаще у женщин моложе 60 лет и сопровождалось 40 % летальностью. Среднее количество тромбоцитов при постановке диагноза составляло 20-30*109/л, отмечался высокий уровень D-димера и низкие уровни фибриногена. Патогенез синдрома вакцино-индуцированной иммунной тромботической тромбоцитопении (VITT) еще не ясен, отмечается его сходство с механизмом гепарин-индуцированной тромбоцитопении и образованием антител к PF4 рецептору тромбоцитов. В результате происходит внутрисосудистая спонтанная активация тромбоцитов с запуском каскада коагуляционного гемостаза [12].
Первая из вакцин, одобренных в России для экстренного применения - Гам-КОВИД-Вак (SputnikV) разработки НИЦЭМ им. Н.Ф. Гамалеи. Это комбинированная векторная вакцина на основе нереплицирующихся аденовирусов человека rAd 26 и rAd 5, оба из которых несут ген полноразмерного S-протеина SARS-CoV-2. Компоненты вводятся внутримышечно с интервалом 21 день. Использование гетерологичной вакцинации с помощью прайм-буста двумя разными векторами дает устойчивый, продолжительный как клеточный, так и гуморальный иммунитет и минимизирует иммунный ответ против компонентов вектора [10, 1].
Выполненное в сентябре-ноябре 2020 г. в клиниках Москвы КИ 3 фазы, показало эффективность вакцины против COVID-19 в 91,6 %, а против тяжелых случаев - 100 %. Всего 48 % участников в возрасте старше 18 лет сообщили о наличии НЯ в поствакцинальном периоде, самыми частыми были гриппоподобный синдром, реакция в месте введения, головная боль и астения. 94 % НЯ относились к 1 степени, 5,7 % к 2 степени тяжести; серьезных НЯ, связанных с вакцинацией, не зарегистрировано. Безопасность дополнительно оценена в подгруппе реципиентов 60-87 лет (1 363 участника): наблюдалось 15,2 % случаев гриппоподобного синдрома и 5,4 % местных реакций 1-2 степени [15].
В декабре 2020 года началась массовая вакцинация Гам-КОВИД-Вак в ДВФО. Нами выполнен анализ частоты НЯ после введения 1 компонента вакцины у 433 и 2 компонента у 302 реципиентов в возрасте от 18 до 85 лет. Изучались местные и системные побочные эффекты, применение жаропонижающих и обезболивающих препаратов в течение 3 недель после получения 1 дозы и 2 недель после 2 дозы. Результаты носят описательный характер и представлены в виде процентов от исходной выборки. Статистическая обработка выполнялась с помощью универсального статистического пакета STADIA, методом согласия частот событий.
Медиана возраста составила 40 (33; 47) лет, 79 % мужчин, 21 % женщин. 133 (30,2 %) реципиента имели хронические заболевания: гипертоническая болезнь, ИБС, сахарный диабет, гипотиреоз, бронхиальная астма, аллергический ринит, ХОБЛ, язвенная болезнь, онкологические заболевания в стадии компенсации; 23 % постоянно принимали медикаментозную терапию в соответствии с имеющейся патологией.
Общее количество системных НЯ после введения 1 компонента составило 48,2 %. В 19,3 % отмечен субфебрилитет, лихорадка 1 степени (38-39 °С) - у 10,9 %, 2 степени (39-40 °С) - у 4,1 %, 3 степени (>40 °С) - у 1 (0,23 %) реципиента. Системные НЯ включали гриппоподобный симптомокомплекс, тошноту, снижение работоспособности. Местные симптомы 1-2 степени наблюдались у 17 % реципиентов, у одного отмечена отсроченная местная реакция через неделю после введения 1 компонента. Системные и местные НЯ разрешались в течение 1-3 суток. Всего 12,5 % участников принимали жаропонижающие или обезболивающие препараты. Выявлено 3 случая НЯ, расцененных как тяжелые и послуживших противопоказанием для введения 2 компонента вакцины (все - у лиц младше 40 лет): 1 случай лихорадки 3 степени; 1 случай лихорадки 2 степени, сопровождавшейся судорогами мышц нижних конечностей; 1 случай обострения хронической крапивницы с отеком лица. Введение 2 компонента вакцины сопровождалось достоверно меньшим числом НЯ, в сравнении с 1 компонентом. Общее количество системных реакций составило 24,2 % (p<0,01), местных - 4,6 % (p<0,01), лихорадка - 6,9 % (p<0,01). Субфебрилитет - в 10,9 %, лихорадка 1 степени - у 3,9 %, 2 степени - у 2,6 %, 3 степени - у 1 реципиента (0,3 %).
Реципиенты вакцины были разделены на 2 возрастные группы: 18-49 лет (n=349) и 50 лет и старше (n=84). Все лица старшей группы имели хронические заболевания и постоянно принимали медикаменты. Частота системных НЯ в группе 18-49 лет была в 3 раза выше по сравнению с группой 50 лет и старше после введения как 1, так и 2 компонентов вакцины (соответственно 53, 9 % и 15,5 % после 1 компонента; 26,5 % и 8,3 % после 2 компонента(p<0,01)). В то время как частоты местных реакций в обеих группах значимо не различались (17,8 % и 14,3 %; 3,9 % и 1,4 %) (рисунок).
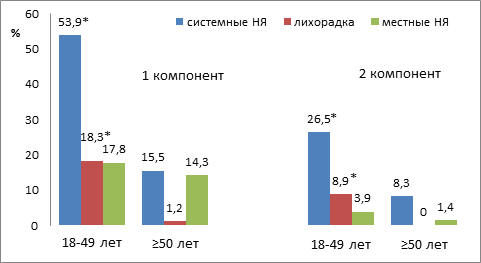
Рис. 1. Частота НЯ (%) после введения 1 и 2 компонентов Гам-КОВИД-Вак у реципиентов двух возрастных групп
Примечание. * - достоверные различия по критерию согласия частот событий (р<0,01) между возрастными группами.
Таким образом, по нашим наблюдениям, вакцина Гам-КОВИД-Вак характеризуется приемлемым уровнем реактогенности, сопоставимым с другими вирусными вакцинами. Количество НЯ значительно ниже у вакцинированных старше 50 лет, уменьшается после введения 2 компонента и не зависит от наличия стабильных хронических заболеваний и принимаемых медикаментов.
Литература |
 |
 1. Ковыршина А.В., Должикова И.В., Гроусова Д.М. и др. Комбинированная векторная вакцина для профилактики ближневосточного респираторного синдрома индуцирует формирование длительного протективного иммунного ответа к коронавирусу БВРС-КоВ // Иммунология. - 2020. - Т. 41, № 2. - С. 135-143. DOI: 10.33029/0206-4952-2020-41-2-135-143.
1. Ковыршина А.В., Должикова И.В., Гроусова Д.М. и др. Комбинированная векторная вакцина для профилактики ближневосточного респираторного синдрома индуцирует формирование длительного протективного иммунного ответа к коронавирусу БВРС-КоВ // Иммунология. - 2020. - Т. 41, № 2. - С. 135-143. DOI: 10.33029/0206-4952-2020-41-2-135-143.  2. Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Moderna COVID-19 Vaccine. Morbidity and Mortality Weekly Report - United States, December 21, 2020 - January 10, 2021. - Режим доступа: https://www.cdc.gov/mmwr/volmes/70/wr/mm7004e1.htm?s_cid=mm7004e1_w.
2. Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Moderna COVID-19 Vaccine. Morbidity and Mortality Weekly Report - United States, December 21, 2020 - January 10, 2021. - Режим доступа: https://www.cdc.gov/mmwr/volmes/70/wr/mm7004e1.htm?s_cid=mm7004e1_w. 3. AstraZeneca's COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. European Medicines Agency. News 07/04/2021. - Режим доступа: https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood.
3. AstraZeneca's COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. European Medicines Agency. News 07/04/2021. - Режим доступа: https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood. 4. Baden L.R., Sahly H.M., Essink B., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. // N Engl J Med. - 2021. - Vol. 384. - P. 403-416.
4. Baden L.R., Sahly H.M., Essink B., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. // N Engl J Med. - 2021. - Vol. 384. - P. 403-416. 5. Blumenthal K.G., Freeman E.E., Saff R.R. et al. Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2. // N Engl J Med. - 2021. - Vol. 384. - P. 1273-1277. DOI: 10.1056/NEJMc2102131.
5. Blumenthal K.G., Freeman E.E., Saff R.R. et al. Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2. // N Engl J Med. - 2021. - Vol. 384. - P. 1273-1277. DOI: 10.1056/NEJMc2102131. 6. Blumenthal K.G., Robinson L.B., Camargo C.A. Jr., et al. Acute Allergic Reactions to mRNA COVID-19 Vaccines // JAMA. - 2021. - Vol. 325, № 15. - P. 1562-1565. doi:10.1001/jama.2021.3976 Published online March 8, 2021. - Режим доступа: https://jamanetwork.com/journals/jama/fullarticle/2777417.
6. Blumenthal K.G., Robinson L.B., Camargo C.A. Jr., et al. Acute Allergic Reactions to mRNA COVID-19 Vaccines // JAMA. - 2021. - Vol. 325, № 15. - P. 1562-1565. doi:10.1001/jama.2021.3976 Published online March 8, 2021. - Режим доступа: https://jamanetwork.com/journals/jama/fullarticle/2777417. 7. Castells M.C., Phillips E.J. Maintaining Safety with SARS-CoV-2 Vaccines // N Engl J Med. - 2021. - Vol. 384, № 7. - P. 643-649. doi: 10.1056/NEJMra2035343.
7. Castells M.C., Phillips E.J. Maintaining Safety with SARS-CoV-2 Vaccines // N Engl J Med. - 2021. - Vol. 384, № 7. - P. 643-649. doi: 10.1056/NEJMra2035343. 8. Cines D.B., Bussel J.B. SARS-CoV-2 Vaccine-Induced Immune Thrombotic Thrombocytopenia. Published Online April 16, 2021, at NEJM.org. - Режим доступа: https://www.nejm.org/doi/10.1056/NEJMe2106315.
8. Cines D.B., Bussel J.B. SARS-CoV-2 Vaccine-Induced Immune Thrombotic Thrombocytopenia. Published Online April 16, 2021, at NEJM.org. - Режим доступа: https://www.nejm.org/doi/10.1056/NEJMe2106315. 9. Common Terminology Criteria for Adverse Events (CTCAE) v5.0 Publish Date: November 27, 2017. - Режим доступа: https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.5x11.pdf.
9. Common Terminology Criteria for Adverse Events (CTCAE) v5.0 Publish Date: November 27, 2017. - Режим доступа: https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.5x11.pdf. 10. Dolzhikova I.V., Zubkova O.V., Tukhvatulin A.I., et al. Safety and immunogenicity of GamEvac-Combi, a heterologous VSV- and Ad5-vectored Ebola vaccine: an open phase I/II trial in healthy adults in Russia // Hum Vaccin Immunother. - 2017. - Vol. 13. - P. 613-620.
10. Dolzhikova I.V., Zubkova O.V., Tukhvatulin A.I., et al. Safety and immunogenicity of GamEvac-Combi, a heterologous VSV- and Ad5-vectored Ebola vaccine: an open phase I/II trial in healthy adults in Russia // Hum Vaccin Immunother. - 2017. - Vol. 13. - P. 613-620. 11. Ella R., Vadrevu K.M., Jogdand H. et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBV152: a double-blind, randomised, phase 1 trial. // Lancet Infect Dis. - 2021. Published Online January 21, 2021. - Режим доступа: https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30942-7/fulltext.
11. Ella R., Vadrevu K.M., Jogdand H. et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBV152: a double-blind, randomised, phase 1 trial. // Lancet Infect Dis. - 2021. Published Online January 21, 2021. - Режим доступа: https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30942-7/fulltext. 12. Greinacher A., Thiele T., Warkentin T. E. et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. // N Engl J Med. - 2021. - Apr 9. - Режим доступа: https://www.nejm.org/doi/10.1056/NEJMoa2104840.
12. Greinacher A., Thiele T., Warkentin T. E. et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. // N Engl J Med. - 2021. - Apr 9. - Режим доступа: https://www.nejm.org/doi/10.1056/NEJMoa2104840. 13. Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19. FDA Briefing Document. February 26, 2021. - Режим доступа: https://www.fda.gov/media/146217/download.
13. Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19. FDA Briefing Document. February 26, 2021. - Режим доступа: https://www.fda.gov/media/146217/download. 14. Lee E.J., Cines D.B., Gernsheimer T, et al. Thrombocytopenia following Pfizer and Moderna SARS-CoV-2 vaccination. // Am J Hematol. - 2021. - Vol. 96. - P. 534-537.
14. Lee E.J., Cines D.B., Gernsheimer T, et al. Thrombocytopenia following Pfizer and Moderna SARS-CoV-2 vaccination. // Am J Hematol. - 2021. - Vol. 96. - P. 534-537. 15. Logunov D.Y., Dolzhikova I.V., Shcheblyakov D.V., et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia // Lancet. - 2021. - Vol. 397. - P. 671-681, Published Online February 2, 2021. - Режим доступа: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00234-8/fulltext.
15. Logunov D.Y., Dolzhikova I.V., Shcheblyakov D.V., et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia // Lancet. - 2021. - Vol. 397. - P. 671-681, Published Online February 2, 2021. - Режим доступа: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00234-8/fulltext. 16. Logunov D.Y., Dolzhikova I.V., Zubkova O.V., et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia // Lancet. - 2020. - Vol. 396. - P. 887-897.
16. Logunov D.Y., Dolzhikova I.V., Zubkova O.V., et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia // Lancet. - 2020. - Vol. 396. - P. 887-897. 17. Oliver S.E., Gargano J.W., Scobie H., et al. The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Janssen COVID-19 Vaccine - United States, February 2021 // Morbidity and Mortality Weekly Report Early Release. - Vol. 70, March 2, 2021. - Режим доступа: https://www.cdc.gov/mmwr/volumes/70/wr/mm7009e4.htm.
17. Oliver S.E., Gargano J.W., Scobie H., et al. The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Janssen COVID-19 Vaccine - United States, February 2021 // Morbidity and Mortality Weekly Report Early Release. - Vol. 70, March 2, 2021. - Режим доступа: https://www.cdc.gov/mmwr/volumes/70/wr/mm7009e4.htm. 18. Polack F.P., Thomas S.J., Kitchin N., et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine // N Engl J Med. - 2020. - Vol. 383. - P. 2603-2615. - Режим доступа: https://doi.org/10.1056/NEJMoa2034577.
18. Polack F.P., Thomas S.J., Kitchin N., et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine // N Engl J Med. - 2020. - Vol. 383. - P. 2603-2615. - Режим доступа: https://doi.org/10.1056/NEJMoa2034577. 19. Ruckwardt T.J., Morabito K.M., Graham B.S. et al. Immunological lessons from respiratory syncytial virus vaccine development. // Immunity. - 2019. - Vol. 51, № 3. - P. 429-442. doi: 10.1016/j.immuni.2019.08.007.
19. Ruckwardt T.J., Morabito K.M., Graham B.S. et al. Immunological lessons from respiratory syncytial virus vaccine development. // Immunity. - 2019. - Vol. 51, № 3. - P. 429-442. doi: 10.1016/j.immuni.2019.08.007. 20. See I., Su J.R., Lale A. et al. US Case Reports of Cerebral Venous Sinus Thrombosis With Thrombocytopenia After Ad26.COV2.S Vaccination, March 2 to April 21, 2021 // JAMA. Published online April 30, 2021. doi:10.1001/jama.2021.7517. - Режим доступа: https://jamanetwork.com/journals/jama/fullarticle/2779731.
20. See I., Su J.R., Lale A. et al. US Case Reports of Cerebral Venous Sinus Thrombosis With Thrombocytopenia After Ad26.COV2.S Vaccination, March 2 to April 21, 2021 // JAMA. Published online April 30, 2021. doi:10.1001/jama.2021.7517. - Режим доступа: https://jamanetwork.com/journals/jama/fullarticle/2779731. 21. Shimabukuro T.T., Cole M., Su J.R., et al. Reports of anaphylaxis after receipt of mRNA COVID-19 vaccines in the US-December 14, 2020-January18, 2021. // JAMA. - 2021. - Vol. 325, № 11. - P. 1101-1102. doi:10.1001/jama.2021.1967.
21. Shimabukuro T.T., Cole M., Su J.R., et al. Reports of anaphylaxis after receipt of mRNA COVID-19 vaccines in the US-December 14, 2020-January18, 2021. // JAMA. - 2021. - Vol. 325, № 11. - P. 1101-1102. doi:10.1001/jama.2021.1967. 22. Vetter V., Denizer G., Friedland L.R. Understanding modern-day vaccines: what you need to know // Ann Med. - 2018. - Vol. 50, № 2. - P. 110-120. doi: 10.1080/07853890.2017.1407035.
22. Vetter V., Denizer G., Friedland L.R. Understanding modern-day vaccines: what you need to know // Ann Med. - 2018. - Vol. 50, № 2. - P. 110-120. doi: 10.1080/07853890.2017.1407035. 23. Voysey M., Clemen S.A., Madhi S.A., et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK // Lancet. - 2021. - Vol. 397. - P. 99-11. - Режим доступа: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32661-1/fulltext.
23. Voysey M., Clemen S.A., Madhi S.A., et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK // Lancet. - 2021. - Vol. 397. - P. 99-11. - Режим доступа: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32661-1/fulltext. 24. Wan Y., Shang J., Sun S., et al. Molecular Mechanism for Antibody Dependent Enhancement of Coronavirus Entry // J Virol. - 2020. - Vol. 94, № 5. - Режим доступа: https://jvi.asm.org/content/94/5/e02015-19.
24. Wan Y., Shang J., Sun S., et al. Molecular Mechanism for Antibody Dependent Enhancement of Coronavirus Entry // J Virol. - 2020. - Vol. 94, № 5. - Режим доступа: https://jvi.asm.org/content/94/5/e02015-19. 25. World Health Organization. (2000). Supplementary information on vaccine safety. Part 2: background rates of adverse events following immunization. World Health Organization. - Режим доступа: https://apps.who.int/iris/handle/10665/ 66675.
25. World Health Organization. (2000). Supplementary information on vaccine safety. Part 2: background rates of adverse events following immunization. World Health Organization. - Режим доступа: https://apps.who.int/iris/handle/10665/ 66675. 26. Xia S., Duan K., Zhang Y., et al. Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes Interim Analysis of 2 Randomized Clinical Trials // JAMA. - 2020. - Vol. 324, № 10. - P. 4951-960. doi:10.1001/jama.2020.15543.
26. Xia S., Duan K., Zhang Y., et al. Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes Interim Analysis of 2 Randomized Clinical Trials // JAMA. - 2020. - Vol. 324, № 10. - P. 4951-960. doi:10.1001/jama.2020.15543. 27. Xia S., Zhang Y., Wang Y., et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial // Lancet Infect Dis. - 2020. - Vol. 21. - P. 39-51. Published Online October 15, 2020. - Режим доступа: https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30831-8/fulltext.
27. Xia S., Zhang Y., Wang Y., et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial // Lancet Infect Dis. - 2020. - Vol. 21. - P. 39-51. Published Online October 15, 2020. - Режим доступа: https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(20)30831-8/fulltext. 28. Yang S., Li Y., Dai L., et al. Safety and immunogenicity of a recombinant tandem-repeat dimeric RBD-based protein subunit vaccine (ZF2001) against COVID-19 in adults: two randomised, double-blind, placebo-controlled, phase 1 and 2 trials // Lancet Infect Dis. - 2021. Published Online March 24, 2021. - Режим доступа: https://doi.org/10.1016/ S1473-3099(21)00127-4.
28. Yang S., Li Y., Dai L., et al. Safety and immunogenicity of a recombinant tandem-repeat dimeric RBD-based protein subunit vaccine (ZF2001) against COVID-19 in adults: two randomised, double-blind, placebo-controlled, phase 1 and 2 trials // Lancet Infect Dis. - 2021. Published Online March 24, 2021. - Режим доступа: https://doi.org/10.1016/ S1473-3099(21)00127-4. 29. Yip M.S., Leung H.L., Li P.H., et al. Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS // Hong Kong Med J. - 2016. - Vol. 22, № 4. - P. 25-31.
29. Yip M.S., Leung H.L., Li P.H., et al. Antibody-dependent enhancement of SARS coronavirus infection and its role in the pathogenesis of SARS // Hong Kong Med J. - 2016. - Vol. 22, № 4. - P. 25-31. 30. Zhang Y., Zeng G., Pan H., et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. // Lancet Infect Dis. - 2021. - Vol. 21. - P. 181-192. - Режим доступа: https://www.thelancet.com/article/S1473-3099(20)30843-4/fulltext.
30. Zhang Y., Zeng G., Pan H., et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. // Lancet Infect Dis. - 2021. - Vol. 21. - P. 181-192. - Режим доступа: https://www.thelancet.com/article/S1473-3099(20)30843-4/fulltext. 31. Zhu Feng-Cai, Guan Xu-Hua, Li Yu-Hua, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo controlled, phase 2 trial // Lancet. - 2020. - Vol. 396. - P. 479-88. Published Online July 20, 2020. - Режим доступа: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31605-6/fulltext.
31. Zhu Feng-Cai, Guan Xu-Hua, Li Yu-Hua, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo controlled, phase 2 trial // Lancet. - 2020. - Vol. 396. - P. 479-88. Published Online July 20, 2020. - Режим доступа: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31605-6/fulltext.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Результаты и обсуждение |
 |
Литература |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»