2022 год № 1
Клиническая медицина
1albina1228@yandex.ru
2larevanv@mail.ru
3tsvinger_s_m@mail.ru
Аннотация:
Ключевые слова:
1albina1228@yandex.ru
2larevanv@mail.ru
3tsvinger_s_m@mail.ru
2larevanv@mail.ru
3tsvinger_s_m@mail.ru
Abstract:
Key words:
Введение |
 |
 |
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) в настоящее время является одним из наиболее распространенных заболеваний органов пищеварения и характеризуется существенным снижением качества жизни и работоспособности [1]. Согласно современным представлениям, развитие ГЭРБ обусловлено двумя основными механизмами: патологическим гастроэзофагеальным рефлюксом и недостаточностю запирательного механизма кардии [4]. Кислое содержимое желудка, а также желчные кислоты и ферменты из двенадцатиперстной кишки в результате дуоденогастроэзофагеального рефлюкса достигают слизистой оболочки пищевода. Несостоятельность кардии приводит к снижению пищеводного клиренса и уменьшению резистентности слизистой оболочки пищевода. Реакция пациента на заброс в пищевод желудочного и/или дуоденального содержимого является результатом передачи сенсорных сигналов. Ключевым модулятором сигналинга служат гетеротримерные гуанин-нуклеотидсвязывающие белки (G-белки, GPCR) и сопряженные с ними каннабиноидные рецепторы двух типов [15]. Вследствие частого и длительного контакта рефлюксата со слизистой оболочкой развиваются воспалительные изменения, эрозии и язвы. Воспалительный процесс в слизистой пищевода протекает с обязательным участием провоспалительных медиаторов, и в первую очередь - интерлейкина-1 (ИЛ-1β), интерлейкина-10 (ИЛ-10) и интерлейкина-12 (ИЛ-12β) [3]. Реализации вышеописанных механизмов способствует ряд внешних и внутренних факторов, таких как стресс, ожирение, курение, прием некоторых лекарственных препаратов, наличие хронической инфекции [1]. В настоящее время активно изучается генетическая обусловленность ГЭРБ [16]. В связи с этим представляется целесообразным проведение генетического исследования с определением полиморфных вариантов генов GPCR, ИЛ-1β, ИЛ-10 и ИЛ-12β у пациентов с ГЭРБ.
Цель исследования - оценка прогностической роли полиморфизмов генов ИЛ-1β, ИЛ-10, ИЛ-12β и GNBβ3 в развитии ГЭРБ у жителей Забайкальского края.
Материалы и методы
|
 |
 |
В исследование включено 139 человек, из них 79 пациентов с ГЭРБ (30 мужчин и 49 женщин) и 60 лиц группы контроля (28 мужчин и 32 женщины), медиана и межквартильный интервал возраста составили 43 (33; 57) и 44 (37; 54) лет, соответственно. Группы были сопоставимы по половому и возрастному признаку. Диагноз "ГЭРБ" устанавливался с учетом данных опросника GerdQ (клинически значимым считали 8 и более баллов) и/или наличия изменений слизистой оболочки пищевода при проведении эндоскопического исследования верхних отделов желудочно-кишечного тракта и/или выявлении патологических кислых, слабокислых или слабощелочных рефлюксов при 24-часовой рН-импедансометрии. С целью выявления грыжи пищеводного отверстия диафрагмы (ГПОД) пациентам проводилось рентгеноскопия пищевода и желудка.
Контрольную группу составили лица, не имеющие клинических и инструментальных признаков ГЭРБ, без тяжелой сопутствующей патологии, которые были охарактеризованы как практически здоровые.
Все респонденты, принявшие участие в исследовании, заполняли дополнительный опросник с указанием этнической принадлежности и охарактеризовали себя как европеоиды, проживающие на территории Забайкальского края не менее трех поколений. Дополнительно у пациентов с ГЭРБ оценивалась частота употребления алкоголя и кофе, наличие факта курения. При проведении опроса о частоте употребления алкоголя были приняты за единицу алкоголя 200 мл вина, 500 мл пива, 50 г водки не реже 1 раза в 2 недели [1]. Регулярный прием кофе признан у респондентов, употребляющих напиток ежедневно. Регулярно курящими считались лица, выкурившие не менее 1 сигареты в день на протяжении 30 дней, предшествующих опросу.
Участники перед проведением исследования подписали информированное добровольное согласие.
С целью проведения генетического исследования выполнялся забор венозной крови, в полученных образцах определялись полиморфные варианты генов ИЛ-1β в положении Т511С и Т31С, бета 3-субъединицы G-белка (GNBβ3) С825Т, ИЛ-10 G1082A и ИЛ-12β А1188С. Генотипирование полиморфных локусов осуществляли методом полимеразной цепной реакции. Материалом для генетического анализа служили образцы ДНК, выделенные из лейкоцитов периферической венозной крови. Визуализация продуктов амплификации выполнена с помощью электрофореза в 3 % агарном геле с добавлением бромистого этидия с ультрафиолетовой детекцией. В работе использовались стандартные наборы для исследуемых SNP научно-производственной фирмы "Литех" (Москва).
Генетические исследования выполнены на базе лаборатории молекулярной генетики Научно-исследовательского института Молекулярной медицины ФГБОУ ВО "Читинской государственной медицинской академии" Министерства здравоохранения РФ.
Статистическая обработка проводилась согласно принципам Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациям "Статистический анализ и методы в публикуемой литературе (SAMPL). Нормальность распределения признака оценивали с использованием критерия Шапиро-Уилка. Во всех случаях гипотеза о нормальности отвергалась, в связи с чем, результаты представлены в виде медианы и интерквартильного интервала (Me (25 %; 75 %)). Для сравнения значений численных характеристик групп использовали критерий Манна-Уитни. Значимость различий распределения генотипов оценивали с использованием критерия χ-квадрат Пирсона (χ2), отношения шансов с учетом 95 % доверительного интервала (95 % ДИ). Значения p<0,05 считали статистически значимыми во всех случаях. Связь с независимыми переменными (факторами риска) оценивали при помощи бинарной логистической регрессии. Диагностическая ценность разработанной модели определена путем построения ROC-кривой с последующим определением площади под ней. Статическую обработку данных, осуществляли с помощью пакета компьютерных программ "IBM SPSS Statistics Version 25.0" (International Business Machines Cation, license No. Z125-3301-14, США) [2, 3, 14].
Оценка отклонения распределений генотипов изученного полиморфного локуса от распределения Харди-Вайнберга проводилась с использованием модифицированного критерия χ-квадрат Пирсона. В расчетах использована онлайн-программа "Hardy-Weinberg equilibrium calculator".
В работе соблюдались этические принципы Хельсинской декларации. Проведение исследования было одобрено локальным этическим комитетом при ФГБОУ ВО "Читинская государственная медицинская академия", г. Чита, протокол № 83, от 22.10.2016 г.
Результаты и обсуждение
|
 |
 |
Распределение частот полиморфизма генов Т31С ИЛ-1β и Т511С ИЛ-1β, G1082A ИЛ-10, А1188С ИЛ-12β и С825Т GNBβ3 в изучаемых группах соответствовало закону Харди-Вайнберга, р>0,05.
При изучении генотипов полиморфных локусов ИЛ-1β у пациентов с ГЭРБ и в группе контроля установлено, что генотип С31Т ИЛ-1β чаще наблюдался у практически здоровых лиц (OR=0,302 ДИ 95 % 0,088-1,034), в то время как распространение полиморфного локуса Т511С ИЛ-1β не отличалось в изучаемых группах. Генотип G1082G ИЛ10 чаще встречался в контрольной группе (OR=0,379 ДИ 95 % 0,190-0,759), в отличие от генотипа А1082А (OR=9,189 ДИ 95 % 2,050-41,195). При изучении полиморфных локусов А1188С ИЛ-12β и С825Т GNBβ3 не установлено статистически значимых различий в распространенности генотипов между группами пациентов с ГЭРБ и контролем. Таким образом, значимых ассоциаций частоты ГЭРБ с изучаемыми полиморфизмами обнаружено не было (табл. 1).
| Генотипы | Пациенты с ГЭРБ n (%) | Контрольная группа n (%) | р |
|---|---|---|---|
| ИЛ-1β (Т31С) | |||
| Т/Т | 35 (44) | 27 (45) | 0,938 |
| Т/С | 40 (51) | 24 (40) | 0,213 |
| С/С | 4 (5) | 9 (15) | 0,046 |
| ИЛ-1β (Т511С) | |||
| Т/Т | 16 (20) | 8 (13) | 0,494 |
| Т/С | 34 (43) | 30 (50) | 0,383 |
| С/С | 29 (37) | 22 (37) | 0,201 |
| ИЛ-10 (G1082A) | |||
| G/G | 35 (44) | 41 (67) | 0,006 |
| G/A | 25 (32) | 17 (30) | 0,753 |
| A/A | 19 (24) | 2 (3) | 0,0008 |
| ИЛ-12 (А1188С) | |||
| А/А | 42 (52) | 37 (61) | 0,334 |
| А/С | 34 (44) | 22 (37) | 0,469 |
| С/С | 3 (4) | 1 (2) | 0,455 |
| GNBβ3 (С825Т) | |||
| С/С | 50 (63) | 31 (52) | 0,251 |
| С/Т | 19 (24) | 20 (34) | 0,238 |
| Т/Т | 10 (13) | 8 (14) | 0,922 |
Примечание. n - количество пациентов, р - уровень статистической значимости.
Для определения независимых факторов риска развития ГЭРБ проведен бинарный логистический регрессионный анализ. Наряду с изучаемыми генетическими маркерами в модели рассматривались известные традиционные факторы риска развития рефлюкса, такие как ожирение, курение, употребление кофе, алкоголя. По данным анализа установлено, что полиморфизмы генов ИЛ-10 (G1082A) и GNBβ3 (C825T) способны выступать как дополнительные факторы риска развития ГЭРБ (табл. 2). Значение данных факторов были включены в уравнение логистической регрессии. Следует отметить, что при добавлении в формулу логистической регрессии значения полиморфных генотипов ИЛ-1β (Т31С), ИЛ-1β (Т511С) и ИЛ-12β (А1188С), площадь подкривой увеличивалась с 0,630 до 0,71, р менее 0,001.
| Показатель | beta | Среднеквадратичная ошибка | Р |
|---|---|---|---|
| ИЛ-10 (G1082A) | 1,609 | 0,451 | менее 0,0001 |
| GNBβ3 (С825Т) | -0,965 | 0,422 | 0,022 |
| ИЛ-1β (Т31С) | -0,593 | 0,409 | 0,147 |
| ИЛ-1β (Т511С) | -0,420 | 0,381 | 0,270 |
| ИЛ-12β (А1188С) | 0,499 | 0,431 | 0,247 |
| Константа | 1,027 | 0,705 | 0,145 |
Разработанная модель прогнозирования развития гастроэзофагеальной рефлюксной болезни отражена в уравнении логистической регрессии:
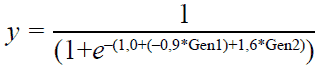 ,
,
где: y - значение зависимой переменной, e - основание натурального логарифма (2,72); 1,0 - значение константы логистической регрессии; -0,9, 1,6 - нестандартизованные коэффициенты beta; Gen1 - полиморфные варианты гена GNB β3 (C825T), Gen2 - полиморфные варианты гена ИЛ-10 (G1082A).
Данная модель обладает хорошей прогностической значимостью (AUC=0,711, 95 % ДИ 0,620-0,802, p<0,0001; стандартная ошибка 0,046) (рисунок).
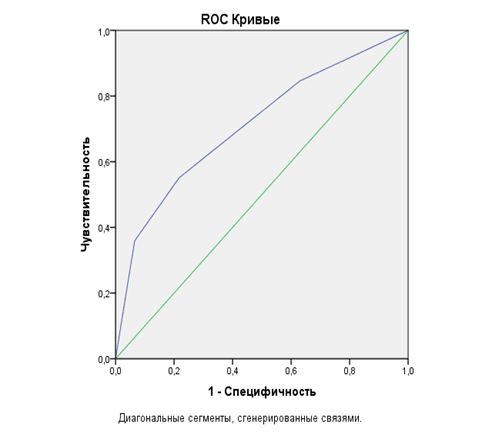
Рис. 1. ROC-кривая модели прогнозирования развития гастроэзофагеальной рефлюксной болезни у жителей Забайкальскго края
Известно, что повышение сывороточного уровня ИЛ-1β прямо коррелирует с частотой рефлюксов и рецидивами ГЭРБ [11]. Впервые роль полиморфного локуса Т511С ИЛ-1β в развитии ГЭРБ была описана Koivurova, et al. в 2003 году. Авторами установлено, что генотип Т511Т ИЛ-1β чаще регистрировался у пациентов с эзофагитом, по сравнению с группой контроля, однако данные не достигли статистически значимых различий [13]. Позже в ряде исследований было показано, что аллель ИЛ-1β 511Т и генотип Т511Т ассоциированы с низким риском развития ГЭРБ [5, 6, 7]. В метаанализе, проведенном на восьми исследованиях, со 1119 пациентами с ГЭРБ не выявлено определенных ассоциаций между полиморфизмом генов ИЛ-1β С511Т и риском развития заболевания [20]. В нашем исследовании мы не получили различий в распространенности полиморфного локуса С511Т ИЛ-1β, равно как и не получили статистически значимых показателей при проведении регрессионного анализа, однако чувствительность и специфичность прогностической модели возрастала при учете данного полиморфного локуса.
Изучение полиморфного локуса С31Т ИЛ-1β показало, что генотип С31С ИЛ-1β чаще наблюдается у лиц без признаков ГЭРБ [17]. Мы получили аналогичные данные.
Имеются единичные публикации, посвященные изучению роли полиморфизма генов ИЛ-10 у пациентов с ГЭРБ. Учеными из Индии (2008 г.) установлено, что генотип А1082А ИЛ-10 является потенциальным фактором риска развития заболевания и его осложнений [8]. В нашем исследовании данный полиморфизм также показал хорошую статистическую значимость в виде фактора риска развития заболевания и был включен в модель прогнозирования.
Роль полиморфизма гена А1188С ИЛ-β12 в литературе описывается как предиктор развития онкологического процесса, и обсуждается возможность его использования в виде биомаркера рака пищевода [18, 19]. В нашем исследовании мы не получили статистически значимых различий в распространенности полиморфных вариантов данного генотипа между пациентами с ГЭРБ и контролем.
Обсуждается роль повышенной передачи сенсорных сигналов как механизма развития симптомов ГЭРБ [9]. Гетеротримерные гуанин-нуклеотидсвязывающие белки (G-белки) служат для передачи сигналов от обширного набора рецепторов к эффекторным системам, включая ионные каналы и ферменты, которые изменяют скорость производства, высвобождения или деградации внутриклеточных вторичных мессенджеров [10]. Теоретической предпосылкой роли полиморфизма гена GNВβ3 825 С/Т стало предположение, что висцеральная гиперчувствительность участвует в формировании симптомов рефлюкса. Рецепторы, способные связываться с G-белком, опосредуют реакцию на кислоту, нейротрансмиттеры и гуморальные факторы, модулирующие сенсорную функцию пищевода [12]. В исследовании D.R. de Vries и соавт. (2009 г.), в котором приняло участие 363 пациента с ГЭРБ и 373 респондента группы контроля, было показано, что генотип С/Т был более распространен у пациентов с ГЭРБ по сравнению с группой контроля, аллель 825Т ассоциировался с повышенным восприятием рефлюкса. Связь аллеля 825Т с симптомами заболевания была показана и в более поздней работе, однако генетическая изменчивость GNBβ3 не зависела от уровня кислотности в пищеводе [1]. В нашем исследовании генотип Т825С GNB3β являлся предиктором развития заболевания и был включен в модель прогнозирования.
Таким образом, согласно полученной модели прогнозирования, генотипы G1082A ИЛ-10 и С825Т GNB3β могут быть рассмотрены как дополнительные предикторы развития заболевания у жителей Забайкальского края. Данный факт свидетельствует о необходимости продолжать исследования в этом направлении.
Список источников |
 |
 1. Лазебник Л.Б., Машарова А.А., Бордин Д.С., Васильев Ю.В., Ткаченко Е.И., Абдулхаков Р.А., Бутов М.А., Еремина Е.Ю., Зинчук Л.И., Цуканов В.В. Результаты многоцентрового исследования "Эпидемиология гастроэзофагеальной рефлюксной болезни в России" (МЭГРЕ) // Терапевтический архив. - 2011. - № 1. - С. 38-41.
1. Лазебник Л.Б., Машарова А.А., Бордин Д.С., Васильев Ю.В., Ткаченко Е.И., Абдулхаков Р.А., Бутов М.А., Еремина Е.Ю., Зинчук Л.И., Цуканов В.В. Результаты многоцентрового исследования "Эпидемиология гастроэзофагеальной рефлюксной болезни в России" (МЭГРЕ) // Терапевтический архив. - 2011. - № 1. - С. 38-41.  2. Мудров В.А. Алгоритмы статистического анализа качественных признаков в биомедицинских исследованиях с помощью пакета программ SPSS // Забайкальский медицинский вестник. - 2020. - № 1. - С. 151-163.
2. Мудров В.А. Алгоритмы статистического анализа качественных признаков в биомедицинских исследованиях с помощью пакета программ SPSS // Забайкальский медицинский вестник. - 2020. - № 1. - С. 151-163.  3. Мудров В.А. Алгоритмы регрессионного анализа в биомедицинских исследованиях с помощью пакета программ SPSS // Забайкальский медицинский вестник. - 2020. - № 2. - С. 177-190.
3. Мудров В.А. Алгоритмы регрессионного анализа в биомедицинских исследованиях с помощью пакета программ SPSS // Забайкальский медицинский вестник. - 2020. - № 2. - С. 177-190.  4. Старостин Б.Д. Современные подходы к лечению гастроэзофагеальной рефлюксной болезни. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2019. - № 29 (1). - Р. 7-16. https://doi.org/10.22416/1382-4376-2019-29-1-7-16.
4. Старостин Б.Д. Современные подходы к лечению гастроэзофагеальной рефлюксной болезни. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2019. - № 29 (1). - Р. 7-16. https://doi.org/10.22416/1382-4376-2019-29-1-7-16. 5. Akçil G., Doğan M., Cengiz M., Engin E.D., Doğan M., Ünal S., et al. The role of interleukin-1 gene polymorphisms and Helicobacter pylori in gastroesophageal reflux disease // Turk J Gastroenterol. - 2014. - № 25 (1). - Р. 81-85.
5. Akçil G., Doğan M., Cengiz M., Engin E.D., Doğan M., Ünal S., et al. The role of interleukin-1 gene polymorphisms and Helicobacter pylori in gastroesophageal reflux disease // Turk J Gastroenterol. - 2014. - № 25 (1). - Р. 81-85. 6. Ando T., El-Omar E.M., Goto Y., Nobata K., Watanabe O., Maeda O., et al. Interleukin 1B proinflammatory genotypes protect against gastro-oesophageal reflux disease through induction of corpus atrophy // Gut. - 2006. - № 55 (2). - Р. 158-164.
6. Ando T., El-Omar E.M., Goto Y., Nobata K., Watanabe O., Maeda O., et al. Interleukin 1B proinflammatory genotypes protect against gastro-oesophageal reflux disease through induction of corpus atrophy // Gut. - 2006. - № 55 (2). - Р. 158-164. 7. Chourasia D., Ghoshal U.C. Pathogenesis of gastro-oesophageal reflux disease: what role do Helicobacter pylori and host genetic factors play? // Trop Gastroenterol. - 2008. - № 29 (1). - Р. 13-19.
7. Chourasia D., Ghoshal U.C. Pathogenesis of gastro-oesophageal reflux disease: what role do Helicobacter pylori and host genetic factors play? // Trop Gastroenterol. - 2008. - № 29 (1). - Р. 13-19. 8. Chourasia D., Achyut B.R., Tripathi S., Mittal B., Mittal R.D., Ghoshal U.C. Genotypic and functional roles of IL-1B and IL-1RN on the risk of gastroesophageal reflux disease: The presence of IL-1B511*T/IL-1RN*1 (T1) haplotype may protect against the disease // Am J Gastroenterol. - 2009. - № 104 (11). - Р. 2704-2713.
8. Chourasia D., Achyut B.R., Tripathi S., Mittal B., Mittal R.D., Ghoshal U.C. Genotypic and functional roles of IL-1B and IL-1RN on the risk of gastroesophageal reflux disease: The presence of IL-1B511*T/IL-1RN*1 (T1) haplotype may protect against the disease // Am J Gastroenterol. - 2009. - № 104 (11). - Р. 2704-2713. 9. De Vries D.R., Ter Linde J.J., Van Herwaarden M.A., et al. Gastroesophageal reflux disease is associated with the C825T polymorphism in the G-protein beta3 subunit gene (GNB3) // Am J Gastroenterol. - 2009. - № 104 (2). - Р. 281-5. doi: 10.1038/ajg.2008.139.
9. De Vries D.R., Ter Linde J.J., Van Herwaarden M.A., et al. Gastroesophageal reflux disease is associated with the C825T polymorphism in the G-protein beta3 subunit gene (GNB3) // Am J Gastroenterol. - 2009. - № 104 (2). - Р. 281-5. doi: 10.1038/ajg.2008.139. 10. Hollmann M.W., Strumper D., Herroeder S., et al. Receptors, G proteins, and their interactions // Anesthesiology. - 2005. - № 103 (5). - Р. 1066-78. doi: 10.1097/00000542-200511000-00022.
10. Hollmann M.W., Strumper D., Herroeder S., et al. Receptors, G proteins, and their interactions // Anesthesiology. - 2005. - № 103 (5). - Р. 1066-78. doi: 10.1097/00000542-200511000-00022. 11. Isomoto H., Wang A.P., Nishi Y., Matsumoto A., Shikuwa S., Mizuta Y., et al. Interleukin 8 and 1 beta and RANTES levels in esophageal mucosa predict recurrence of endoscopynegative gastroesophageal reflux disease // Hepato-gastroenterol. - 2008. - № 55 (82-83). - Р. 482-485.
11. Isomoto H., Wang A.P., Nishi Y., Matsumoto A., Shikuwa S., Mizuta Y., et al. Interleukin 8 and 1 beta and RANTES levels in esophageal mucosa predict recurrence of endoscopynegative gastroesophageal reflux disease // Hepato-gastroenterol. - 2008. - № 55 (82-83). - Р. 482-485. 12. Jiang D., Huang D., Cai W., et al. G protein beta 3(GNβ3) C825T polymorphism and irritable bowel syndrome susceptibility: an updated meta-analysis based on eleven case-control studies // Oncotarget. - 2017. - №9 (2). - Р. 2770-2781. doi: 10.18632/oncotarget.23449.
12. Jiang D., Huang D., Cai W., et al. G protein beta 3(GNβ3) C825T polymorphism and irritable bowel syndrome susceptibility: an updated meta-analysis based on eleven case-control studies // Oncotarget. - 2017. - №9 (2). - Р. 2770-2781. doi: 10.18632/oncotarget.23449. 13. Koivurova O.P., Karhukorpi J.M.J., Joensuu E.T., Koistinen P.O., Valtonen J.M., Karttunen T.J., et al. IL-1 RN 2/2 genotype and simultaneous carriage of genotypes IL-1 RN 2/2 and IL-1 beta-511 T/T associated with oesophagitis in Helicobacter pylori-negative patients // Scand J Gastroenterol. - 2003. - № 38 (12). - Р. 1217-1222.
13. Koivurova O.P., Karhukorpi J.M.J., Joensuu E.T., Koistinen P.O., Valtonen J.M., Karttunen T.J., et al. IL-1 RN 2/2 genotype and simultaneous carriage of genotypes IL-1 RN 2/2 and IL-1 beta-511 T/T associated with oesophagitis in Helicobacter pylori-negative patients // Scand J Gastroenterol. - 2003. - № 38 (12). - Р. 1217-1222. 14. Lang T.A., Altman D.G. Basic statistical reporting for articles published in biomedical journals: the "Statistical Analyses and Methods in the Published Literature" or the SAMPL Guidelines // International journal of nursing studies advances // 2015. - № 52 (1). - Р. 5-9. https://doi.org/10.1016/j.ijnurstu.2014.09.006.
14. Lang T.A., Altman D.G. Basic statistical reporting for articles published in biomedical journals: the "Statistical Analyses and Methods in the Published Literature" or the SAMPL Guidelines // International journal of nursing studies advances // 2015. - № 52 (1). - Р. 5-9. https://doi.org/10.1016/j.ijnurstu.2014.09.006. 15. Lee Y., Jo J., Chung H.Y., Pothoulakis C., Im E. Endocannabinoids in the gastrointestinal tract // Am J Physiol Gastrointest Liver Physiol. - 2016 Oct 1;311(4):G655-G666. doi: 10.1152/ajpgi.00294.2015. Epub 2016 Aug 18. PMID: 27538961.
15. Lee Y., Jo J., Chung H.Y., Pothoulakis C., Im E. Endocannabinoids in the gastrointestinal tract // Am J Physiol Gastrointest Liver Physiol. - 2016 Oct 1;311(4):G655-G666. doi: 10.1152/ajpgi.00294.2015. Epub 2016 Aug 18. PMID: 27538961. 16. Patel A., Hasak S., Nix B.D., et al. Genetic risk factors for perception of symptoms in GERD: an observational cohort study // Aliment Pharmacol Ther. - 2018. - № 47 (2). - Р. 289-297. doi: 10.1111/apt.14414.
16. Patel A., Hasak S., Nix B.D., et al. Genetic risk factors for perception of symptoms in GERD: an observational cohort study // Aliment Pharmacol Ther. - 2018. - № 47 (2). - Р. 289-297. doi: 10.1111/apt.14414. 17. Queiroz D.M., Guerra J.B., Rocha G.A., Rocha A.M., Santos A., De Oliveira A.G., et al. IL1B and IL1RN polymorphic genes and Helicobacter pylori cagA strains decrease the risk of reflux esophagitis // Gastroenterol. - 2004. - № 127 (1). - Р. 73-79.
17. Queiroz D.M., Guerra J.B., Rocha G.A., Rocha A.M., Santos A., De Oliveira A.G., et al. IL1B and IL1RN polymorphic genes and Helicobacter pylori cagA strains decrease the risk of reflux esophagitis // Gastroenterol. - 2004. - № 127 (1). - Р. 73-79. 18. Shi X., Jia Y., Xie X., Li S. Single-nucleotide polymorphisms of the IL-12 gene lead to a higher cancer risk: a meta-analysis based on 22,670 subjects // Genes Genet Syst. - 2018. Feb. - № 10; 92 (4). - Р. 173-187. https://doi.org/10.1266/ggs.16-00024.
18. Shi X., Jia Y., Xie X., Li S. Single-nucleotide polymorphisms of the IL-12 gene lead to a higher cancer risk: a meta-analysis based on 22,670 subjects // Genes Genet Syst. - 2018. Feb. - № 10; 92 (4). - Р. 173-187. https://doi.org/10.1266/ggs.16-00024. 19. Tao Y.P., Wang W.L., Li S.Y., Zhang J., Shi Q.Z., Zhao F., Zhao B.S. Associations between polymorphisms in IL-12A, IL-12B, IL-12Rβ1, IL-27 gene and serum levels of IL-12p40, IL-27p28 with esophageal cancer // J Cancer Res Clin Oncol. - 2012. Nov. - № 138 (11). - Р. 1891-900. https://doi.org/10.1007/s00432-012-1269-0.
19. Tao Y.P., Wang W.L., Li S.Y., Zhang J., Shi Q.Z., Zhao F., Zhao B.S. Associations between polymorphisms in IL-12A, IL-12B, IL-12Rβ1, IL-27 gene and serum levels of IL-12p40, IL-27p28 with esophageal cancer // J Cancer Res Clin Oncol. - 2012. Nov. - № 138 (11). - Р. 1891-900. https://doi.org/10.1007/s00432-012-1269-0. 20. Xue M.M., Li J., Li W., Wang D.X. Association of interleukin-1B gene polymorphisms at site 511 with gastroesophageal reflux disease: A meta-analysis // Esophagus. - 2016. - № 13 (1). - Р. 74-9.
20. Xue M.M., Li J., Li W., Wang D.X. Association of interleukin-1B gene polymorphisms at site 511 with gastroesophageal reflux disease: A meta-analysis // Esophagus. - 2016. - № 13 (1). - Р. 74-9.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

