2022 год № 2
Обзоры литературы
Аннотация:
Ключевые слова:
Abstract:
Key words:
Введение |
 |
 |
Непрерывный рост случаев туберкулёза с множественной лекарственной устойчивостью (МЛУ-ТБ; устойчивость к изониазиду и рифампицину) является серьезной проблемой для глобального здравоохранения. Лечение МЛУ-ТБ более токсично для пациента, менее эффективно (зарегистрированный в 2019 г. глобальный показатель успешного исхода терапии составляет всего 56 %) и несёт гораздо более высокую экономическую нагрузку на пациентов и систему здравоохранения, что ставит под угрозу усилия по борьбе с ТБ как в развитых, так и в развивающихся странах [77].
Возникновение лекарственно-устойчивого туберкулёза (ЛУ-ТБ) определяется не только своевременной правильной диагностикой, адекватным применением противотуберкулёзных препаратов и комплаенсом пациента, но и микробиологическими факторами [45]. В виду того, что мутации, обеспечивающие резистентность микобактерии к Изониазиду и Рифампицину, могут возникать спонтанно, комбинация нескольких противотуберкулёзных препаратов является обязательной для минимизации риска развития лекарственной устойчивости. Хотя комбинация антибиотиков при лечении ТБ может в некоторой степени предотвратить приобретённую лекарственную устойчивость, универсального решения проблемы приобретённой лекарственной устойчивости так и не найдено. [62].
В 2015 г. ВОЗ сформировало стратегию искоренения ТБ, согласно которой поставлена цель снижения заболеваемости туберкулёзом на 90 % к 2035 г. [72]. Однако, прогресс далёк от удовлетворительного, так как, несмотря на общее снижение общей заболеваемости ТБ, распространённость МЛУ/РУ-ТБ продолжает расти [12]. Более того, согласно созданным математическим моделям, тренд роста может ускориться почти в 2 раза к 2040 г. [57]. Этот эпидемический аспект является одним из главных препятствий для реализации стратегии ВОЗ. Таким образом, в клинической практике чрезвычайно важно оценивать универсальные для всей популяции факторы риска, равно как и факторы, характерные для региона проживания пациентов, чтобы можно было разработать более осуществимые и экономически эффективные глобальные и региональные подходы для контроля этой тенденции [42].
Туберкулёз во многом является социально детерминированным заболеванием, непропорционально затрагивающим развивающиеся страны [42]. Целью данного обзора является комплексная оценка демографических, социально-экономических и поведенческих факторов риска, влияющих на высокую распространённость МЛУ-ТБ в мире.
Материалы и методы
|
 |
 |
Стратегия поиска
Данное исследование является систематическим обзором факторов риска, способствующих распространенности МЛУ среди больных туберкулёзом. Стратегия заключается в поиске опубликованных исследований по выявлению факторов риска МЛУ-ТБ среди больных ТБ. Данное исследование выполнялось в соответствии с рекомендациями Preferred Reporting Items for Systematic Reviews (PRISMA) (рис. 1) [43]. Поиск производился в базе данных PubMed, с временными рамками даты публикации с 1 января 2011 по 31 декабря 2021 года. Термины поиска объединяли термины медицинских предметных рубрик (MeSH) и текстовые слова, включая "tuberculosis", "Multidrug-Resistant", "MDR TB", "risk factors", "Predictors", "Determinates". Соответственно, использовались логические операторы AND и OR. Финальный оператор, использованный для поиска - (("Tuberculosis, Multidrug-Resistant" []) OR ("MDR TB")) AND ((determinants) OR (Predictors) OR ("Risk Factors" [])). Поиск производился без языковых ограничений.
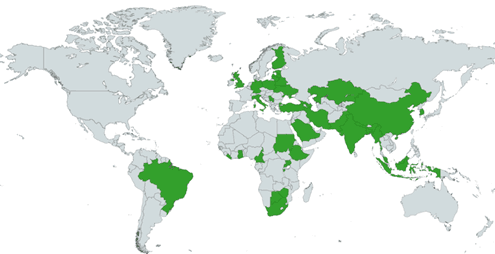
Рис. 1. Географическое распределение отобранных исследований по стране проведения
Критерии включения и исключения
Исследовательские статьи по МЛУ-ТБ, опубликованные в соответствующих временных рамках, были включены на основании наличия следующих критериев: демографические факторы риска, социально-экономические факторы риска и поведенческие факторы риска. Все исследовательские статьи и резюме, которые не соответствовали ключевым словам, а также дублированные и опубликованные в нерецензируемых журналах, были исключены из этого исследования.
Извлечение и синтез данных
Данные, извлечённые из многочисленных исследовательских статей для этого исследования, включали: авторов, страну проведения исследования, год публикации, дизайн исследования, период исследования и факторы риска, связанные с МЛУ-ТБ. Финальный список рассматриваемых факторов риска по описанным категориям формировался индуктивно из отобранных статей.
Были отобраны следующие переменные - демографические (возраст, пол, местность проживания), поведенческие характеристики (курение, злоупотребление наркотиками и алкоголем) и социально-экономические характеристики (уровень образования, занятость, уровень дохода, бездомность и история лишения свободы).
Результаты и обсуждение
|
 |
 |
Поиск литературы и выборка статей
В результате первичного поиска с использованием поискового оператора было найдено 647 статей. После проведения скрининга на предмет дубликатов статей в первичной выборке, последних обнаружено не было. В результате проверки заголовков и аннотаций, 526 статей были определены как не соответствующие теме исследования и исключены из дальнейшего анализа. Полные тексты 121 статьи были оценены на предмет соответствия критериям включения, из которых 70 статей были включены в финальный анализ, в соответствии с критериями PRISMA.
По дизайну исследования были распределены следующим образом: метаанализ - 6, систематический обзор - 6, поперечное эпидемическое исследование - 33, когортные исследования - 12, исследования случай-контроль - 13 (таблица). По территориальному признаку проведения исследования публикации были разделены на следующие регионы: СНГ - 7, Западная Европа - 4, Центральная и Восточная Европа - 3, Южная Америка - 2, Африка - 15, Юго-Восточная Азия - 25, Ближний Восток - 9. На рисунке представлено графическое распределение публикаций на карте мира. 5 публикаций использовали глобальные данные.
| Автор | Страна проведения исследования | Период исследования | Год публикации |
|---|---|---|---|
| Поперечное эпидемиологическое исследование | |||
| Alikhanova N., et al. | Азербайджан | 2012-2013 | 2019 |
| Skrahina A., et al. | Беларусь | 2010-2011 | 2013 |
| Tembo B.P., et al. | Ботсвана | 2013-2014 | 2019 |
| Lalor M.K., et al. | Великобритания | 2010-2014 | 2019 |
| Loddenkemper R., et al. | Германия | 2015-2019 | 2020 |
| Jenkins H.E., et al. | Грузия | 2009-2011 | 2014 |
| Timire C., et al. | Зимбабве | 2015-2016 | 2019 |
| Shadrach B.J., et al. | Индия | 2016-2017 | 2020 |
| Sharma S., et al. | Индия | 2013-2019 | 2020 |
| Sharma V., et al. | Индия | 2012-2014 | 2016 |
| Machmud P.B., et al. | Индонезия | 2010-2015 | 2021 |
| Salmanzadeh S., et al. | Иран | 2017 | 2020 |
| Mbuh T.P., et al. | Камерун | 2016-2017 | 2021 |
| Van den Hof S., et al. | Казахстан | 2007-2011 | 2013 |
| Lin M., et al. | Китай | 2014-2017 | 2019 |
| Ruan Q., et al. | Китай | 2009-2016 | 2021 |
| Tao N., et al. | Китай | 2004-2019 | 2021 |
| Wang W., et al. | Китай | 2008-2009 | 2011 |
| Wu B., et al. | Китай | 2010-2017 | 2019 |
| Yang S., et al. | Китай | 1999-2015 | 2020 |
| Carter B.B., et al. | Либерия | 2015 | 2021 |
| Seifert M., et al. | Мьянма | 2020 | 2021 |
| Shrestha S.K., et al. | Непал | 2018 | 2020 |
| Hameed S., et al. | Пакистан | 2011-2013 | 2019 |
| Korzeniewska M., et al. | Польша | 2013 | 2015 |
| Al-Hayani A.M., et al. | Саудовская Аравия | 2016-2020 | 2021 |
| Al-Shahrani M.S., et al. | Саудовская Аравия | 2000-2018 | 2021 |
| Sambas M.F.M.K., et al. | Саудовская Аравия | 2009-2019 | 2020 |
| Pavlenko E., et al. | Украина | 2013-2014 | 2018 |
| Toit K., et al. | Эстония | 2009-2012 | 2014 |
| Lee M., et al. | Южная Корея | 2011-2015 | 2019 |
| Метаанализ | |||
| Cai X., et al. | Китай | 1990-2013 | 2015 |
| Feng M., et al. | Китай | 2005-2016 | 2019 |
| Diriba G., et al. | Эфиопия | 2014-2020 | 2021 |
| Исследование случай-контроль | |||
| Iradukunda A., et al. | Бурунди | 2019-2020 | 2021 |
| Rifat M., et al. | Бангладеш | 2012-2013 | 2014 |
| Basingnaa A., et al. | Гана | 2016 | 2019 |
| Goel S., et al. | Индия | 2019 | 2021 |
| Sharma P., et al. | Индия | 2015-2016 | 2019 |
| Chen Y., et al. | Китай | 2013-2018 | 2021 |
| Ignatyeva O., et al. | Латвия, Литва, Эстония | 2009 | 2015 |
| Stosic M. et al. | Сербия | 2015-2017 | 2021 |
| Elduma A.H. et al. | Судан | 2017-2019 | 2019 |
| Tanrikulu A.C., et al. | Турция | 2002-2008 | 2010 |
| Kizito E., et al. | Уганда | 2016 | 2021 |
| Alene K.A., et al. | Эфиопия | 2010-2018 | 2019 |
| Mulisa G., et al. | Эфиопия | 2013-2014 | 2015 |
| Систематический обзор | |||
| Abubakar I., et al. | Великобритания | 2012 | 2012 |
| Fadaee M., et al. | Иран | 2007-2017 | 2020 |
| Scotto G., et al. | Италия | 2016 | 2017 |
| Rajendran M., et al. | Малайзия | 2009-2018 | 2020 |
| Grobler L., et al. | Южная Африка | 1991-2011 | 2016 |
| McNabb K.C., et al. | Южная Африка | 2010-2020 | 2021 |
| Когортное исследование | |||
| Arroyo L.H., et al. | Бразилия | 2006-2016 | 2020 |
| de Almeida J., et al. | Бразилия | 2006-2016 | 2021 |
| Matambo R., et al. | Зимбабве | 2010-2015 | 2021 |
| Soeroto A.Y., et al. | Индонезия | 2015-2017 | 2021 |
| Cheng Q., et al. | Китай | 2005-2019 | 2021 |
| Cheng Q., et al. | Китай | 2005-2020 | 2021 |
| Ge E., et al. | Китай | 2009-2012 | 2018 |
| Zheng X.B., et al. | Китай | 2014-2019 | 2020 |
| Saifullah A., et al. | Пакистан | 2014-2019 | 2021 |
| Al Ammari M., et al. | Саудовская Аравия | 2014-2015 | 2018 |
| Korhonen V., et al. | Финляндия | 2007-2014 | 2020 |
| Tola H., et al. | Эфиопия | 2009-2019 | 2021 |
Демографические факторы риска, ассоциированные с распространённостью МЛУ-ТБ
Возраст
Среди научного сообщества на данный момент достигнут консенсус касательно возраста старше 60 лет, который является предиктором неблагоприятного исхода терапии и повышенной смертности [37, 50, 71], равно как и возраст моложе 45 лет, который ассоциирован с положительным исходом терапии и снижением смертности [38, 64]. Однако касательно риска развития МЛУ-ТБ всё не так однозначно, и среди научных публикаций встречаются противоречивые данные. Исследования по данной тематике сообщают как о наличии корреляции между риском развития МЛУ и возрастом, так и об её отсутствии [61]. При этом, фактором риска развития МЛУ может быть как молодой возраст (младше 18 лет) [ 7,56], так и пожилой возраст [14]. Более того, граница возраста повышенного риска варьируется от 30 лет до 65 лет в различных исследованиях [14, 51, 55]. Несмотря на существующие противоречия, большинство исследователей склонны ассоциировать МЛУ именно с пожилым возрастом: так, исследователи из Саудовской Аравии пришли к выводу, что, с каждый последующим годом начиная с 43 лет, риск развития МЛУ среди больных ТБ увеличивается от 1 % до 4 % [53, 3].
Противоречивые результаты различных исследований позволяют нам сделать вывод, что возраст не является независимой детерминантой риска МЛУ-ТБ и должен рассматриваться исключительно в совокупности с другими социально-демографическими факторами. Ярким примером этого может послужить когортное исследование Chen Q., et al. [14], согласно которому, среди мужчин главную группу риска развития МЛУ составляли пациенты от 21 до 30 лет, в то время как среди женщин группа риска состояла из пациенток в возрасте 41-50 лет.
Наиболее вероятным объяснением таких противоречий служит существующая неоднородность мировой популяции: в развитых странах прогрессивное накопление сопутствующих заболеваний с возрастом увеличивает и риск развития МЛУ, в то время как в развивающихся странах недоступность медицинской помощи, бедность и персиcтирующее недоедание среди наиболее уязвимых слоев населения, таких как несовершеннолетние, делает их более подверженными заражению и развитию МЛУ-ТБ.
Пол
Исторически считается, что мужчины более подвержены развитию туберкулёза, чем женщины. В настоящее время доказано, что повышенный уровень смертности, неблагоприятный исход терапии, равно как и повышенная вероятность рецидивированния туберкулёза ассоциированы именно с мужским полом [50, 3, 40, 31]. Однако, на сегодняшний день, научное сообщество не достигло консенсуса относительно влияния пола на развитие МЛУ-ТБ.
Одни публикации сообщают об отсутствии какой-либо связи между полом и заболеваемостью МЛУ-ТБ [67, 52, 41, 68, 34], другие утверждают, что именно мужчины более подвержены развитию МЛУ [55, 19, 5], третьи же выделяют женщин как группу риска для данного вида устойчивости [59, 35, 46, 2].
Противоречивость научных публикаций требует от нас критического отношения к полу как к независимому фактору риска развития МЛУ-ТБ. На сегодня, целесообразно рассматривать пол только в совокупности с другими демографическими факторами риска, с обязательным учётом региональных особенностей проявления гендерного неравенства в повседневной жизни.
Местность проживания
Проблема высокой заболеваемости ТБ и распространённости лекарственной устойчивости среди пациентов в сельской местности актуальна для многих стран [23, 10, 60]. Сельские жители чаще всего имеют ограниченный доступ к медицинской помощи и более низкий уровень жизни, что приводит к отсроченной диагностике и неадекватному режиму терапии МЛУ-ТБ, делая возможным персистирование бактериовыделителей в популяции. Большинство публикаций, включая когортные, сплошные эпидемические исследования, исследования случай-контроль и метаанализы, сообщают, что проживание в сельской местности является значимым фактором риска развития МЛУ среди больных туберкулёзом [79, 28, 24, 78, 26].
Однако, изолированные эпидемические исследования описывают проживание в городской местности как неблагоприятный прогностический признак для развития лекарственной устойчивости у пациентов [32, 29]. Так, исследование Wang, et al. описывает значительное увеличение заболеваемости МЛУ-ТБ среди жителей городов в сравнении с трудовыми мигрантами из сельской местности [75]. Учитывая ускоряющийся общемировой тренд урбанизации, мы можем ожидать последующее увеличение распространения МЛУ в городской местности в ближайшем будущем.
Социально-экономические факторы риска, ассоциированные с распространённостью МЛУ-ТБ
Уровень образования
Низкий уровень образования увеличивает шансы индивида на заражение туберкулёзом и повышает вероятность неблагоприятного исхода терапии, как у пациентов с сохранённой чувствительностью, так и с наличием устойчивости к противотуберкулёзным препаратам [30]. Отсутствие формального образования или его низкий уровень являются значительным фактором риска развития МЛУ-ТБ, увеличивая риск наличия МЛУ от 1,6 до 5 раз в данной группе пациентов [58, 4]. К таким выводам пришли исследователи из Индии [43], Эфиопии [4], Зимбабве [69], Китая [79, 13, 80], Малайзии [48] и Ганы [9]. Помимо наличия отрицательного влияния низкого уровня образования, исследователи также сообщают, что наличие высшего образования приводит к снижению риска развития МЛУ-ТБ [69].
Наличие однородных результатов в научных публикациях из стран с различным уровнем грамотности и образованности населения показывает, что уровень образования является важной социально-экономической детерминантой, которая варьируется в силе своего влияния на риск развития МЛУ-ТБ от региона к региону, но не теряет своей статистической значимости.
Занятость и профессиональная деятельность
На сегодняшний день, хотя и имеются сообщения, что занятость не влияет на развитие лекарственной устойчивости [48], подавляющее большинство публикаций определяют безработицу как фактор риска развития МЛУ. Источники сообщают, что безработные пациенты в сравнении с занятыми имеют от 2 до 6 раз более высокие шансы развития лекарственной устойчивости [14, 66], делая их одной из главных групп риска.
Помимо занятости, фактором риска также служит и род деятельности пациента. Мы можем с относительной уверенностью судить, что пациенты, занятые неквалифицированным трудом, занимающие должности, связанные с тяжелым физическим трудом, и работники сферы здравоохранения имеют повышенный риск заболеваемости МЛУ-ТБ [58, 44, 25]. Однако, данный фактор следует интерпретировать с осторожностью, ввиду возможного наличия неочевидных причинно-следственных связей. Например, неквалифицированный труд может быть обусловлен отсутствием формального образования у пациента или же являться следствием национальной экономической турбулентности на рынке труда. Так, например, исследование Rifat M., et al. [49] определило работников сферы услуг как главную группу риска развития МЛУ-ТБ, указывая на региональные эпидемические особенности как первопричину данного результата. Хотя на первый взгляд занятость может казаться очевидным фактором риска, подобные сообщения стоит интерпретировать с разумной научной осторожностью.
Уровень дохода
Заболеваемость туберкулёзом неразрывно связана с бедностью. Все 30 стран, несущих наибольшее бремя туберкулёза, относятся к группам с низким или средним уровнем дохода населения. Хотя распространённость МЛУ среди больных туберкулёзом не полностью повторяет данный тренд [77], низкий уровень дохода всё же чётко ассоциирован с повышенным риском развития МЛУ. Стоит отметить, что данная зависимость сохраняется как для абсолютной бедности [48, 18], так и относительной бедности [8, 22, 65].
Ограниченные финансовые ресурсы сокращают доступ к своевременной диагностике и лечению туберкулёза, способствуя развитию вторичной лекарственной устойчивости даже в странах с реализованным универсальным здравоохранением. Как правило, низкий уровень дохода также сочетается с неблагоприятными бытовыми условиями и поведением, связанным с риском для здоровья, делая таких пациентов более восприимчивыми к первичному заражению или активации латентного лекарственно-устойчивого туберкулёза.
Бездомность
Бездомность является устоявшимся фактором риска заболевания туберкулёзом, равно как и развития МЛУ. Это подтверждается многочисленными эпидемиологическими исследованиями, систематическими обзорами и мета анализами [59].
Хоть заболеваемость туберкулёзом в данной группе пациентов значительно превышает таковую в общей популяции во всех регионах мира, большее внимание данной группе пациентов уделяется в развитых странах [47]. Высокая заболеваемость туберкулёзом и распространение МЛУ в развивающихся стран в совокупности с низким уровнем доходов населения отводит проблему бездомности на второй план [73]. В развитых же странах, бездомные являются одним из главных резервуаров МЛУ-ТБ в популяции. Так, в Германии, Великобритании и ряде других стран, клинические протоколы обязывают врачей проводить скрининг бездомных пациентов на предмет наличия туберкулёза независимо от причины обращения или госпитализации таких пациентов, с обязательным последующим тестированием на предмет лекарственной устойчивости при установлении диагноза ТБ [36, 33, 1].
Отсутствие жилья, распространение поведения опасного для здоровья, отсутствие финансовых ресурсов для проведения адекватной терапии делают таких пациентов более восприимчивыми к заражению и развитию МЛУ-ТБ. Таким образом, бездомность должна интерпретироваться как один из важнейших независимых социально-экономических факторов развития МЛУ у пациентов, страдающих туберкулёзом.
История заключения
Высокая распространённость туберкулеза и его лекарственно-устойчивых форм (в том числе МЛУ) наблюдается в тюрьмах по всему миру, как в развитых, так и в развивающихся странах [33, 17].
Эпидемический контроль и организация адекватной помощи больным туберкулёзом в пенитенциарной системе остаются нерешёнными задачами на региональных и глобальном уровнях. Высокая распространенность МЛУ-ТБ в местах лишения свободы обусловлена множеством факторов: плохие бытовые условия, перенаселённость, бедность рациона, пренебрежение мерами эпидемического контроля, высокая распространённость сопутствующих патологий (ВИЧ, Гепатип В, С и т. д.), отсутствие доступа к качественной медицинской помощи. Последнее, в свою очередь, ведёт к отсроченной диагностике, неадекватному режиму химиотерапии и низкому комплаенсу. Совокупность факторов создает идеальные условия для формирования МЛУ у инфицированных пациентов и дальнейшему распространению устойчивых штаммов внутри и вне мест лишения свободы [16].
Согласно результатам множества исследований, бывшие и нынешние заключенные являются важной группой риска по заражению и развитию МЛУ-ТБ [39, 6]. Это особенно актуально для развитых стран, где заключенные наравне с бездомными составляют основной резервуар МЛУ-ТБ, являясь векторами его распространения в общей популяции.
Поведенческие факторы риска, ассоциированные с распространённостью МЛУ-ТБ
Курение
Как и в случае множества респираторных заболеваний, курение значительно увеличивает риск развития и заражения МЛУ-ТБ [74]. Накопленный научный опыт показывает, что данную группу составляют как нынешние курильщики, так и некурящие пациенты со стажем курения. Публикации сообщают, что риск развития МЛУ-ТБ увеличивается у таких пациентов от 3,7 до 1,5 раз соответственно [11]. Более того, данный риск не зависит от способа доставки никотина в организм. Например, исследование Elduma A.H., et al. выявило, что вопреки распространённому заблуждению о меньшей вреде курения кальяна, данный способ доставки никотина также увеличивает риск развития МЛУ-ТБ в 3,2 раза в сравнении с некурящими пациентами [20].
Алкоголизм и наркомания
Другими поведенческими факторами, ассоциированными с МЛУ-ТБ, являются алкоголизм и наркомания [48, 21]. Данные переменные во многих случаях ассоциированы с другими социально-экономическими детерминантами, однако множество публикаций выделяют их как независимые факторы риска развития и заражения МЛУ-ТБ [18, 27].
Алкоголизм и наркомания оказывают токсическое действие на организм, делая таких пациентов более восприимчивыми к заражению лекарственно-устойчивыми штаммами ТБ [70]. Также эти факторы - самостоятельно и через ассоциированное с ними опасное для здоровья поведение - способствуют развитию сочетанной патологии (цирроз печени, ВИЧ-инфекция, вирусные гепатиты, ЗППП и т. д.), увеличивая риск реактивации латентного туберкулёза и последующему развитию МЛУ [63, 54]. В числовых выражениях публикации сообщают, что упомянутые зависимости увеличивают риск развития МЛУ-ТБ от 1,5 до 2,5 раз [18, 63].
Многочисленные и разнообразные по дизайну исследования уверенно ассоциируют социально-экономические факторы риска (низкий уровень дохода, образования, бездомность, занятость и историю заключения) с туберкулёзом. Хотя потенциально любой человек может заразиться туберкулёзом, совокупный научный опыт, в первую очередь, ассоциирует заболеваемость данной инфекцией с маргинализированными и незащищёнными слоями населения. Это относится как к общей заболеваемости, так и к распространённости лекарственной устойчивости в данных группах [47].
Распространение МЛУ среди пациентов неразрывно связано с бедностью. Для развивающихся стран это чаще всего означает абсолютную бедность, в развитых же странах связь сохраняется, но уже подразумевает под собой относительную бедность [22]. Наравне с низким уровнем дохода, низкий уровень образования, бездомность и безработица также показали сильную ассоциацию с повышенной распространённостью МЛУ среди пациентов. Потенциально все вышеперечисленные факторы могут быть как зависимыми, так и независимым факторами риска, образуя большую вероятность конфаундинга при их анализе. Учитывая данную возможность, мы можем сделать более широкие выводы. А именно, что данные факторы риска могут применяться на разных уровнях организации борьбы с МЛУ-ТБ.
В развивающихся странах с низким и средним уровнем дохода населения одни лишь противоэпидемические меры не смогут значительно снизить распространенность МЛУ-ТБ. Наравне с развитием здравоохранения и правильной организации помощи, в таких странах необходимо решать глобальные экономические проблемы, чтобы достичь значительного снижения заболеваемости и развития МЛУ-ТБ. В развитых же странах основное внимание должно быть сосредоточено на группах риска, с усилением эпидемического контроля за группами населения, разделяющих вышеописанные факторы риска [1].
Следует отдельно обозначить распространённость МЛУ-ТБ в местах лишения свободы, которая значительно превышает таковую в общей популяции [39]. Совокупность условий содержания и ограниченного доступа к медицинской помощи создаёт идеальные условия для формирования МЛУ у инфицированных пациентов и дальнейшему распространению устойчивых штаммов внутри исправительных учреждений. Это делает историю заключения одним из важнейших факторов риска развития МЛУ-ТБ, так как бывшие заключенные становятся векторами распространения МЛУ-ТБ в общей популяции [16]. Таким образом, имеется необходимость в снижении общего числа заключенных в целях снижения пула потенциальных носителей МЛУ-ТБ, наравне с необходимостью улучшения качества медицинской помощи и усиления эпидемического надзора в пенитенциарных учреждениях. Такие меры позволят предотвратить первичное заражение заключенных и обеспечить своевременную диагностику и адекватное лечение таких пациентов.
Поведенческие факторы, такие как алкоголизм, наркомания и курение, увеличивают риск развития МЛУ-ТБ до 4 раз [11]. Данные факторы риска увеличивают восприимчивость организма к заражению и развитию не только МЛУ-ТБ, но и других ассоциированных состояний (ВИЧ, ХОБЛ, вирусные гепатиты и тд.), которые в свою очередь ещё больше увеличивают риск развития лекарственной устойчивости. Данные факторы риска сохраняют возможность конфаундинга, например, они могут быть следствием социально-экономического неблагополучия человека. Однако, подавляющее большинство исследований доказывает, что подобное поведение является независимым и значимым фактором риска развития и заражения МЛУ-ТБ.
Влияние на распространенность МЛУ-ТБ выявленных демографических факторов риска, по большей части, остаётся неопределённым. Большое количество публикаций сообщает противоречивые данные о влиянии возраста и пола на развитие и заражение МЛУ-ТБ [67, 19, 59]. Сохраняющееся гендерное, экономическое и бытовое неравенство может служить косвенным объяснением данного явления [76]. Это обязывает нас соблюдать предельную осторожность в формировании выводов касательно данных факторов риска и делает необходимым дальнейшие исследования данного вопроса.
Касательно местности проживания большинство публикаций склоняются к выводу о негативном влиянии проживания в сельской местности на распространенность МЛУ-ТБ в популяции [10]. Это может быть следствием экономического разрыва городской и сельской местности, равно как и независимым фактором риска. Однако, общемировой темп урбанизации диктует необходимость в динамическом изучении данного фактора риска из-за потенциального изменения влияния местности проживания на распространённость МЛУ-ТБ [75].
На сегодняшний день МЛУ-ТБ остается актуальной проблемой общественного здравоохранения в мире. Дальнейший рост распространённости МЛУ-ТБ приведёт к катастрофическим последствиям мирового масштаба, и изучение факторов риска является важным звеном для формирования эффективных противоэпидемических программ.
В большинстве исследований, которые использовались для этого систематического обзора, сообщалось, что социально-экономические факторы риска и поведенческие факторы риска способствуют более высокой распространенности (МЛУ-ТБ). В то же время, роль таких демографических факторов, как возраст и пол, остаётся неоднозначной.
Основываясь на результатах этого исследования, такие подфакторы, как проживание в сельской местности, бездомность, история тюремного заключения, низкий уровень образования, занятость, низкий уровень дохода, курение, злоупотребление наркотиками и алкоголизм, являются факторами риска, тесно связанными с распространённостью МЛУ-ТБ во всем мире.
Образовательные и профилактические программы должны быть усилены с упором на пациентов, входящих в группы риска по заболеваемости МЛУ-ТБ. Одновременно с этим, неоднозначные факторы риска должны быть подвергнуты дальнейшему изучению и контролю.
Данные меры позволят снизить развитие вторичной МЛУ среди больных туберкулёзом и первичное заражение здоровых людей МЛУ-ТБ.
Список источников |
 |
 1. Abubakar I., et al. Controversies and unresolved issues in tuberculosis prevention and control: a low-burden-country perspective //Journal of Infectious Diseases. - 2012. - Vol. 205, № 2. - P. 293-300.
1. Abubakar I., et al. Controversies and unresolved issues in tuberculosis prevention and control: a low-burden-country perspective //Journal of Infectious Diseases. - 2012. - Vol. 205, № 2. - P. 293-300. 2. Al Ammari M., et al. Drug resistant tuberculosis in Saudi Arabia: an analysis of surveillance data 2014-2015 // Antimicrobial Resistance & Infection Control. - 2018. - Vol. 7, № 1. - P. 1-6.
2. Al Ammari M., et al. Drug resistant tuberculosis in Saudi Arabia: an analysis of surveillance data 2014-2015 // Antimicrobial Resistance & Infection Control. - 2018. - Vol. 7, № 1. - P. 1-6. 3. Alemu A., et al. Predictors of mortality in patients with drug-resistant tuberculosis: A systematic review and meta-analysis // PLoS ONE. - 2021. - Vol. 16, № 6. - P. e0253848.
3. Alemu A., et al. Predictors of mortality in patients with drug-resistant tuberculosis: A systematic review and meta-analysis // PLoS ONE. - 2021. - Vol. 16, № 6. - P. e0253848. 4. Alene K.A., et al. Risk factors for multidrug-resistant tuberculosis in northwest Ethiopia: A case-control study // Transboundary and emerging diseases. - 2019. - Vol. 66, № 4. - P. 1611-1618.
4. Alene K.A., et al. Risk factors for multidrug-resistant tuberculosis in northwest Ethiopia: A case-control study // Transboundary and emerging diseases. - 2019. - Vol. 66, № 4. - P. 1611-1618. 5. Al-Hayani A.M., et al. Drug Resistance to Anti-Tuberculosis Drugs: A Cross-Sectional Study From Makkah, Saudi Arabia // Cureus. - 2021. - Vol. 13, № 8. - P. e17069.
5. Al-Hayani A.M., et al. Drug Resistance to Anti-Tuberculosis Drugs: A Cross-Sectional Study From Makkah, Saudi Arabia // Cureus. - 2021. - Vol. 13, № 8. - P. e17069. 6. Alikhanova N., et al. First national survey of anti-tuberculosis drug resistance in Azerbaijan and risk factors analysis // Public Health Action. - 2014. - Vol. 4, № 2. - P. 17-23.
6. Alikhanova N., et al. First national survey of anti-tuberculosis drug resistance in Azerbaijan and risk factors analysis // Public Health Action. - 2014. - Vol. 4, № 2. - P. 17-23. 7. Al-Shahrani M.S., et al. Prevalence of primary anti-tuberculosis drug resistance at the tertiary center in Saudi Arabia and associated risk factors // Saudi Medical Journal. - 2021. - Vol. 42, № 7. - P. 728-734.
7. Al-Shahrani M.S., et al. Prevalence of primary anti-tuberculosis drug resistance at the tertiary center in Saudi Arabia and associated risk factors // Saudi Medical Journal. - 2021. - Vol. 42, № 7. - P. 728-734. 8. Arroyo L.H., et al. Determinants of multidrug-resistant tuberculosis in São Paulo - Brazil: a multilevel Bayesian analysis of factors associated with individual, community and access to health services // Tropical Medicine & International Health. - 2020. - Vol. 25, № 7. - P. 839-849.
8. Arroyo L.H., et al. Determinants of multidrug-resistant tuberculosis in São Paulo - Brazil: a multilevel Bayesian analysis of factors associated with individual, community and access to health services // Tropical Medicine & International Health. - 2020. - Vol. 25, № 7. - P. 839-849. 9. Basingnaa A., et al. Plasma levels of cytokines (IL-10, IFN-γ and TNF-α) in multidrug resistant tuberculosis and drug responsive tuberculosis patients in Ghana // Diseases. - 2019. - Vol. 7, № 1. - P. 2.
9. Basingnaa A., et al. Plasma levels of cytokines (IL-10, IFN-γ and TNF-α) in multidrug resistant tuberculosis and drug responsive tuberculosis patients in Ghana // Diseases. - 2019. - Vol. 7, № 1. - P. 2. 10. Cai X., et al. Meta-analysis on risk factors of multidrug resistant tuberculosis in China //Zhonghua liu xing bing xue za zhi= Zhonghua liuxingbingxue zazhi. - 2015. - Vol. 36, № 12. - P. 1424-1429.
10. Cai X., et al. Meta-analysis on risk factors of multidrug resistant tuberculosis in China //Zhonghua liu xing bing xue za zhi= Zhonghua liuxingbingxue zazhi. - 2015. - Vol. 36, № 12. - P. 1424-1429. 11. Carter B.B., et al. Survival analysis of patients with tuberculosis and risk factors for multidrug-resistant tuberculosis in Monrovia, Liberia // Plos One. - 2021. - Vol. 16, № 4. - P. e0249474.
11. Carter B.B., et al. Survival analysis of patients with tuberculosis and risk factors for multidrug-resistant tuberculosis in Monrovia, Liberia // Plos One. - 2021. - Vol. 16, № 4. - P. e0249474. 12. Chang L., et al. Mapping international collaboration in tuberculosis research from 1998 to 2017: A scientometric study // Medicine. - 2019. - Vol. 98, № 37. - P. e17027.
12. Chang L., et al. Mapping international collaboration in tuberculosis research from 1998 to 2017: A scientometric study // Medicine. - 2019. - Vol. 98, № 37. - P. e17027. 13. Chen Y., et al. Association of gene polymorphisms and environmental factors in tuberculosis patients and their household contacts // Transactions of The Royal Society of Tropical Medicine and Hygiene. - 2021. - Vol. 115, № 1. - P. 20-29.
13. Chen Y., et al. Association of gene polymorphisms and environmental factors in tuberculosis patients and their household contacts // Transactions of The Royal Society of Tropical Medicine and Hygiene. - 2021. - Vol. 115, № 1. - P. 20-29. 14. Cheng Q., et al. Impact of different tuberculosis history at the onset of future multidrug-resistant tuberculosis: a large, retrospective, population-based cohort study // Journal of Global Antimicrobial Resistance. - 2021. - Vol. 24. - P. 158-168.
14. Cheng Q., et al. Impact of different tuberculosis history at the onset of future multidrug-resistant tuberculosis: a large, retrospective, population-based cohort study // Journal of Global Antimicrobial Resistance. - 2021. - Vol. 24. - P. 158-168. 15. Cheng Q., et al. Incidence density and predictors of multidrug-resistant tuberculosis among individuals with previous tuberculosis history: a 15-year retrospective cohort study // Frontiers in Public Health. - 2021. - Vol. 9. - P. 549.
15. Cheng Q., et al. Incidence density and predictors of multidrug-resistant tuberculosis among individuals with previous tuberculosis history: a 15-year retrospective cohort study // Frontiers in Public Health. - 2021. - Vol. 9. - P. 549. 16. de Almeida Crispim J., et al. Risk factors associated with drug-resistant tuberculosis in prisons in São Paulo State, Brazil (2006-2016) // The Journal of Infection in Developing Countries. - 2021. - Vol. 15, № 11. - P. 1661-1669.
16. de Almeida Crispim J., et al. Risk factors associated with drug-resistant tuberculosis in prisons in São Paulo State, Brazil (2006-2016) // The Journal of Infection in Developing Countries. - 2021. - Vol. 15, № 11. - P. 1661-1669. 17. Dean A.S., Cox H., Zignol M. Epidemiology of drug-resistant tuberculosis // Strain variation in the Mycobacterium tuberculosis complex: its role in biology, epidemiology and control. - 2017. - P. 209-220.
17. Dean A.S., Cox H., Zignol M. Epidemiology of drug-resistant tuberculosis // Strain variation in the Mycobacterium tuberculosis complex: its role in biology, epidemiology and control. - 2017. - P. 209-220. 18. Di Gennaro F., et al. Social determinants of therapy failure and multi drug resistance among people with tuberculosis: A review // Tuberculosis. - 2017. - Vol. 103. - P. 44-51.
18. Di Gennaro F., et al. Social determinants of therapy failure and multi drug resistance among people with tuberculosis: A review // Tuberculosis. - 2017. - Vol. 103. - P. 44-51. 19. Diriba G., et al. Drug resistance and its risk factors among extrapulmonary tuberculosis in Ethiopia: A systematic review and meta-analysis // PloS One. - 2021. - Vol. 16, № 10. - P. e0258295.
19. Diriba G., et al. Drug resistance and its risk factors among extrapulmonary tuberculosis in Ethiopia: A systematic review and meta-analysis // PloS One. - 2021. - Vol. 16, № 10. - P. e0258295.  20. Elduma A.H., et al. Assessment of the risk factors associated with multidrug-resistant tuberculosis in Sudan: a case-control study // Epidemiology and Health. - 2019. - Vol. 41. - P. e2019014.
20. Elduma A.H., et al. Assessment of the risk factors associated with multidrug-resistant tuberculosis in Sudan: a case-control study // Epidemiology and Health. - 2019. - Vol. 41. - P. e2019014. 21. Fadaee M., et al. Stopping of the downtrend of Tuberculosis in Iran, a systematic review of associated risk factors // Infectious Disorders-Drug Targets (Formerly Current Drug Targets-Infectious Disorders). - 2020. - Vol. 20, № 3. - P. 367-373.
21. Fadaee M., et al. Stopping of the downtrend of Tuberculosis in Iran, a systematic review of associated risk factors // Infectious Disorders-Drug Targets (Formerly Current Drug Targets-Infectious Disorders). - 2020. - Vol. 20, № 3. - P. 367-373. 22. Feng M., et al. Risk factors of multidrug-resistant tuberculosis in China: A meta-analysis // Public Health Nursing. - 2019. - Vol. 36, № 3. - P. 257-269.
22. Feng M., et al. Risk factors of multidrug-resistant tuberculosis in China: A meta-analysis // Public Health Nursing. - 2019. - Vol. 36, № 3. - P. 257-269. 23. Ge E., et al. Transmission of multidrug-resistant tuberculosis in Shanghai: roles of residential status // The International Journal of Tuberculosis and Lung Disease. - 2018. - Vol. 22, № 12. - P. 1462-1468.
23. Ge E., et al. Transmission of multidrug-resistant tuberculosis in Shanghai: roles of residential status // The International Journal of Tuberculosis and Lung Disease. - 2018. - Vol. 22, № 12. - P. 1462-1468. 24. Goel S., Thakur D., Singh A. Determinants of drug resistant & drug sensitive tuberculosis patients from North India-a case control study // Indian Journal of Tuberculosis. - 2021. - Vol. 68. - P. 108-114.
24. Goel S., Thakur D., Singh A. Determinants of drug resistant & drug sensitive tuberculosis patients from North India-a case control study // Indian Journal of Tuberculosis. - 2021. - Vol. 68. - P. 108-114. 25. Grobler L., et al. The epidemiology of tuberculosis in health care workers in South Africa: a systematic review // BMC Health Services Research. - 2016. - Vol. 16, № 1. - P. 1-15.
25. Grobler L., et al. The epidemiology of tuberculosis in health care workers in South Africa: a systematic review // BMC Health Services Research. - 2016. - Vol. 16, № 1. - P. 1-15. 26. Hameed S., et al. Drug resistance profile of Mycobacterium tuberculosis and predictors associated with the development of drug resistance // Journal of global antimicrobial resistance. - 2019. - Vol. 18. - P. 155-159.
26. Hameed S., et al. Drug resistance profile of Mycobacterium tuberculosis and predictors associated with the development of drug resistance // Journal of global antimicrobial resistance. - 2019. - Vol. 18. - P. 155-159. 27. Ignatyeva O., et al. Resistance profile and risk factors of drug resistant tuberculosis in the Baltic countries // Tuberculosis. - 2015. - Vol. 95, № 5. - P. 581-588.
27. Ignatyeva O., et al. Resistance profile and risk factors of drug resistant tuberculosis in the Baltic countries // Tuberculosis. - 2015. - Vol. 95, № 5. - P. 581-588. 28. Iradukunda A., et al. Key factors influencing multidrug-resistant tuberculosis in patients under anti-tuberculosis treatment in two centres in Burundi: a mixed effect modelling study // BMC Public Health. - 2021. - Vol. 21, № 1. - P. 1-9.
28. Iradukunda A., et al. Key factors influencing multidrug-resistant tuberculosis in patients under anti-tuberculosis treatment in two centres in Burundi: a mixed effect modelling study // BMC Public Health. - 2021. - Vol. 21, № 1. - P. 1-9. 29. Jenkins H.E., et al. Geographical heterogeneity of multidrug-resistant tuberculosis in Georgia, January 2009 to June 2011 // Eurosurveillance. - 2014. - Vol. 19, № 11. - P. 20743.
29. Jenkins H.E., et al. Geographical heterogeneity of multidrug-resistant tuberculosis in Georgia, January 2009 to June 2011 // Eurosurveillance. - 2014. - Vol. 19, № 11. - P. 20743. 30. Kizito E., et al. Risk factors for mortality among patients diagnosed with multi-drug resistant tuberculosis in Uganda-a case-control study // BMC Infectious Diseases. - 2021. - Vol. 21, № 1. - P. 1-7.
30. Kizito E., et al. Risk factors for mortality among patients diagnosed with multi-drug resistant tuberculosis in Uganda-a case-control study // BMC Infectious Diseases. - 2021. - Vol. 21, № 1. - P. 1-7. 31. Korhonen V., et al. Risk factors affecting treatment outcomes for pulmonary tuberculosis in Finland 2007-2014: a national cohort study // BMC Public Health. - 2020. - Vol. 20, № 1. - P. 1-9.
31. Korhonen V., et al. Risk factors affecting treatment outcomes for pulmonary tuberculosis in Finland 2007-2014: a national cohort study // BMC Public Health. - 2020. - Vol. 20, № 1. - P. 1-9. 32. Korzeniewska-Koseła M., et al. Tuberculosis in Poland in 2013 // Przegl Epidemiol. - 2015. - Vol. 69, № 2. - P. 277-282.
32. Korzeniewska-Koseła M., et al. Tuberculosis in Poland in 2013 // Przegl Epidemiol. - 2015. - Vol. 69, № 2. - P. 277-282. 33. Lalor M.K., Perkins S., Thomas H.L. Burden of multidrug-resistant tuberculosis in England: a focus on prevalent cases // The International Journal of Tuberculosis and Lung Disease. - 2019. - Vol. 23, № 6. - P. 707-713.
33. Lalor M.K., Perkins S., Thomas H.L. Burden of multidrug-resistant tuberculosis in England: a focus on prevalent cases // The International Journal of Tuberculosis and Lung Disease. - 2019. - Vol. 23, № 6. - P. 707-713. 34. Lee M., et al. Multidrug-resistant tuberculosis in South Korea: a retrospective analysis of national registry data in 2011-2015 // The International Journal of Tuberculosis and Lung Disease. - 2019. - Vol. 23, № 7. - P. 850-857.
34. Lee M., et al. Multidrug-resistant tuberculosis in South Korea: a retrospective analysis of national registry data in 2011-2015 // The International Journal of Tuberculosis and Lung Disease. - 2019. - Vol. 23, № 7. - P. 850-857. 35. Lin M., et al. High incidence of drug-resistant Mycobacterium tuberculosis in Hainan island, China // Tropical Medicine & International Health. - 2019. - Vol. 24, № 9. - P. 1098-1103.
35. Lin M., et al. High incidence of drug-resistant Mycobacterium tuberculosis in Hainan island, China // Tropical Medicine & International Health. - 2019. - Vol. 24, № 9. - P. 1098-1103. 36. Loddenkemper R., et al. 125 Jahre Deutsches Zentralkomitee zur Bekämpfung der Tuberkulose e. V. (DZK) // Pneumologie. - 2020. - Vol. 74, № 11. - P. 719-741.
36. Loddenkemper R., et al. 125 Jahre Deutsches Zentralkomitee zur Bekämpfung der Tuberkulose e. V. (DZK) // Pneumologie. - 2020. - Vol. 74, № 11. - P. 719-741. 37. Machmud P.B., Gayatri D., Ronoatmodjo S. A Survival Analysis of Successful and Poor Treatment Outcome Among Patients with Drug-Resistant Tuberculosis and the Associated Factors: A Retrospective Cohort Study // Acta Medica Indonesiana. - 2021. - Vol. 53, № 2. - P. 184-193.
37. Machmud P.B., Gayatri D., Ronoatmodjo S. A Survival Analysis of Successful and Poor Treatment Outcome Among Patients with Drug-Resistant Tuberculosis and the Associated Factors: A Retrospective Cohort Study // Acta Medica Indonesiana. - 2021. - Vol. 53, № 2. - P. 184-193. 38. Matambo R., et al. Predictors of mortality and treatment success of multi-drug resistant and Rifampicin resistant tuberculosis in Zimbabwe: a retrospective cohort analysis of patients initiated on treatment during 2010 to 2015 // The Pan African Medical Journal. - 2021. - Vol. 39. - P. 128.
38. Matambo R., et al. Predictors of mortality and treatment success of multi-drug resistant and Rifampicin resistant tuberculosis in Zimbabwe: a retrospective cohort analysis of patients initiated on treatment during 2010 to 2015 // The Pan African Medical Journal. - 2021. - Vol. 39. - P. 128. 39. Mbuh T.P., et al. Predictors of Drug-Resistant Tuberculosis among High-Risk Population Diagnosed under National Program Conditions in the Littoral Region, Cameroon // BioMed Research International. - 2021. - Vol. 2021. - P. 8817442.
39. Mbuh T.P., et al. Predictors of Drug-Resistant Tuberculosis among High-Risk Population Diagnosed under National Program Conditions in the Littoral Region, Cameroon // BioMed Research International. - 2021. - Vol. 2021. - P. 8817442. 40. McNabb K.C., Bergman A., Farley J.E. Risk factors for poor engagement in drug-resistant TB care in South Africa: a systematic review // Public Health Action. - 2021. - Vol. 11, № 3. - P. 139-145.
40. McNabb K.C., Bergman A., Farley J.E. Risk factors for poor engagement in drug-resistant TB care in South Africa: a systematic review // Public Health Action. - 2021. - Vol. 11, № 3. - P. 139-145. 41. McQuaid C.F., et al. The risk of multidrug-or rifampicin-resistance in males versus females with tuberculosis // European Respiratory Journal. - 2020. - Vol. 56, № 3. - P. 2000626.
41. McQuaid C.F., et al. The risk of multidrug-or rifampicin-resistance in males versus females with tuberculosis // European Respiratory Journal. - 2020. - Vol. 56, № 3. - P. 2000626. 42. Migliori G.B., et al. MDR/XDR-TB management of patients and contacts: Challenges facing the new decade. The 2020 clinical update by the Global Tuberculosis Network //International Journal of Infectious Diseases. - 2020. - Vol. 92. - P. 15-25.
42. Migliori G.B., et al. MDR/XDR-TB management of patients and contacts: Challenges facing the new decade. The 2020 clinical update by the Global Tuberculosis Network //International Journal of Infectious Diseases. - 2020. - Vol. 92. - P. 15-25. 43. Moher D., et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement // PLoS medicine. - 2009. - Vol. 6, № 7. - P. e1000097.
43. Moher D., et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement // PLoS medicine. - 2009. - Vol. 6, № 7. - P. e1000097. 44. Mulisa G., et al. International Journal of Infectious Diseases Multidrug-resistant Mycobacterium tuberculosis and associated risk factors in Oromia Region of Ethiopia // International Society for Infectious Diseases. - 2015. - Vol. 39. - P. 57-61.
44. Mulisa G., et al. International Journal of Infectious Diseases Multidrug-resistant Mycobacterium tuberculosis and associated risk factors in Oromia Region of Ethiopia // International Society for Infectious Diseases. - 2015. - Vol. 39. - P. 57-61. 45. Müller B., et al. The heterogeneous evolution of multidrug-resistant Mycobacterium tuberculosis // Trends in Genetics. - 2013. - Vol. 29, № 3. - P. 160-169.
45. Müller B., et al. The heterogeneous evolution of multidrug-resistant Mycobacterium tuberculosis // Trends in Genetics. - 2013. - Vol. 29, № 3. - P. 160-169. 46. Pavlenko E., et al. Alarming levels of multidrug-resistant tuberculosis in Ukraine: results from the first national survey // The International Journal of Tuberculosis and Lung Disease. - 2018. - Vol. 22, № 2. - P. 197-205.
46. Pavlenko E., et al. Alarming levels of multidrug-resistant tuberculosis in Ukraine: results from the first national survey // The International Journal of Tuberculosis and Lung Disease. - 2018. - Vol. 22, № 2. - P. 197-205. 47. Pradipta I.S., et al. Risk factors of multidrug-resistant tuberculosis: A global systematic review and meta-analysis // Journal of Infection. - 2018. - Vol. 77, № 6. - P. 469-478.
47. Pradipta I.S., et al. Risk factors of multidrug-resistant tuberculosis: A global systematic review and meta-analysis // Journal of Infection. - 2018. - Vol. 77, № 6. - P. 469-478. 48. Rajendran M., Zaki R.A., Aghamohammadi N. Contributing risk factors towards the prevalence of multidrug-resistant tuberculosis in Malaysia: A systematic review // Tuberculosis. - 2020. - Vol. 122. - P. 101925.
48. Rajendran M., Zaki R.A., Aghamohammadi N. Contributing risk factors towards the prevalence of multidrug-resistant tuberculosis in Malaysia: A systematic review // Tuberculosis. - 2020. - Vol. 122. - P. 101925. 49. Rifat M., et al. Development of multidrug resistant tuberculosis in Bangladesh: a case-control study on risk factors // PloS One. - 2014. - Vol. 9, № 8. - P. e105214.
49. Rifat M., et al. Development of multidrug resistant tuberculosis in Bangladesh: a case-control study on risk factors // PloS One. - 2014. - Vol. 9, № 8. - P. e105214. 50. Ruan Q., et al. Recurrent pulmonary tuberculosis after treatment success: a population-based retrospective study in China // Clinical Microbiology and Infection. - 2021. - P. S1198-743X(21)00546-2.
50. Ruan Q., et al. Recurrent pulmonary tuberculosis after treatment success: a population-based retrospective study in China // Clinical Microbiology and Infection. - 2021. - P. S1198-743X(21)00546-2. 51. Saifullah A., et al. Evaluation of risk factors associated with the development of MDR-and XDR-TB in a tertiary care hospital: a retrospective cohort study // Peer J. - 2021. - P. e10826.
51. Saifullah A., et al. Evaluation of risk factors associated with the development of MDR-and XDR-TB in a tertiary care hospital: a retrospective cohort study // Peer J. - 2021. - P. e10826. 52. Salmanzadeh S., et al. Evaluation of the frequency of resistance to 2 drugs (Isoniazid and Rifampin) by molecular investigation and it's risk factors in new cases of smear positive pulmonary tuberculosis in health centers under the cover of Jundishapur University of Medical Sciences in 2017 // Journal of Family Medicine and Primary Care. - 2020. - Vol. 9, № 4. - P. 19-58.
52. Salmanzadeh S., et al. Evaluation of the frequency of resistance to 2 drugs (Isoniazid and Rifampin) by molecular investigation and it's risk factors in new cases of smear positive pulmonary tuberculosis in health centers under the cover of Jundishapur University of Medical Sciences in 2017 // Journal of Family Medicine and Primary Care. - 2020. - Vol. 9, № 4. - P. 19-58. 53. Sambas M. F. M. K., et al. Prevalence and Determinants of Multidrug-Resistant Tuberculosis in Makkah, Saudi Arabia // Infection and Drug Resistance. - 2020. - Vol. 13. - P. 40-31.
53. Sambas M. F. M. K., et al. Prevalence and Determinants of Multidrug-Resistant Tuberculosis in Makkah, Saudi Arabia // Infection and Drug Resistance. - 2020. - Vol. 13. - P. 40-31. 54. Scotto G., Fazio V., Lo Muzio L. Tuberculosis in the immigrant population in Italy: state-of-the-art review // Infez Med. - 2017. - Vol. 25, № 3. - P. 199-209.
54. Scotto G., Fazio V., Lo Muzio L. Tuberculosis in the immigrant population in Italy: state-of-the-art review // Infez Med. - 2017. - Vol. 25, № 3. - P. 199-209. 55. Seifert M., et al. Age and sex distribution of Mycobacterium tuberculosis infection and rifampicin resistance in Myanmar as detected by Xpert MTB/RIF // BMC Infectious Diseases. - 2021. - Vol. 21, № 1. - P. 1-8.
55. Seifert M., et al. Age and sex distribution of Mycobacterium tuberculosis infection and rifampicin resistance in Myanmar as detected by Xpert MTB/RIF // BMC Infectious Diseases. - 2021. - Vol. 21, № 1. - P. 1-8. 56. Shadrach B.J., et al. A study of multidrug resistant tuberculosis among symptomatic household contacts of MDR-TB patients // Indian Journal of Tuberculosis. - 2021. - Vol. 68, № 1. - P. 25-31.
56. Shadrach B.J., et al. A study of multidrug resistant tuberculosis among symptomatic household contacts of MDR-TB patients // Indian Journal of Tuberculosis. - 2021. - Vol. 68, № 1. - P. 25-31. 57. Sharma A., et al. Estimating the future burden of multidrug-resistant and extensively drug-resistant tuberculosis in India, the Philippines, Russia, and South Africa: a mathematical modelling study // The Lancet Infectious Diseases. - 2017. - Vol. 17, № 7. - P. 707-715.
57. Sharma A., et al. Estimating the future burden of multidrug-resistant and extensively drug-resistant tuberculosis in India, the Philippines, Russia, and South Africa: a mathematical modelling study // The Lancet Infectious Diseases. - 2017. - Vol. 17, № 7. - P. 707-715. 58. Sharma P., et al. Factors associated with the development of secondary multidrug-resistant tuberculosis // International Journal of Preventive Medicine. - 2019. - Vol. 10. - P. 67.
58. Sharma P., et al. Factors associated with the development of secondary multidrug-resistant tuberculosis // International Journal of Preventive Medicine. - 2019. - Vol. 10. - P. 67. 59. Sharma S., et al. Demographic profile, clinical and microbiological predictors of mortality amongst admitted pediatric TB patients in a tertiary referral tuberculosis hospital // Indian Journal of Tuberculosis. - 2020. - Vol. 67, № 3. - P. 312-319.
59. Sharma S., et al. Demographic profile, clinical and microbiological predictors of mortality amongst admitted pediatric TB patients in a tertiary referral tuberculosis hospital // Indian Journal of Tuberculosis. - 2020. - Vol. 67, № 3. - P. 312-319. 60. Sharma V., et al. Audiological evaluation of patients taking kanamycin for multidrug resistant tuberculosis // Iranian Journal of Otorhinolaryngology. - 2016. - Vol. 28, № 86. - P. 203.
60. Sharma V., et al. Audiological evaluation of patients taking kanamycin for multidrug resistant tuberculosis // Iranian Journal of Otorhinolaryngology. - 2016. - Vol. 28, № 86. - P. 203. 61. Shrestha S. K., et al. Prevalence and risk factors of depression in patients with drug-resistant tuberculosis in Nepal: A cross-sectional study // Journal of Clinical Tuberculosis and Other Mycobacterial Diseases. - 2020. - Vol. 21. - P. 100-106.
61. Shrestha S. K., et al. Prevalence and risk factors of depression in patients with drug-resistant tuberculosis in Nepal: A cross-sectional study // Journal of Clinical Tuberculosis and Other Mycobacterial Diseases. - 2020. - Vol. 21. - P. 100-106. 62. Singh A., et al. Prevalence of adverse drug reaction with first-line drugs among patients treated for pulmonary tuberculosis // Clinical Epidemiology and Global Health. - 2015. - Vol. 3. - P. 80-90.
62. Singh A., et al. Prevalence of adverse drug reaction with first-line drugs among patients treated for pulmonary tuberculosis // Clinical Epidemiology and Global Health. - 2015. - Vol. 3. - P. 80-90. 63. Skrahina A., et al. Multidrug-resistant tuberculosis in Belarus: the size of the problem and associated risk factors // Bulletin of the World Health Organization. - 2013. - Vol. 91. - P. 36-45.
63. Skrahina A., et al. Multidrug-resistant tuberculosis in Belarus: the size of the problem and associated risk factors // Bulletin of the World Health Organization. - 2013. - Vol. 91. - P. 36-45. 64. Soeroto A.Y., et al. Factors affecting outcome of longer regimen multidrug-resistant tuberculosis treatment in West Java Indonesia: A retrospective cohort study // Plos One. - 2021. - Vol. 16, № 2. - P. e0246284.
64. Soeroto A.Y., et al. Factors affecting outcome of longer regimen multidrug-resistant tuberculosis treatment in West Java Indonesia: A retrospective cohort study // Plos One. - 2021. - Vol. 16, № 2. - P. e0246284. 65. Stosic M., et al. Risk factors for multidrug-resistant tuberculosis among tuberculosis patients in Serbia: a case-control study // BMC Public Health. - 2018. - Vol. 18, № 1. - P. 1-8.
65. Stosic M., et al. Risk factors for multidrug-resistant tuberculosis among tuberculosis patients in Serbia: a case-control study // BMC Public Health. - 2018. - Vol. 18, № 1. - P. 1-8. 66. Tanrikulu A.C., Abakay A., Abakay O. Risk factors for multidrug-resistant tuberculosis in Diyarbakir, Turkey // Medical Science Monitor. - 2010. - Vol. 16, № 6. - P. PH57-PH62.
66. Tanrikulu A.C., Abakay A., Abakay O. Risk factors for multidrug-resistant tuberculosis in Diyarbakir, Turkey // Medical Science Monitor. - 2010. - Vol. 16, № 6. - P. PH57-PH62. 67. Tao N., et al. Risk factors for drug-resistant tuberculosis, the association between comorbidity status and drug-resistant patterns: a retrospective study of previously treated pulmonary tuberculosis in Shandong, China, during 2004-2019 // BMJ Open. - 2021. - Vol. 11, № 6. - P. e044349.
67. Tao N., et al. Risk factors for drug-resistant tuberculosis, the association between comorbidity status and drug-resistant patterns: a retrospective study of previously treated pulmonary tuberculosis in Shandong, China, during 2004-2019 // BMJ Open. - 2021. - Vol. 11, № 6. - P. e044349. 68. Tembo B.P., Malangu N.G. Prevalence and factors associated with multidrug/rifampicin resistant tuberculosis among suspected drug resistant tuberculosis patients in Botswana // BMC infectious diseases. - 2019. - Vol. 19, № 1. - P. 1-8.
68. Tembo B.P., Malangu N.G. Prevalence and factors associated with multidrug/rifampicin resistant tuberculosis among suspected drug resistant tuberculosis patients in Botswana // BMC infectious diseases. - 2019. - Vol. 19, № 1. - P. 1-8. 69. Timire C., et al. Prevalence of drug-resistant tuberculosis in Zimbabwe: A health facility-based cross-sectional survey // International Journal of Infectious Diseases. - 2019. - Vol. 87. - P. 119-125.
69. Timire C., et al. Prevalence of drug-resistant tuberculosis in Zimbabwe: A health facility-based cross-sectional survey // International Journal of Infectious Diseases. - 2019. - Vol. 87. - P. 119-125. 70. Toit K., et al. A four-year nationwide molecular epidemiological study in Estonia: risk factors for tuberculosis transmission // Public Health Action. - 2014. - Vol. 4, № 2. - P. 34-40.
70. Toit K., et al. A four-year nationwide molecular epidemiological study in Estonia: risk factors for tuberculosis transmission // Public Health Action. - 2014. - Vol. 4, № 2. - P. 34-40. 71. Tola H., et al. National treatment outcome and predictors of death and treatment failure in multidrug-resistant tuberculosis in Ethiopia: a 10-year retrospective cohort study // BMJ Open. - 2021. - Vol. 11, № 8. - P. e040862.
71. Tola H., et al. National treatment outcome and predictors of death and treatment failure in multidrug-resistant tuberculosis in Ethiopia: a 10-year retrospective cohort study // BMJ Open. - 2021. - Vol. 11, № 8. - P. e040862. 72. Uplekar M., et al. WHO's new end TB strategy // The Lancet. - 2015. - Vol. 385, № 9979. - P. 1799-1801.
72. Uplekar M., et al. WHO's new end TB strategy // The Lancet. - 2015. - Vol. 385, № 9979. - P. 1799-1801. 73. Van den Hof S., et al. Converging risk factors but no association between HIV infection and multidrug-resistant tuberculosis in Kazakhstan // The International Journal of Tuberculosis and Lung Disease. - 2013. - Vol. 17, № 4. - P. 526-531.
73. Van den Hof S., et al. Converging risk factors but no association between HIV infection and multidrug-resistant tuberculosis in Kazakhstan // The International Journal of Tuberculosis and Lung Disease. - 2013. - Vol. 17, № 4. - P. 526-531. 74. Wang M.G., et al. Association between tobacco smoking and drug-resistant tuberculosis // Infection and Drug Resistance. - 2018. - Vol. 11. - P. 873.
74. Wang M.G., et al. Association between tobacco smoking and drug-resistant tuberculosis // Infection and Drug Resistance. - 2018. - Vol. 11. - P. 873. 75. Wang W., et al. Contribution of rural-to-urban migration in the prevalence of drug resistant tuberculosis in China // European Journal of Clinical Microbiology & Infectious Diseases. - 2011. - Vol. 30, № 4. - P. 581-586.
75. Wang W., et al. Contribution of rural-to-urban migration in the prevalence of drug resistant tuberculosis in China // European Journal of Clinical Microbiology & Infectious Diseases. - 2011. - Vol. 30, № 4. - P. 581-586. 76. World Health Organization, et al. Gender equality, work and health: a review of the evidence. - World Health Organization, 2006.
76. World Health Organization, et al. Gender equality, work and health: a review of the evidence. - World Health Organization, 2006. 77. World Health Organization, et al. Global tuberculosis report 2020. - 2020.
77. World Health Organization, et al. Global tuberculosis report 2020. - 2020. 78. Wu B., et al. Epidemiology of drug-resistant tuberculosis in Chongqing, China: A retrospective observational study from 2010 to 2017 // PloS One. - 2019. - Vol. 14, № 12. - P. e0216018.
78. Wu B., et al. Epidemiology of drug-resistant tuberculosis in Chongqing, China: A retrospective observational study from 2010 to 2017 // PloS One. - 2019. - Vol. 14, № 12. - P. e0216018. 79. Yang S., et al. Multi-drug resistant spinal tuberculosis-epidemiological characteristics of in-patients: a multicentre retrospective study // Epidemiology & Infection. - 2020. - Vol. 148. - P. e11.
79. Yang S., et al. Multi-drug resistant spinal tuberculosis-epidemiological characteristics of in-patients: a multicentre retrospective study // Epidemiology & Infection. - 2020. - Vol. 148. - P. e11. 80. Zheng X.B., et al. Treatment quality and outcome for multidrug-resistant tuberculosis patients in four regions of China: a cohort study // Infectious Diseases of Poverty. - 2020. - Vol. 9, № 1. - P. 1-9.
80. Zheng X.B., et al. Treatment quality and outcome for multidrug-resistant tuberculosis patients in four regions of China: a cohort study // Infectious Diseases of Poverty. - 2020. - Vol. 9, № 1. - P. 1-9.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

