2022 год № 4
Клиническая медицина
2Национальный исследовательский медицинский центр онкологии им Н.Н. Блохина РАМН Минздрава России", Москва, Россия, aper52@gmail.com, http://orcid.org/0000-0002-1978-3477
Аннотация:
Ключевые слова:
21N.N. Blochin National Medical Research Center of Oncology, Moscow, Russia, aper52@gmail.com, http://orcid.org/0000-0002-1978-3477
Abstract:
Key words:
Введение |
 |
 |
Определение терапевтической эффективности противоопухолевой полихимиотерапии у пациентов в группе выживших, а также с отдаленными метастазами и с местными рецидивами, является актуальным направлением в клинической онкологии и морфологической диагностике опухолей.
Достаточно часто диагностика рака анального канала является запоздалой, опухоль распространяется быстро, часто выявляются отдаленные метастазы, местные рецидивы, поражение регионарных лимфоузлов.
При использовании линейных ускорителей (Philips SL-20, Philips SL-75-5, Clinac-2100C), добивались уничтожения опухоли, оставляя при этом фиброз и склерозирование окружающей ткани [13].
Верхняя граница поля облучения локализуется на уровне LV-SI (на уровне пояснично-крестцового сочленения) (рис. 1).
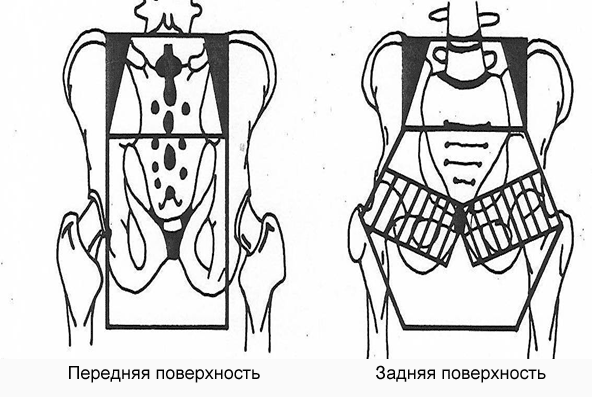
Рис. 1. Схема облучения дистанционной лучевой терапии. Малый таз
Нижняя граница поля облучения - на расстоянии 2,5 см (по некоторым данным на 3-4 см ниже дистального края первичной опухоли, боковые границы - на уровне тазового кольца, передняя- на 1 см кпереди от промонториума и задняя - на 2 см кзади от переднего контура крестца [13, 14].
В 2015 году рядом авторов был выполнен литературный обзор, посвященный проведенным рандомизированным исследованиям 3 фазы, лечения пациентов, страдающих плоскоклеточным раком анального канала. К ним относится АСТI, EORTC - 22861, RTOG 8704, ACTII, RTOG 98-11, ACCORDS-03. В некоторых работах было изучена возможность замены Митомицина С на Цисплатин, (АСТII, RTOG 98-11) [2].
Материалы и методы
|
 |
 |
Проведен ретроспективный анализ результатов лечения, а также заключений гистологических срезов опухоли у пациентов, страдающих раком анального канала в ФГБУ "НИМЦ им. Н.Н. Блохина" РАМН Минздрава РФ.
Пациенты в зависимости от клинической стадии (согласно TNM классификации, 7-я редакция, 2009) подверглись ДЛТ в течение пяти дней, ежедневно, в разовой дозе облучения (РОД) 5,0 Гр, в суммарной дозе облучения (СОД) до 25 Гр при аденокарциноме. Через 3-4 недели после начала лучевого облучения проводилось оперативное пособие в расширенном режиме [1, 3, 5, 6, 7].
При аденокарциноме в дни лучевой терапии проводилась неоадъювантную терапия, включающую СВЧ - гипертермию 2 раза в неделю, при температуре 41-43 °С, в течение 60 мин. с интервалом 72 ч, в 3,4,5 дни лучевого облучения вместе с внутриректальным введением метронидазола на 3,5 сеансы гипертермии, в сочетании с Капецитабином (Кселода) в дозе 1300 мг/м2 и 5-ФУ в дозе 1000 мг/м2/сут., 1-й, 4-й, 29-й, 32-й дни внутривенно [1, 6, 7].
При плоскоклеточном раке совместно с ДЛТ в дозе СОД 40-44 Гр на первичную опухоль и регионарные зоны, через двухнедельный перерыв, применялся дополнительный буст в СОД 10-26 Гр (локальное облучение первичной опухоли с одного промежностного прямого поля), Суммарная доза облучения в 2 этапа составляет СОД 64-70 Гр.
В 1-ый и 29-ый дни ЛТ использовался Цисплатин в дозе 60 мг/м2/сут., инфузионно, капельно, в сочетании с Блеомицином в дозе 15 мг/м2, внутримышечно, в течение 3-4 недель [1, 6, 7].
Известно, что применение Цисплатина и Блеомицина, включено во многие схемы ХЛТ (химиолучевой терапии), они являются давно известными в онкологии препаратами, применяющимися вместо Митомицина С.
На рисунке 2 представлена зависимость проведения расширенного радикального оперативного лечения, в зависимости от морфологического типа опухоли (рис. 2).
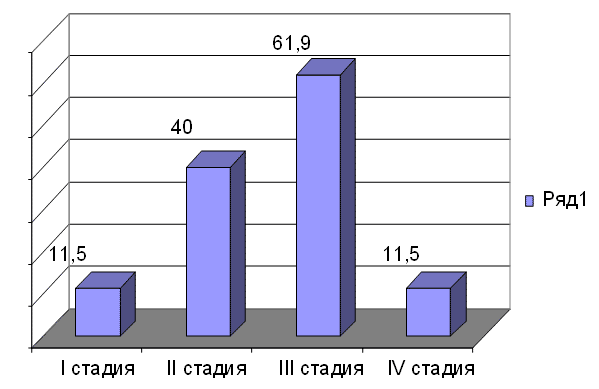
Рис. 2. Структура клинической стадии рака анального канала по TNM классификации 7-я редакция, 2009 (%)
Использовались программы Statistica и компьютерные методы Microsoft Excel 2007, морфологическое исследование гистологических срезов проводилось на микроскопе "Asiostarplus" с увеличением объективов ×5, ×10, ×20, ×40. Патоморфологическая стадия оценивалась по TNM классификации, 7-я редакция (UICC), 2009. Наличие лечебного патоморфоза определялось по методике Dworak J., 1997, Лавниковой А.Г., 1976 [13].
Математический расчет показателей выполнялся с помощью критерия χ2 (хи-квадрат). Используя четырехпольную таблицу, рассчитывали показатель ОШ (отношение шансов), оценивали риск неблагоприятных событий, сравнивая показатели с 1. Статистически значимыми считались значения при p≤0,05.
Результаты и обсуждение
|
 |
 |
Комбинированное противоопухолевое лечение проводилось 109 пациентам, страдающих раком анального канала, из них мужчины составили 30,2 % случаев (n=33), женщины - 69,8 % случаев (n=76), средний возраст составил 64,3±1,08 года (n=105).
В таблице 1 представлена клинико-морфологическая оценка пациентов, страдающих раком анального канала (табл. 1).
| Клинический параметр | Морфологическая структура опухоли | |
|---|---|---|
| Плоскоклеточный рак | Аденокарцинома | |
| Возраст пациента медиана до 68 лет / медиана 58 лет n % | 15 42,8 | 38 58,4 |
| Возраст пациента медиана старше 68 лет/ медиана старше 58 лет n % | 20 57,1 | 27 41,5 |
| Пол пациента: мужчины/ женщины n % | 4/31 11,4/ 88,5 | 27/38 41,5/58,4 |
| Применение Цисплатина и Блеомицина: да/нет n % | 29/5 82,8/17,1 | 65/0 100/0 |
| ДЛТ на первичную опухоль и регионарные лимфоузлы /внутриполостная лучевая терапия на первичную опухоль n % | 15/17 47/53 | -/- -/- |
| Суммарная доза облучения: медиана<25Гр/ медиана<58 Гр n % | 16 29,6 | 38 70,4 |
| Суммарная доза облучения: медиана >25Гр/ медиана>58 Гр n % | 15 53,6 | 13 46,3 |
| Оперативное лечение: да/нет n % | 27/7 81,2/18,8 | 54/11 83,8/16,2 |
| 62/Локализация опухоли: анальный канал: да/нет n % | 35/0 100/0 | 41/24 63,1/36,9 |
| Лечебный патоморфоз: да/нет n % | 11/23 31,4/68,4 | 34/31 52,3/47,6 |
По классификации TNM, 7-я редакция, I стадия выявлена в 11,5 % случаев (n=11), II стадия выявлена в 40 % случаев (n=35), III cтадия - в 61,9 % случаев (n=38), IV стадия - в 11,5 % случаев (n=11) (рис. 2).
Используя гистологическую классификацию 2010 года злокачественные опухоли анального канала подразделялись на аденокарциному (62,5 %/65), плоскоклеточный ороговевающий рак (32,7 %/34), плоскоклеточный неороговевающий рак (4,8 %/5). Чаще злокачественная опухоль локализовалась непосредственно в анальном канале (71,5 %/73), а также в прямой кишке (28,5 %/29). Наличие лечебного патоморфоза определялось в 44,3 % случаев (n=46), отсутствие лечебного патоморфоза в 55,78 % случаев (n=58), (рис. 3). Дистанционная лучевая терапия применялась при плоскоклеточном ороговевающим и неороговевающим раке в СОД составила 55,3±2,53 Гр, при аденокарциноме - 31,2±3,8 Гр, соответственно. Радикальное оперативное лечение применялась как при аденокарциноме так и при плоскоклеточном раке (рис. 4).
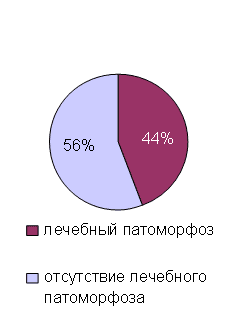
Рис. 3. Структура наличия лечебного патоморфоза рака анального канала в гистологическом срезе опухоли (%)
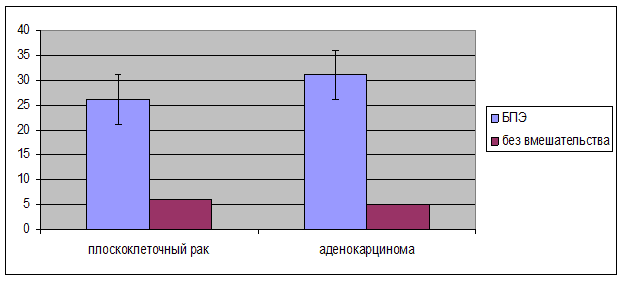
Рис. 4. Применение радикального оперативного лечения пациентов, страдающих раком анального канала, в зависимости от морфологического типа опухоли (n)
Изменение относительного риска наличия терапевтического патоморфоза у пациентов, страдающих раком анального канала в группе с использованием Цисплатина и Блеомицина, по отношению к абсолютному риску группы пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, равна (29,7 %-13,6 %)/13,6 %=2,5.
Изменение наличия терапевтического эффекта в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, относительно абсолютного риска этой группы, равно (29,7 %-13,6 %)/29,7 %=0,54. Тогда терапевтический эффект в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, выше, по сравнению с группой пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, χ2=3,38, ДИ 1,69-3,2, p<0,05 (рис. 5), (табл. 2).
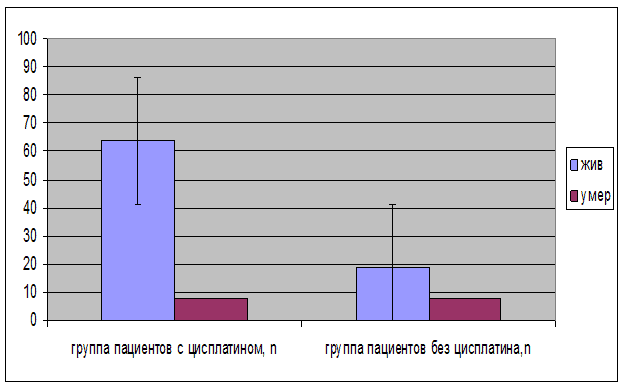
Рис. 5. Терапевтическая эффективность приема Цисплатина и Блеомицина, в зависимости от исхода заболевания (n)
Примечание. χ2=3,38, p<0,05.
| Пациенты | Выживший | Умерший |
|---|---|---|
| Группа 1 (с использованием Цисплатина и Блеомицина), n=27 n % | 19 70,3 | 8 29,7 |
| Группа 2 (без использования Цисплатина и Блеомицина), n=72 n % | 64 86,4 | 8 13,6 |
Примечание. χ2=3,38, p<0,05.
Отсутствие отдаленных метастазов в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, определяется достоверно чаще, по сравнению с группой пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, χ2=2,4, ДИ 0,12-2,28, p<0,05, (рис. 6) (табл. 4, 5).
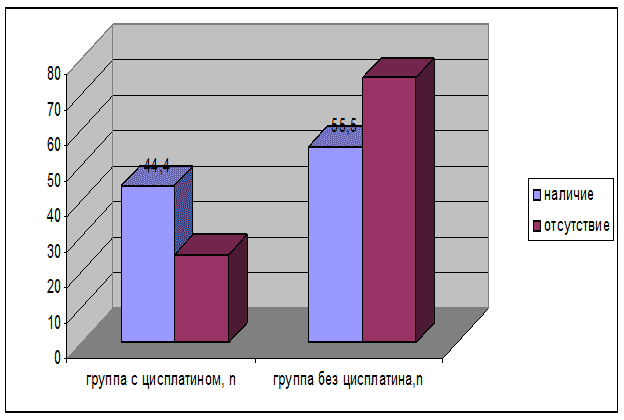
Рис. 6. Терапевтическая эффективность приема Цисплатина и Блеомицина, в зависимости отдаленных метастазов (%) Примечание. χ2=2,4, p<0,05.
Отсутствие местных рецидивов в группе пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина определялось достоверно чаще, по сравнению с группой пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, χ2=1,47, ДИ 0,07-1,39, p<0,05, (рис. 7, 8, 9), (табл. 3).
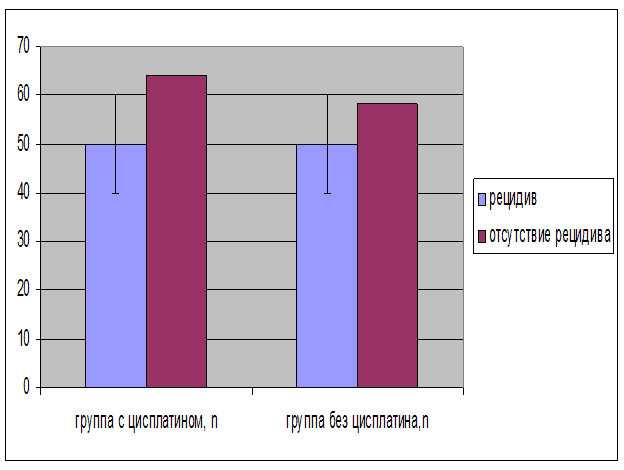
Рис. 7. Терапевтическая эффективность приема Цисплатина и Блеомицина, в зависимости от наличия местных рецидивов (%) Примечание. χ2=1,47, p<0,05.
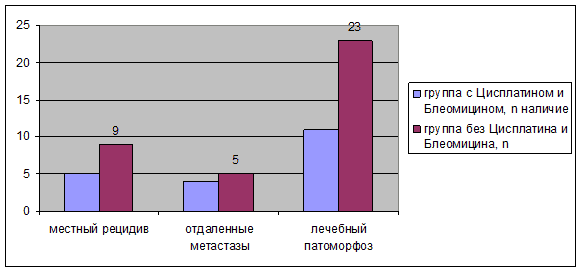
Рис. 8. Результаты комбинированного лечения у пациентов, страдающих раком анального канала, в зависимости от применения Цисплатина и Блеомицина (n)
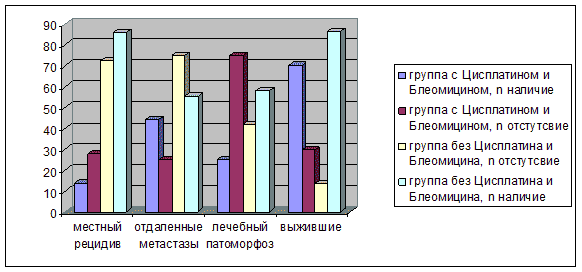
Рис. 9. Результаты комбинированного лечения в зависимости от использования Цисплатина и Блеомицина (%)
| Местный рецидив | Наличие | Отсутствие |
|---|---|---|
| Группа 1 (с использованием Цисплатина и Блеомицина), n=18 n % | 5 13,9 | 13 27,7 |
| Группа 2 (без использования Цисплатина и Блеомицина), n=46 n % | 9 86,1 | 37 72,2 |
Примечание. χ2=1,47, p<0,05.
| Отдаленные метастазы | Наличие (M1) | Отсутствие (M0) |
|---|---|---|
| Группа 1 (с использованием Цисплатина и Блеомицина), n=18 n % | 4 44,4 | 18 25 |
| Группа 2 (без использования Цисплатина и Блеомицина), n=69 n % | 5 55,5 | 64 75 |
Примечание. χ2=2,4, p<0,05.
| Отдаленные метастазы | Наличие (M1) | Отсутствие (M0) | Всего |
|---|---|---|---|
| Группа 1 (с использованием Цисплатина и Блеомицина), n=22 | 44,4 % | 25 % | 24,1 % |
| Группа 2 (без использования Цисплатина и Блеомицина), n=69 | 55,5 % | 75 % | 75,8 % |
Примечание. χ2=2,4, p<0,05.
Наличие лечебного патоморфоза чаще определялась в группе пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, χ2=1,7, ДИ 0,085-1,615, p<0,05 (рис. 8).
В группе пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, наличие лечебного патоморфоза составляет 68 % случаев (n=11) и в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина - 32 % случаев (n=23). То есть определяется тенденция наличия лечебного патоморфоза в гистологическом срезе в группе пациентов, без использования Цисплатина и Блеомицина (рис. 10).
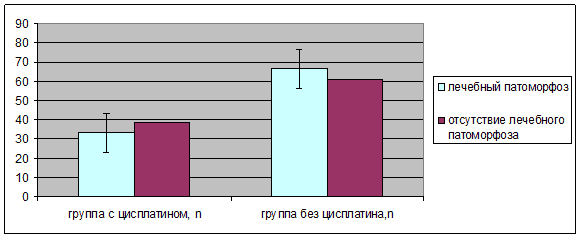
Рис. 10. Лечебный патоморфоз в гистологическом срезе опухоли, в зависимости от использования Цисплатина и Блеомицина (%)
Так изменение относительного риска наличия лечебного патоморфоза в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, к абсолютному риску группы пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, ниже, чем его изменение относительно абсолютного риска группы пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина.
Отсутствие периневральной инвазии в гистологическом срезе злокачественной опухоли рака анального канала, в 2 раза выше в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, по сравнению с группой пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина, χ2=1,85, ДИ 0,1-1,9, р<0,05 (табл. 6).
| Периневральная инвазия | Наличие | Отсутствие | Всего |
|---|---|---|---|
| Группа 1 (с использованием Цисплатина и Блеомицина), n=22 n % | 3 14 | 19 86 | 22 28 |
| Группа 2 (без использования Цисплатина и Блеомицина), n=55 n % | 4 7,2 | 51 92,7 | 55 72 |
Примечание. χ2=1,85, p<0,05.
Тогда абсолютный риск наличия лечебного патоморфоза в группе пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина выше, по сравнению к абсолютному риску терапевтического эффекта группы с применением Цисплатина и Блеомицина (0,428<0,75).
|0,24-0,42|/0,42<|0,24-0,42|/0,24
|0,18| / 0,42 < |0,18| / 0,24
0,428<0,75, p<0,05
Снижение относительного риска составляет 0,42.
Относительный риск наличия лечебного патоморфоза составляет 0,24/0,42=0,57, Изменение относительного риска составляет 0,42. Т. е. 0,42<0,54. Отмечается снижение относительного риска (табл. 7).
| Лечебный патоморфоз опухоли | Наличие | Отсутствие | Всего |
|---|---|---|---|
| Группа 1 (с использованием Цисплатина и Блеомицина), n=45 n % | 11 25 | 34 75 | 45 45 |
| Группа 2 (без использования Цисплатина и Блеомицина), n=54 n % | 23 42 | 31 58 | 54 55 |
Примечание. χ2=1,7, p<0,05.
Ранее проводимые клинические исследования определили, что на степень злокачественности опухоли влияют такие молекулярно-биологические маркеры, как CDX-2, Цитокератин 20 (CK20), а также p53. Известно, что экспрессия молекулярно-биологических маркеров, обуславливает новый морфологический вариант опухоли, после проведенного, комбинированного противоопухолевого лечения. Поэтому необходимо продолжить данные исследования, в том числе изучать действие химиопрепаратов, применяемых в стандартах и протоколах комбинированного лечения, их терапевтическую эффективность [4, 5, 6].
Выводы
|
 |
 |
1. Пациенты, страдающие раком анального канала, подвергшиеся комбинированному противоопухолевому лечению, чаще всего имеют благоприятный исход заболевания. Среди гистологических вариантов наиболее часто встречается аденокарцинома в возрасте с медианой до 68 лет - в 58,4 % случаев, после 68 лет - в 41,5 % случаев, (всего n=65), по сравнению с плоскоклеточным раком: в возрасте до 58 лет - 42,8 % случаев, после 58 лет - в 57,1 % случаев (всего n=34).
2. Терапевтический эффект комбинированного противоопухолевого лечения, в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, выше, по сравнению с группой пациентов, страдающих раком анального канала, без использования Цисплатина и Блеомицина. Различия статистически достоверны в группе выживших (χ2=3,38) и группе с наличием отдаленных метастазов (χ2=2,4), p<0,05.
3. Микроскопические изменения в гистологическом срезе злокачественной опухоли, пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, характеризуются снижением частоты определения периневральной инвазии опухоли, χ2=1,85. Однако наличие лечебного патоморфоза опухоли в гистологических срезах в группе пациентов, страдающих раком анального канала, с использованием Цисплатина и Блеомицина, не выявил статистически значимых различий, χ2=1,7, p<0,05.
Список источников |
 |
 1. Барсуков Ю.А. Полирадиомодификация в комбинированном лечении рака анального канала. - М., 2009. - 96 c.
1. Барсуков Ю.А. Полирадиомодификация в комбинированном лечении рака анального канала. - М., 2009. - 96 c. 2. Гордеев С.С., Расулов А.О., Назаренко А.В., Ткачёв С.И., Сураева Ю.Э., Федонин М.Ю. Плоскоклеточный рак анального канала как редкое заболевание и "драгоценная" порода" // Вестник ФГБУ "РОНЦ им. Н.Н. Блохина". - 2015. - Т. 26, № 2. - С. 5-13.
2. Гордеев С.С., Расулов А.О., Назаренко А.В., Ткачёв С.И., Сураева Ю.Э., Федонин М.Ю. Плоскоклеточный рак анального канала как редкое заболевание и "драгоценная" порода" // Вестник ФГБУ "РОНЦ им. Н.Н. Блохина". - 2015. - Т. 26, № 2. - С. 5-13. 3. Замай Т.Н. Старков А.К., Снижение токсичности цисплатина путем его конъюгации с арабиногалактаном // Биологические мембраны. - 2020. - Т. 37, № 1. - С. 69-75.
3. Замай Т.Н. Старков А.К., Снижение токсичности цисплатина путем его конъюгации с арабиногалактаном // Биологические мембраны. - 2020. - Т. 37, № 1. - С. 69-75. 4. Зенюкова Т.В. Перевощиков А.Г. Белки клеточного цикла, индуцирующие опухолевую прогрессию при раке анального канала, их прогностическое значение // Здоровье и образование в ХХI веке. - 2018. - Т. 20, № 97. - С. 46-51.
4. Зенюкова Т.В. Перевощиков А.Г. Белки клеточного цикла, индуцирующие опухолевую прогрессию при раке анального канала, их прогностическое значение // Здоровье и образование в ХХI веке. - 2018. - Т. 20, № 97. - С. 46-51.  5. Зенюкова Т.В., Перевощиков А.Г., Кузьмичев Д.В., Барсуков Ю.А. Ядерный пролиферативный антиген и степень лечебного патоморфоза в клетках аденокарциномы после комплексного лечения // Российский онкологический журнал. - 2014. - Т. 5. - С. 42-46.
5. Зенюкова Т.В., Перевощиков А.Г., Кузьмичев Д.В., Барсуков Ю.А. Ядерный пролиферативный антиген и степень лечебного патоморфоза в клетках аденокарциномы после комплексного лечения // Российский онкологический журнал. - 2014. - Т. 5. - С. 42-46. 6. Зенюкова Т.В. Морфологические и иммуноморфологические критерии диагностики и прогноза при аноректальном раке // Здоровье и образование в ХХI веке. - 2017. - Т. 19, № 7. - С. 142-146.
6. Зенюкова Т.В. Морфологические и иммуноморфологические критерии диагностики и прогноза при аноректальном раке // Здоровье и образование в ХХI веке. - 2017. - Т. 19, № 7. - С. 142-146. 7. Клинические рекомендации по диагностике и лечению рака ободочной кишки / В.С. Ананьев, Е.В. Артамонова, С.И. Ачкасов. - М., 2014. - C. 5-7.
7. Клинические рекомендации по диагностике и лечению рака ободочной кишки / В.С. Ананьев, Е.В. Артамонова, С.И. Ачкасов. - М., 2014. - C. 5-7. 8. Кузьмичев Д.В. Комбинированное лечение больных раком прямой кишки с использованием новых вариантов полирадиомодификации. - М., 2009. - 121 c.
8. Кузьмичев Д.В. Комбинированное лечение больных раком прямой кишки с использованием новых вариантов полирадиомодификации. - М., 2009. - 121 c.  9. Лебедько О.А., Рыжавский Б.Я., Жильников Д.И. Влияние субстанции созданной на основе эхинохрома А, на изменения легких новорожденных крыс, обусловленных введением блеомицина // Дальневосточный медицинский журнал. - 2021. - № 2. - С. 41-45.
9. Лебедько О.А., Рыжавский Б.Я., Жильников Д.И. Влияние субстанции созданной на основе эхинохрома А, на изменения легких новорожденных крыс, обусловленных введением блеомицина // Дальневосточный медицинский журнал. - 2021. - № 2. - С. 41-45. 10. Лебедько О.А., Рыжавский Б.Я., Жильников Д.И. Влияние препарата, содержащего эхинохром А, токоферол и аскорбиновую кислоту, на легкие крыс, подвергнутых введению липополисахарида // Дальневосточный медицинский журнал. - 2012. - № 4. - С. 63-66.
10. Лебедько О.А., Рыжавский Б.Я., Жильников Д.И. Влияние препарата, содержащего эхинохром А, токоферол и аскорбиновую кислоту, на легкие крыс, подвергнутых введению липополисахарида // Дальневосточный медицинский журнал. - 2012. - № 4. - С. 63-66. 11. Онкология для практикующих врачей: учебное пособие. - М.: Авторская Академия; Товарищество научных изданий КМК. - 2009. - С. 45.
11. Онкология для практикующих врачей: учебное пособие. - М.: Авторская Академия; Товарищество научных изданий КМК. - 2009. - С. 45. 12. Рыжавский Б.Я., Лебедько О.А., Демидова О.В. Влияние введения блеомицина крысам в конце молочного периода на структуру легких и свободнорадикального окисления в них (отсроченное последствие) // Дальневосточный медицинский журнал. - 2013. - № 2. - С. 81-84.
12. Рыжавский Б.Я., Лебедько О.А., Демидова О.В. Влияние введения блеомицина крысам в конце молочного периода на структуру легких и свободнорадикального окисления в них (отсроченное последствие) // Дальневосточный медицинский журнал. - 2013. - № 2. - С. 81-84. 13. Шелыгин Ю.А., Нечушкин М.И., Рыбаков Е.Г. Опухоли анального канала и перианальной кожи. - М., 2011. - 125 c.
13. Шелыгин Ю.А., Нечушкин М.И., Рыбаков Е.Г. Опухоли анального канала и перианальной кожи. - М., 2011. - 125 c. 14. Dworak O., Keiholz L., Hoffman A. Pathological features o rectal cancer after preoperative radiochemotherapy // Int. J. Colorectal Dis. - 1997. - Vol. 12, № 1. - P. 19-23. doc:10.1007/s003840050072.
14. Dworak O., Keiholz L., Hoffman A. Pathological features o rectal cancer after preoperative radiochemotherapy // Int. J. Colorectal Dis. - 1997. - Vol. 12, № 1. - P. 19-23. doc:10.1007/s003840050072. 15. Glimelius B. Radiation therapy of the epidermoid carcinoma // Int. J. Radiat. Oncol. Biol. and Phys. - 1987. - Vol. 13. - P. 307-312.
15. Glimelius B. Radiation therapy of the epidermoid carcinoma // Int. J. Radiat. Oncol. Biol. and Phys. - 1987. - Vol. 13. - P. 307-312. 16. Jamieson E.R., Lippard S.J. Structure, recognition and processing of cisplatin - DNA adducts // Chem. Rev. 1999. - P. 2467-2498.
16. Jamieson E.R., Lippard S.J. Structure, recognition and processing of cisplatin - DNA adducts // Chem. Rev. 1999. - P. 2467-2498.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

