2022 год № 4
Клиническая медицина
1martiniana.ru@mail.ru, http://orcid.org/0000-0001-6481-751Х
2senkevicholga@yandex.ru, http://orcid.org/0000-0003-4195-2350
4cian_bloodbane@mail.ru
3Детская краевая клиническая больница имени А.К. Пиотровича, Хабаровск, Россия
5,6,7Детская городская клиническая больница имени В.М. Истомина, Хабаровск, Россия
5melnickiy1979@mail.ru
Аннотация:
Ключевые слова:
1martiniana.ru@mail.ru, http://orcid.org/0000-0001-6481-751Х
2senkevicholga@yandex.ru, http://orcid.org/0000-0003-4195-2350
4cian_bloodbane@mail.ru
3Children's Regional Clinical Hospital named after A.K. Piotrovich, Khabarovsk, Russia
5,6,7Munisipal Clinical Hospital named after V.M. Istomin, Khabarovsk
5melnickiy1979@mail.ru
Abstract:
Key words:
Введение |
 |
 |
Перенесенные критические состояния при рождении реализуются в гипоксически-ишемическое поражение органов и систем и наиболее уязвима центральная нервная система (ЦНС) ребенка [12, 15]. Большая часть патологии ЦНС у детей (от задержки психомоторного развития до тяжелых форм детского церебрального паралича (ДЦП)) [2, 12], связана с перенесенной гипоксией и острой асфиксией новорожденных и является наиболее частой причиной госпитализации доношенных новорожденных в отделения реанимации, до 70 % причин детской неврологической инвалидности обусловлены перинатальными факторами [18, 19].
Клинические проявления и последствия перенесенных критических состояний при рождении достаточно изучены [1, 2, 12], как и нейрофизиологические изменения в нервной системе в разные периоды жизни ребенка [4, 5, 8, 12], тогда как биохимические и иммунохимические методы, позволяющие анализировать изменения метаболизма, являющегося определяющим в течении и исходах перинатального гипоксически-ишемического поражения ЦНС, во многом остается неизвестным [3].
Транзиторные состояния в периоде неонатальной адаптации ребенка могут проявляться гипофункцией щитовидной железы и надпочечников, их раннее выявление имеет немаловажное значение, так как даже непродолжительный дефицит тиреоидных гормонов у детей раннего возраста неблагоприятно сказывается на их физическом и, особенно, нервно-психическом развитии [9, 11].
По данным Малиненко З.И. (2009), гипоксия плода, перенесенная на фоне сочетанных анте- и интранатальных факторов риска, имеет ведущее значение в формировании изменений функционального состояния ЦНС и гипофизарно-тиреоидной систем у новорожденных. У детей, перенесших транзиторный гипотиреоз и церебральную гипоксию/ишемию, выявлен дисбаланс тиреоидных гормонов на фоне увеличения объема щитовидной железы, что указывает на высокий риск формирования тиреоидной патологии [11, 14].
В настоящее время объективным способом оценки величины, расположения, структуры, объема щитовидной железы, согласно заключениям экспертов и рекомендациям ВОЗ, стало уточнение ее суммарного объема, измеряемого с помощью ультразвуковой методики - эховолюметрии [11, 20], что может помочь в выработке диагностической и лечебной тактики не только врожденной, но и транзиторной патологии щитовидной железы у новорожденных и детей раннего возраста, а также в оценке эффективности пренатальной йодной профилактики и в определении показаний к постнатальной терапии [11].
Так же, как и явления тиреоидной недостаточности, симптомы нарушения функции надпочечников могут остаться незамеченными или быть принятыми за симптомы поражения ЦНС [11, 14]. Недостаточность коры надпочечников также может утяжелять состояние пациентов в ургентных ситуациях, даже если до этого гипоталамо-гипофизарная система оставалась интактной. Неспособность надпочечников сформировать адекватный ответ и в достаточной степени увеличить концентрацию кортизола при чрезмерном стрессовом воздействии и/или воспалительном заболевании, с чем часто сталкиваются в отделениях реанимации, существенно увеличивает риск смертельного исхода [11]. Заместительная терапия временно компенсирует функциональную недостаточность надпочечников, однако в дальнейшем не исключено возникновение данных изменений в критические периоды развития организма.
Возраст 6-7 лет характеризуется напряженной адаптацией ребенка, повышенной социализацией, нагрузкой на все системы организма [10], и является критическим в отношении реализации реабилитационного потенциала, связанного с ростовым скачком, возросшими физическими и интеллектуальными нагрузками вследствие начала образовательного процесса, личностного взросления и другими адаптационными процессами [12, 13].
Таким образом, поиск дополнительных методов для определения исхода и прогноза состояния здоровья детей в возрасте 6-7 лет, перенесших критические состояния при рождении, определило актуальность, цель и задачи данного исследования.
Цель исследования - определить гормональный оттиск последствий перенесенных при рождении критических состояний у детей 6-7 лет.
Материалы и методы
|
 |
 |
Проведено проспективное, выборочное когортное исследование 66 детей 6-7 летнего возраста, перенесших критические состояния при рождении. Эта группа в ходе исследования была разделена на 2 подгруппы в зависимости от оценки по шкале Апгар при рождении - дети, рожденные с оценкой по шкале Апгар 4 и менее баллов (n=36), составили первую подгруппу, во вторую подгруппу были включены дети, рожденные с оценкой по шкале Апгар более 4 баллов (n=30).
В исследование включались дети, родившиеся у здоровых матерей на сроке гестации 38-41 недели, жительниц города Хабаровска. Возраст женщин составил 18-38 лет (26,8±9,5). Настоящая беременность характеризовалась отсутствием обострений хронических заболеваний, анемии, гестоза. Роды нормальные срочные через естественные родовые пути.
Лабораторные исследования проведены в ЦНИЛ ФГБОУ ВО ДВГМУ Минздрава России, клинические исследования - в КГБУЗ "Детская краевая клиническая больница" имени А.К. Пиотровича, КГБУЗ "Детская городская клиническая больница" имени В.М. Истомина.
Критерии включения: возраст на момент проведения обследования 6-7 лет, срок гестации при рождении 38-41 неделя, перенесенные критические состояния при рождении, информированное согласие законных представителей пациента.
Для изучения лабораторных последствий перенесенных критических состояний при рождении у детей 6-7 лет было проведено исследование ряда гормонов. Выбор линейки гормонов (тиреотропный гормон (ТТГ), свободный тироксин (свТ4), кортизол) для изучения гормонального профиля был обусловлен тем, что ТТГ, свТ4 и кортизол являются "стресс-реализующими" гормонами [7, 14, 15], обеспечивают основные нейрогуморальные регуляторные связи; отражают адаптационные процессы в организме в ответ на любое смещение гомеостаза, увеличивая устойчивость организма к различным воздействиям при стрессе, формируя повышенную резистентность [14]; оказывают значительное влияние на когнитивные процессы и эмоциональность; при дисбалансе проявляясь формированием комплекса нервно-психических нарушений, включая изменения настроения, тревогу, снижение способности к сосредоточению и вниманию [7, 14]. Уровень кортизола повышается при экстремальных ситуациях, патологических состояниях, обострениях соматической патологии, длительных эмоциональных переживаниях, которые характерны для детей 6-7 лет в условиях осознания наличия определенной патологии, а также при неадекватно высокой физической нагрузке.
Исследование проведено с соблюдением этических норм. Все законные представители участников исследования были осведомлены о научной стороне проблемы и дали добровольное информированное согласие на проведение исследования в соответствии со ст. 20 Федерального закона от 21.11.11 № 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации". Исследование одобрено локальным этическим комитетом при ФГБОУ ВО "Дальневосточный государственный медицинский университет" Минздрава России (протокол № от 14.05.2017), проведено согласно этическим принципам проведения медицинских исследований с участием людей в качестве субъектов (Хельсинки, 1964; пересмотр - Шотландия, октябрь 2000).
Статистическая обработка материалов исследования проведена с помощью методов биомедицинской статистики, реализованных в пакете программ Microsoft Office 2010 с использованием коэффициента сопряженности Пирсона, критериев Крамера и Чупрова, точного критерия Фишера (двусторонняя критическая область), прогностических факторов (предикторов) (отношение шансов), t-критерия Стьюдента (с поправкой Бонферроне). Рассчитывались относительные средние показатели и их ошибки, определялась медиана, 25 и 75 процентили, определялся доверительный интервал, максимальные и минимальные значения. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
|
 |
 |
В первой подгруппе исходом перенесенного критического состояния при рождении у абсолютного большинства детей (30 детей, 83,3±6,2 %) был детский церебральный паралич (ДЦП) в различных формах: диплегическая - 36,1±8,0 % (n=13), гиперкинетическая - 27,8±7,5 % (n=10), спастико-кинетическая и гемиплегическая по 11,1±5,2 % (n=4), двойная гемиплегия - 8,3±4,6 % (n=3). У 6 детей первой подгруппы диагностирована резидуальная энцефалопатия с когнитивными и речевыми нарушениями. Почти у половины детей (41,7±8,2 %, n=15) первой подгруппы была диагностирована белково-энергетическая недостаточность 1 степени, остальные дети имели средние для своего возраста и пола показатели физического развития.
Во второй подгруппе только у 3 детей (10,0±5,5 %) был диагностирован ДЦП, у остальных - резидуальная энцефалопатия с когнитивными, речевыми, эмоционально-поведенческими нарушениями. Дети второй подгруппы к возрасту 6-7 лет имели средние росто-весовые показатели развития без выраженных нарушений и физическое развитие определено как мезосоматическое (76,7±7,7 %), гармоничное (90,0±5,5 %).
В первой подгруппе показатели ниже средних наблюдались в два раза чаще, чем во второй (33,3±7,9 % и 16,7±1,2 % соответственно), а средние показатели физического развития достоверно преобладали во второй подгруппе (76,7±7,7 %) (р<0,01), несмотря на то, что в целом достоверной разницы между подгруппами не установлено (р>0,05).
Все дети с рождения находились под наблюдением невролога, 86,4±4,2 % из них - сочетали наблюдение невролога в детской поликлинике по месту жительства с реабилитацией в муниципальных и частных реабилитационных центрах.
У детей 6-7 летнего возраста, кроме определения гормонального профиля, был установлен уровень полового развития ребенка (по шкале Таннера) - дети исследуемых групп соответствовали I стадии (препубертатный период).
Клинически дети имели признаки, обуславливающие как основную патологию, так и влияние дефицита тиреоидных гормонов в виде нарушения когнитивных процессов, эмоциональную лабильность, тревогу, снижение способности к сосредоточению и вниманию. По данным литературы [6, 16, 17] известно, что дисбаланс тиреоидных гормонов может приводить к повышенной восприимчивости организма к инфекционным заболеваниям, в исследуемой нами группе детей "сниженная" резистентность, группа часто болеющих детей, выявлена только в 13,6±4,2 % случаев (n=9). Остальные дети имели "хорошую" резистентность - 83,3±4,6 % (1-3 острых заболеваний в год; joз =0-0,32).
Оценка гормонального профиля позволила установить, что уровень ТТГ в первой подгруппе превышал референсные значения в 38,9±8,1 % случаев (n=14), во второй - в 36,7±8,8 % (n=11), что обусловило необходимость дополнительного обследования (УЗИ щитовидной железы, свТ4) для уточнения диагноза, определения тактики ведения. Средние значения ТТГ и свТ4 в подгруппах не имели значимых отличий (табл. 1).
| Показатели | ТТГ (норма 0,3-4,0 мМЕ/л) | свТ4 (норма 10,3-24,5 нмоль/л) | ||
|---|---|---|---|---|
| 1 подгруппа (n=36) | 2 подгруппа (n=30) | 1 подгруппа (n=36) | 2 подгруппа (n=30) | |
| M±m | 3,51±0,28 | 3,58±0,22 | 14,16±0,57 | 14,01±0,41 |
| Ме | 3,44 (1,39÷5,12) | 3,11 (2,45÷4,53) | 12,69 (11,49÷13,74) | 13,11 (12,09÷14,62) |
| ДИ (95 %) | 2,96÷4,07 | 7,33÷8,67 | 13,02÷15,30 | 13,19÷14,82 |
| Мах | 8,60 | 6,87 | 31,81 | 31,18 |
| Мin | 1,11 | 1,39 | 9,87 | 10,77 |
В обеих группах было зарегистрировано незначительное относительно референсных показателей увеличение свТ4 (11,1±5,2 % (n=4) и 13,3±6,2 % (n=4) соответственно). Учитывая повышения уровня ТТГ и результаты свТ4, проявления субклинического гипотиреоза были оценены нами, как явления эндемического зоба, что послужило основанием для проведения морфометрии щитовидной железы УЗ методом (n=25) детям исследуемой группы.
Диффузное увеличение щитовидной железы с нормальной эхогенностью и васкуляризацией по ЦДК выявлено у 72,0±9,0 % (n=18), при этом у 52,0±10,0 % (n=13) из них в паренхиме железы имелись единичные расширенные фолликулы с коллоидом в центре. Объем щитовидной железы, соответствующий возрастной норме, в группе детей с превышением нормальных значений ТТГ определен у 28,0±9,0 % (n=7), из них у 20,0±8,0 % (n=5) в паренхиме железы выявлены единичные расширенные фолликулы с коллоидом в центре.
Для выявления роли перенесенного при рождении критического состояния на уровень ТТГ в возрасте 6-7 лет было проведено определение отношения шансов и установлено значение ОШ=1,099, что свидетельствует о большей вероятности влияния, перенесенного при рождении критического состояния на уровень ТТГ в 1 подгруппе, но различия не достигали достоверных значений. Величина 95 % ДИ 0,404 - 2,989 подтверждает отсутствие статистической значимой связи между фактором и исходом при уровне значимости p>0,05. Отсутствие достоверных отличий между подгруппами (р>0,05), возможно связано с единым регионом проживанием детей и систематической нейрореабилитацией в связи с основным заболеванием.
Детям с диагностированным субклиническим гипотиреозом проведена терапия йодидом калия в возрастной дозировке (Йодомарин 100 мкг) в течение 3 месяцев, по результатам лечения проведен повторный анализ ТТГ (табл. 2).
| Подгруппы | ТТГ выше нормы | р | |
|---|---|---|---|
| до лечения | после лечения | ||
| 1 подгруппа n=36, абс., % | 14 (38,9±8,1) | 3 (8,3±4,6) | 0,005 |
| 2 подгруппа n=30, абс., % | 11 (36,7±8,8) | 1 (3,3±3,3) | 0,002 |
| После йодтерапии достоверная нормализация ТТГ произошла в 30,6±7,7 % (n=11) и 33,3±8,6 % (n=10) случаев 1 и 2 подгрупп соответственно (р<0,01) (рис. 1). | |||
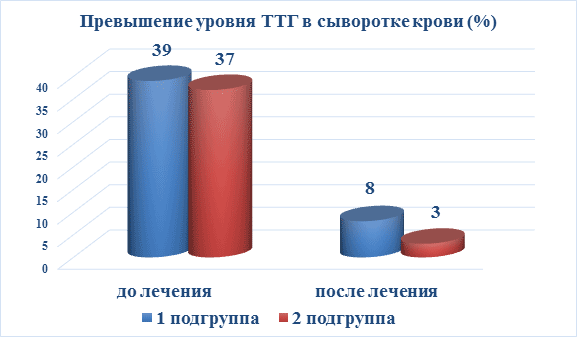
Рис. 1. Данные ТТГ до и после лечения
Транзиторная надпочечниковая недостаточность со снижением уровня кортизола до 73,9 нмоль/л была диагностирована в периоде новорожденности у 52,8±8,3 % детей (n=19) первой и у 30,0±8,4 % детей (n=9) второй подгруппы.
В возрасте 6-7 лет лабораторные признаки гипокортицизма выявлены только в первой подгруппе в 5,6±3,8 % случаев (n=2) со снижением уровня кортизола до 74,13 нмоль/л, клинически сопровождаясь жалобами на слабость, утомляемость, снижение массы тела, частые ОРВИ, аллергические реакции. Средний уровень кортизола в первой подгруппе был достоверно ниже, чем во второй (р<0,01), что послужило основанием для повторного исследования уровня кортизола с учетом суточного биоритма. При индивидуальном ретроспективном анализе установлено, что у этих детей в периоде новорожденности уровень кортизола также был ниже референсных значений и, по данным УЗИ, было диагностировано кровоизлияние с формированием гематомы в одном из надпочечников.
У одного ребенка первой и у двух - второй подгруппы выявлено незначительное превышение уровня кортизола, что возможно, обусловлено стрессовой ситуацией при заборе крови.
При проведении корреляционного анализа выявлена прямая средняя связь между уровнем ТТГ и уровнем кортизола (Rxy=0,47).
Проведенные исследования позволили установить наличие отклонений в гормональном профиле, а, следовательно, и в адаптационных механизмах исследуемой группы детей в отдаленном периоде. У детей в возрасте 6-7 лет, перенесших критические состояния при рождении, были выявлены значения ТТГ выше референсных значений у каждого третьего ребенка и явления гипокортицизма у части детей (4,5±2,6 %), что может быть связано с нарушением обратной связи вследствие поражения ЦНС.
Гипоксия и асфиксия оказывают однонаправленное действие на многие органы и системы детского организма, снижая функцию и адаптационно-приспособительные возможности организма в целом, что подтверждается результатами нашего исследования и формирует необходимость настороженности в отношении развития эндокринной патологии у детей, перенёсших гипоксически-ишемические поражения головного мозга в неонатальном периоде.
Список источников |
 |
 1. Акинина З.Ф. Отдалённые последствия перинатального поражения центральной нервной системы у детей: дис. … канд. мед. наук / З. Ф. Акинина. - Барнаул, 2004. - 125 с.
1. Акинина З.Ф. Отдалённые последствия перинатального поражения центральной нервной системы у детей: дис. … канд. мед. наук / З. Ф. Акинина. - Барнаул, 2004. - 125 с. 2. Александрович Ю.С. Прогнозирование ранних исходов критических состояний у новорожденных / Ю.С. Александрович, Е.В. Паршин, К.В. Пшениснов // Вестник анестезиологии и реаниматологии. - 2012. - Т. 9, № 4. - С. 36-42.
2. Александрович Ю.С. Прогнозирование ранних исходов критических состояний у новорожденных / Ю.С. Александрович, Е.В. Паршин, К.В. Пшениснов // Вестник анестезиологии и реаниматологии. - 2012. - Т. 9, № 4. - С. 36-42. 3. Блинов Д.В. Объективные методы определения тяжести и прогноза перинатального гипоксически-ишемического поражения ЦНС // Акушерство, гинекология и репродукция. - 2011. - № 2. - C. 5-12.
3. Блинов Д.В. Объективные методы определения тяжести и прогноза перинатального гипоксически-ишемического поражения ЦНС // Акушерство, гинекология и репродукция. - 2011. - № 2. - C. 5-12. 4. Дьяконова Е.Н. Последствия легкого перинатального гипоксически-ишемического поражения головного мозга у детей 3-12 лет: возрастные особенности, коррекция: дис. … д-ра мед. наук / Е.Н. Дьяконова. - Иваново, 2009. - 291 с.
4. Дьяконова Е.Н. Последствия легкого перинатального гипоксически-ишемического поражения головного мозга у детей 3-12 лет: возрастные особенности, коррекция: дис. … д-ра мед. наук / Е.Н. Дьяконова. - Иваново, 2009. - 291 с. 5. Задворнов А.А. Биомаркеры перинатального поражения центральной нервной системы / А.А. Задворнов, А.В. Голомидов, Е.В. Григорьев // Неонатология: новости, мнения, обучение. - 2017. - № 1. - С. 47-57.
5. Задворнов А.А. Биомаркеры перинатального поражения центральной нервной системы / А.А. Задворнов, А.В. Голомидов, Е.В. Григорьев // Неонатология: новости, мнения, обучение. - 2017. - № 1. - С. 47-57. 6. Захарова И.С., Малюгина Т.Н. Исследование уровня тиреотропного гормона и гормонов щитовидной железы для оценки процесса адаптации при нейроинфекциях у детей // Саратовский научно-медицинский журнал. - 2018. - № 14 (1). - С. 65-69.
6. Захарова И.С., Малюгина Т.Н. Исследование уровня тиреотропного гормона и гормонов щитовидной железы для оценки процесса адаптации при нейроинфекциях у детей // Саратовский научно-медицинский журнал. - 2018. - № 14 (1). - С. 65-69. 7. Кубасов Р.В. Гормональные изменения в ответ на экстремальные факторы внешней среды // Вестник РАМН. - 2014. - № 9-10. - С. 102-109.
7. Кубасов Р.В. Гормональные изменения в ответ на экстремальные факторы внешней среды // Вестник РАМН. - 2014. - № 9-10. - С. 102-109. 8. Лаврик С.Ю. Последствия перинатальных гипоксических поражений центральной нервной системы у детей дошкольного и раннего школьного возраста: автореф. дис. … д-ра мед. наук / С.Ю. Лаврик. - Иркутск, 2015. - С. 44.
8. Лаврик С.Ю. Последствия перинатальных гипоксических поражений центральной нервной системы у детей дошкольного и раннего школьного возраста: автореф. дис. … д-ра мед. наук / С.Ю. Лаврик. - Иркутск, 2015. - С. 44. 9. Логачева Т.С. Возможности ультразвукового исследования в диагностике заболеваний щитовидной железы у новорожденных и детей первого года жизни: автореф. дисс. … канд. мед. наук. - М., 2004. - 23 с.
9. Логачева Т.С. Возможности ультразвукового исследования в диагностике заболеваний щитовидной железы у новорожденных и детей первого года жизни: автореф. дисс. … канд. мед. наук. - М., 2004. - 23 с. 10. Люленкова О.Ю. Факторы адаптации детей к школе / О. Ю. Люленкова // Современная психология: материалы Междунар. науч. конф. (г. Пермь, июнь 2012 г.). - Пермь: Меркурий, 2012. - С. 84-87.
10. Люленкова О.Ю. Факторы адаптации детей к школе / О. Ю. Люленкова // Современная психология: материалы Междунар. науч. конф. (г. Пермь, июнь 2012 г.). - Пермь: Меркурий, 2012. - С. 84-87. 11. Малиненко З.И. Варианты морфофункциональных нарушений щитовидной железы у детей раннего возраста, перенесших неонатальный транзиторный гипотиреоз и церебральную гипоксию-ишемию: диссертация ... канд. мед. наук / З.И. Малиненко. - М., 2009. - 152 с.
11. Малиненко З.И. Варианты морфофункциональных нарушений щитовидной железы у детей раннего возраста, перенесших неонатальный транзиторный гипотиреоз и церебральную гипоксию-ишемию: диссертация ... канд. мед. наук / З.И. Малиненко. - М., 2009. - 152 с. 12. Попова К.Е., Сенькевич О.А., Бажанова Ю.В. Проспективное исследование зрительных и слуховых функций у детей дошкольного и младшего школьного возраста, перенесших критические состояния при рождении. Дальневосточный медицинский журнал. - 2016. - № 4. - С. 31-36.
12. Попова К.Е., Сенькевич О.А., Бажанова Ю.В. Проспективное исследование зрительных и слуховых функций у детей дошкольного и младшего школьного возраста, перенесших критические состояния при рождении. Дальневосточный медицинский журнал. - 2016. - № 4. - С. 31-36. 13. Преодоление кризиса 6-7 лет в условиях преемственной работы ДОУ и начальной школы / Г.Г. Крылова // Педагогика: традиции и инновации: материалы V Междунар. науч. конф. (г. Челябинск, июнь 2014 г.). - Челябинск: Два комсомольца, 2014. - С. 52-54.
13. Преодоление кризиса 6-7 лет в условиях преемственной работы ДОУ и начальной школы / Г.Г. Крылова // Педагогика: традиции и инновации: материалы V Междунар. науч. конф. (г. Челябинск, июнь 2014 г.). - Челябинск: Два комсомольца, 2014. - С. 52-54. 14. Сапронов Н.С., Масалова О.О. Нейрофизиологические эффекты тиреоидных гормонов // ПФБН. - 2007. - № 2. - С. 1533-1541.
14. Сапронов Н.С., Масалова О.О. Нейрофизиологические эффекты тиреоидных гормонов // ПФБН. - 2007. - № 2. - С. 1533-1541. 15. Серикова И.Ю., Воробьева Е.Н., Шумахер Г.И. Лабораторные маркеры отдаленных последствий перинатального поражения ЦНС у подростков // Journal of Siberian Medical Sciences. - 2013. - № 2. - С. 21.
15. Серикова И.Ю., Воробьева Е.Н., Шумахер Г.И. Лабораторные маркеры отдаленных последствий перинатального поражения ЦНС у подростков // Journal of Siberian Medical Sciences. - 2013. - № 2. - С. 21. 16. Халимов Ю.Ш., Рубцов Ю.Е., Гусев Р.В., Чеховских Ю.С., Кузьмич В.Г., Геращенко Е.В.. Внебольничная пневмония тяжелого течения: патофизиологические особенности тиреоидного статуса // Здоровье. Медицинская экология. Наука. - 2015. - № 60 (2). - С. 50-54.
16. Халимов Ю.Ш., Рубцов Ю.Е., Гусев Р.В., Чеховских Ю.С., Кузьмич В.Г., Геращенко Е.В.. Внебольничная пневмония тяжелого течения: патофизиологические особенности тиреоидного статуса // Здоровье. Медицинская экология. Наука. - 2015. - № 60 (2). - С. 50-54. 17. Черных Н.М., Карноухова О.Г. Микробный пейзаж полости носа у пациентов с симптомами ринита на фоне тиреоидной дисфункции. Российская оториноларингология. - 2015. - № 1 (74). - С. 132-134.
17. Черных Н.М., Карноухова О.Г. Микробный пейзаж полости носа у пациентов с симптомами ринита на фоне тиреоидной дисфункции. Российская оториноларингология. - 2015. - № 1 (74). - С. 132-134. 18. Effect of neonatal resuscitation courses on long-term neurodevelopmental outcomes of newborn infants with perinatal asphyxia / R. Duran, I. Gorker, B. Acunas [et al.] // Pediatr. Int. - 2012. - Vol. 54, № 1. - P. 56-59.
18. Effect of neonatal resuscitation courses on long-term neurodevelopmental outcomes of newborn infants with perinatal asphyxia / R. Duran, I. Gorker, B. Acunas [et al.] // Pediatr. Int. - 2012. - Vol. 54, № 1. - P. 56-59. 19. Pin T.W. A review of developmental outcomes of term infants with post-asphyxia neonatal encephalopathy / T.W. Pin, B. Eldridge, M.P. Galea // Eur. J. Paediatr. Neurol. - 2009. - Vol. 13, № 3. - P. 224-234.
19. Pin T.W. A review of developmental outcomes of term infants with post-asphyxia neonatal encephalopathy / T.W. Pin, B. Eldridge, M.P. Galea // Eur. J. Paediatr. Neurol. - 2009. - Vol. 13, № 3. - P. 224-234. 20. Smutec D., Sara R., Jiskra J., Tesar L. Ultrasound of thyroid gland what is hidden inside and physician does not see // XVI European congress of ultrasound in Medicine and Biology. - 2004. - P. 57.
20. Smutec D., Sara R., Jiskra J., Tesar L. Ultrasound of thyroid gland what is hidden inside and physician does not see // XVI European congress of ultrasound in Medicine and Biology. - 2004. - P. 57.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

