2024 год № 1
Обзоры литературы
2Институт повышения квалификации специалистов здравоохранения, Хабаровск, Россия, elvott@mail.ru, https://orcid.org/0000-0002-2365-5734
Аннотация:
Ключевые слова:
2Institute for Advanced Training of Healthcare Professionals, Khabarovsk, Russia, elvott@mail.ru, https://orcid.org/0000-0002-2365-5734
Abstract:
Key words:
Введение |
 |
 |
В настоящее время распространенность гиперурикемии (ГУ) возрастает с каждым годом, ее частота среди населения России составляет 16,7 %, среди мужчин - 25,3 % [1], в основном это связано с изменением образа жизни современного поколения, которое ведет малоподвижный образ жизни, употребляет большое количество пуринов и сахара с продуктами питании; растет распространенность ожирения.
Обсуждение
|
 |
 |
Гиперурикемией следует считать повышение уровня мочевой кислоты (МК) в сыворотке крови >360 мкмоль/л у женщин и >420 мкмоль/л у мужчин. Если клинические симптомы подагры отсутствуют, то ГУ считается бессимптомной [2].
Асимптомная гиперурикемия может подразделяться на ГУ без кристаллов моноурата натрия (МУН) и с наличием последних [3], так как кристаллы МУН могут быть обнаружены еще до возникновения первого подагрического артрита [4]. Наиболее часто гиперурикемия встречается у мужчин после 30 лет и у женщин в менопаузе. Сдерживающим фактором у женщин до менопаузы являются эстрогены, которые обладают урикозурическим эффектом [5].
При длительно персистирующем высоком уровне мочевой кислоты в крови увеличивается риск развития подагры и мочекаменной болезни. Однако исследование Dalbeth N., Phipps-Green A., Frampton C. с соавторами показало низкую вероятность развития подагры у пациентов с ГУ. Так, при уровне МК 420-480 мкмоль/л подагра развивалась менее чем у 1 из 11 пациентов в течение 15 лет наблюдения [6, 7].
Подагра определяется как хроническое системное метаболическое заболевание, связанное с нарушением пуринового обмена, вследствие чего в крови повышается уровень МК, в тканях откладываются кристаллы натриевой соли МК (ураты), что клинически проявляется рецидивирующим острым артритом, хроническим воспалением, формированием подагрических узлов (тофусов) [2].
Кристаллы моноуратов натрия могут откладываться не только в параартикулярных тканях. Описаны случаи обнаружения кристаллов в коронарных артериях, предстательной железе [8], в грудном позвонке [9].
Появляется все больше доказательств, что бессимптомная ГУ может быть предиктором развития не только подагры, но и гипертонии, ожирения, сахарного диабета и хронической болезни почек [10, 11, 12].
Ранее считалось, что ГУ является следствием хронических неинфекционных заболеваний, однако ГУ может быть предшественником развития и прогрессирования данных состояний [13, 14]. Так, в 5-летнем наблюдении за 5 899 людьми без сопутствующих заболеваний, проведенном в Японии, исследователи доказали, что гиперурикемия была связана с повышенным уровнем заболеваемости артериальной гипертензией (14,9 % против 6,1 %, p<0,001), дислипидемией (23,1 % против 15,5 %, p<0,001), хронической болезнью почек (19,0 % против 10,7 %, р<0,001) и избыточной массой тела/ожирением (8,9 % против 3,0 %, р<0,001), а также сахарным диабетом (1,7 % против 0,9 %, р=0,087) [15].
Одним из механизмов образования и прогрессирования данных заболеваний является развитие воспалительной реакции в организме, и, как следствие, является запуск каскадных реакций, таких как активация ренин-ангиотензин-альдостероновой системы, развитие оксидативного стресса, пролиферация гладкомышечных клеток сосудов, дисфункция эндотелия [16]. За развитие воспаления могут отвечать как кристаллическая МК (соли моноурата натрия), так и растворимая мочевая кислота.
Обзор опубликованных данных свидетельствует, каким образом мочевая кислота оказывает воздействие на иммунную систему и может быть связана с воспалительными процессами.
Метаболизм мочевой кислоты
Мочевая кислота является продуктом распада пуринов (гуанина и аденина) и пуринсодержащих соединений (нуклеиновые кислоты, аденозинтрифосфат (АТФ)). Также МК может образовываться из рибозо-5-фосфата. Под действием 5-фосфорибозил-1-пирофосфат (ФРПФ)-синтазы и ФРПФ-аминотрансферазы рибозо-5-фосфат преобразуется в инозиновую кислоту, а последующие процессы биосинтеза метаболизируют ее до ксантина, и далее до МК [2].
У большинства млекопитающих сывороточные концентрации циркулирующей формы мочевой кислоты относительно низки (1-3 мг/дл) из-за присутствия уриказы (также известной как уратоксидаза), фермента в печени (или иногда в почках), которая разлагает мочевую кислоту до 5-гидроксиизоурата и, в конечном итоге, до аллантоина [17]. Но у птиц, большинства рептилий, а также у ряда гомоноидов (орангутанги, шимпанзе, гориллы, человек), уриказа отсутствует ввиду длительной мутации гена, устраняющего уриказу [18].
Потеря физиологической уриказы эволюционно помогла млекопитающим приспособиться к жизни на земле. Во-первых, МК способна регулировать кровяное давление, стимулировать запасы жира и глюконеогенез [18, 19, 20], во-вторых, она отвечает за умственную работоспособность, энергоемкость, время реакции и импульсивность [21, 22], в-третьих, МК может оказывать противодействие окислительному повреждению, связанному с атеросклерозом и старением у людей [23].
В отдельном экспериментальном исследовании было показано, что мочевая кислота является мощным антиоксидантом и поглотителем молекул кислорода и свободных радикалов, происходит защита эритроцитов от перекисного окисления липидов и от пероксидативного повреждения, приводящего к лизису [24].
Основная часть МК из организма выводится через почки (около 85 %). Данные процессы происходят с помощью белков транспортеров в проксимальных канальцах почек. URAT1, GLUT9, ОАТ4 и ОАТ10 участвуют в реабсорбции уратов на уровне апикальной мембраны клеток проксимальных почечных канальцев; GLUT9 отвечает за транспорт уратов из клетки через базолатеральную мембрану в кровь; ABCG2 является однонаправленным переносчиком, отвечающим за секрецию уратов через апикальную мембрану; ОАТ1 и ОАТ3, локализованные на базолатеральной мембране, участвуют в экскреции уратов [25, 26] (рисунок). Часть МК проходит в тонкий кишечник через GLUT9 и АТФ-связывающий транспортер подсемейства G (ABCG2) [27, 28, 29], расположенные на апикальной мембране клеток, экскретирует почечные ураты.
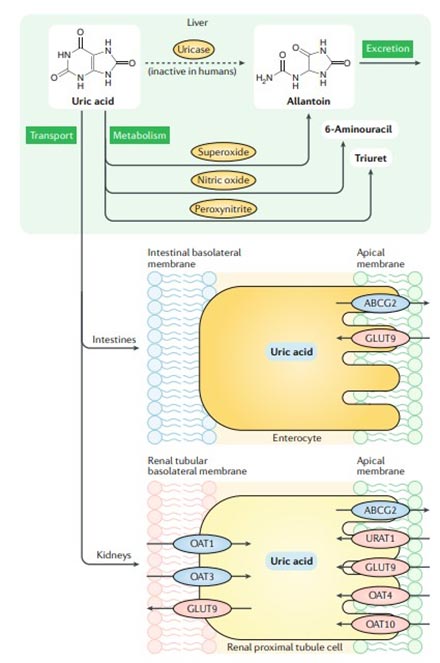
Рис. Метаболизм мочевой кислоты
Примечание. Почки отвечают, как за реабсорбцию, так и за выведение мочевой кислоты из организма. URAT1, GLUT9, ОАТ4 и ОАТ10 - основные транспортеры реабсорбции МК в проксимальных канальцах почек, а ABCG2-основной транспортер экскреции. В тонком кишечнике основной транспортер - ABCG2 [26].
Причины гиперурикемии
Наиболее часто ГУ встречается у пациентов, которые придерживаются диет с высоким содержанием сахара (который содержит фруктозу), пуринов (особенно из животных белков) и алкоголя (особенно пива). Также прием некоторых препаратов может способствовать развитию ГУ (например, тиазидовые и петлевые диуретики, низкие дозы аспирина).
Нередко развитие гиперурикемии связано не только с избыточным поступлением большого количества пуринов, но и с недостаточным её выведением из организма. Доказано, что ожирение, инсулинорезистентность и гипертония связаны со снижением экскреции уратов. Например, в ходе наблюдения было показано, что гиперинсулинемия не влияла на концентрацию МК в сыворотке, но вызывала значительное снижение экскреции МК с мочой [30].
Как уже упоминалось выше, длительное наличие гиперурикемии может увеличить риски развития нефролитиаза. Но данное состояние также может развиваться при повышенной экскреции уратов после высвобождения большого количества ДНК и РНК, например, во время повреждения тканей или лизиса опухоли, как можем наблюдать это при химиотерапии. Из-за быстрого разрушения опухоли, увеличивается концентрации мочевой кислоты в моче, что может приводить к урикозурии с образованием кристаллов и, как осложнение, к внутриканальцевой обструкции [31, 32].
Развитие воспаления при гиперурикемии
Воспаление - это реакция врожденной иммунной системы на вредный раздражитель, включая инфекции или повреждение тканей [33]. При гиперурикемии существует несколько путей активации иммунной системы.
Основным и наиболее главным механизмом развития воспаления при наличии моноуратов натрия в организме является стимуляция врожденного иммунного ответа, образование цитокинов, главным из которых является интерлейкин (IL)-1β.
Образующиеся при гиперурикемии моноураты натрия (МУН) задействуют инфламмасому NALP3, активирующую каспазу-1 [34]. Инфламмасома - цитозольный полипротеиновый комплекс, который образуется в ответ на разносторонние внешние и внутренние стимулы, в том числе вирусные и бактериальные инфекции. Главными продуктами инфламмасом являются провоспалительные цитокины: IL-1β и IL-18, что приводит к гиперпродукции IL-1β. В свою очередь, IL-1β активирует каскад процессов для активации провоспалительных и противовирусных генов. Оба этих цитокина образуются путем расщепления активной каспазой-1. Активация каспазы-1 приводит к гибели клеток (пироптоз) [35].
NALP3 инфламмасома в основном реагирует на различные факторы не экзогенной природы, это могут быть изменения окружающей среды или изменения внутри самого организма. Поэтому активация NALP3 инфламмасомы лежит в основе патогенеза при развитии атеросклероза, сахарного диабета 2 типа, подагры, фиброза и нейродегенеративных заболеваний [35, 36]. Активация NALP3 инфламмасомы происходит за счет, с одной стороны, прайминга под действием липополисахаридов (LPS), с другой стороны, за счет экзогенного синтеза АТФ-рецептора Р2Х7, что в свою очередь, быстро активирует каспазу-1 и приводит к утечке калия в цитозоле инфламмасомы. Запуск каспазы-1, ведет к выходу зрелых форм IL-1β и IL-18 из клетки [37, 38].
Есть еще один путь воспаления - это накопление белка/гена р62, которое происходит за счет воздействия кристаллов моноурата натрия, вызывая нестабильность лизосом с последующим нарушением аутофагии. Данные процессы ведут к активации ядерного транскрипционного фактора 2 (NRF2), что в последующем запускает транскрипцию генов, кодирующих антиоксидативные ферменты [39].
Кристаллы МУН подавляют фосфорилирование AMPK (AMP-активируемая протеинкиназа), усиливая провоспалительную поляризацию М2 макрофагов, экспрессию гена NLP3, активацию каспазы-1 и IL-1b [40].
Еще один вариант развития воспалительной реакции в организме, несвязанный с активацией инфламмасомы, это воздействие на нейтрофилы. Дипептидилпептидаза I (DPPI) - это цистеиновая протеаза, которая необходима для активации нейтрофильных сериновых протеаз (NSP), катепсина G, нейтрофильной эластазы и протеиназы 3 (PR3), которые являются ферментами, модулирующими воспаление [41]. Данный процесс запускается при большом притоке клеток, в ответ на их повреждение и гибель под воздействием МУН. Нейтрофильная эластаза и протеиназа 3 (PR3) могут задействовать неактивный предшественник IL-1b через ограничение протеолиза, что приводит к созреванию IL-1 [42, 43].
В защиту нейтрофилов, они способны и подавлять развитие воспаления при подагрическом артрите. С5а (комплимент 5а), образующийся на воздействие моноуратами натрия, подготавливает воспаление и продукцию IL-1b. Нейтрофильные микровезикулы высвобождают фосфотидилсерин (PS) и ингибируют прайминг воспаления, запущенный С5а [44]. Кроме того, нейтрофилы способы образовывать нейтрофильные ловушки, которые устраняют воспаление за счет протеолиза цитокинов и хемокинов и защиты нейтрофильной эластазы от α1-антитрипсина [45].
Развитие оксидативного стресса в условиях присутствия МК
Мочевая кислота считается классическим антиоксидантом в организме человека, который способен защищать от старения, рака и окислительного (оксидативного) стресса. Но так ли это на самом деле? Повышенный уровень МК связан и с развитием окислительного стресса.
Оксидативный стресс - это повреждение клетки, связанное с окислением. В результате дисбаланса окислительно-восстановительных процессов возникают токсические изменения с образованием свободных радикалов, повреждающих компоненты клеток, липиды, ДНК [46].
Оксид азота (NO) - самая главная молекула, регулирующая деятельность многих систем организма. Мочевая кислота, реагируя с NO, приводит к образованию 6-аминоурацила и истощению запасов NO, данный патогенез ведет к эндотелиальной дисфункции, при которой количество МК увеличивается [47].
Эндотелиальная дисфункция, связанная с высоким уровнем МК, также может быть опосредована митохондриальными нарушениями. Sanchez-Lozada L.G. с соавторами доказали снижение массы митохондрий и продукции АТФ в условиях гиперурикемии. Данные процессы происходили путем уменьшения активности аконитазы-2 и экспрессии еноил-КоА-гидратазы-1 (участвующей в продукции активных форм кислорода) под воздействием МК [48].
Исследование Sautin Y., Nakagawa T., Zharikov S., Johnson R. показало связь растворенной МК и усиление активности НАДФН-оксидазы и продукции активных форм кислорода в зрелых адипоцитах, что приводило к активации митоген-активируемой протеинкиназы (МАР-киназы) р38 и ERK1/2, снижению биодоступности оксида азота, усилению окисления липидов. То есть ГУ провоцировала окислительный стресс в адипоцитах, что является одним из звеньев патогенеза инсулинорезистентности и развития сердечно-сосудистых заболеваний [49].
В другом исследовании доказан эффект МК по увеличению экспрессии мРНК циклооксигеназы-2(ЦОГ-2), активацию NF-kB и белка-активатора 1 в гладкомышечных клетках сосудов. Данные явления усиливают пролиферацию гладкомышечных клеток, которая играет важную роль в росте сердечно-сосудистых заболеваний [50].
Все описанные провоспалительные эффекты могут быть связаны с развитием хронических неинфекционных заболеваний (сердечно-сосудистые заболевания, хроническая болезнь почек, метаболические нарушения). Но одной из ведущих является связь гиперурикемии в развитии хронической болезни почек.
Хроническая болезнь почек
Хроническая болезнь почек (ХБП) - это персистирующее в течение трех месяцев или более поражение органа вследствие действия различных этиологических факторов, анатомической основой которого является процесс замещения нормальных анатомических структур фиброзом, приводящий к его дисфункции [51].
Не всегда понятно, что явилось первичным: гиперурикемия, которая привела к прогрессированию ХБП или заболевания почек, на фоне которых развивается вторичная гиперурикемия. Наблюдается своего рода порочный круг.
В ходе наблюдения за 177 570 пациентами в Северной Калифорнии развитие терминальной почечной недостаточности (ТПН) было связано с повышением уровня мочевой кислоты. В два раза увеличивались риски развития ТПН у пациентов с высоким уровнем МК (6,0-14,9 мг/дл), по сравнению с пациентами с нормальными значениями МК в сыворотке крови [52].
К патогенетическим механизмам, влияющим на развитие и прогрессирование повреждения почечной ткани, относится иммунное воспаление (о чем было рассказано выше), активация ренин-ангиотензин-альдостероновой системы (РААС), оксидативный стресс, пролиферация гладкомышечных клеток сосудов с исходом в ангиосклероз, дисфункция эндотелия, прогрессирующий атеросклероз, гломерулосклероз, интерстициальный фиброз [10, 16].
Повышение уровня МК в крови увеличивает восприимчивость клеток проксимальных канальцев почек к апоптозу, запуская путь, включающий передачу сигналов NADPH-оксидазой и транспорт URAT-1, что провоцирует хроническое тубулоинтерстициальное повреждение [53].
Активация системы РААС в условиях ГУ, приводит к вазоконстрикции почечных сосудов, что ведет к нарушению почечного кровотока. Пролиферация ГМК сосудов вызывает ишемию почечной ткани. В экспериментальном исследовании на крысах с гиперурикемией, возникала артериолопатия прегломерулярных сосудов, что вело к клубочковой гипертензии и, как следствие, к гипоперфузии. Данные процессы провоцировали тубулоинтерстициальное воспаление и фиброз [54].
Отложение моноуратов натрия в почечной ткани и канальцах почек еще один фактор прогрессирования ХБП [55, 56]. Отложение происходит преимущественно в собирательных канальцах почек, в ответ на которое возникает местная воспалительная реакция, что может спровоцировать разрыв стенки канальца и выход кристаллов МУН в интерстицию [57].
Уратснижающая терапия
В крупном метаанализе, при участии 1211 пациентов с ХБП, в результате применения уратснижающих препаратов (в основном аллопуринол и фебуксостат), наблюдалось достаточное снижение рисков развития почечной недостаточности на 55 %, сердечно-сосудистых катастроф на 60 %, умеренное снижение протеинурии (на 0,23 стандартной девиации) и расчетной СКФ на 4,10 мл/мин./1,73 м? в год [58].
В 7-летнем рандомизированном исследовании, которое включало 113 пациентов, назначение уратснижающей терапии (аллопуринола) значительно уменьшало риск развития почечной недостаточности на 68 %, а риск сердечно-сосудистых осложнений на 57 % [59].
В настоящее время в России используются два препарата для уратснижающей терапии - ингибиторы ксантиноксидазы (Аллопуринол и Фебуксостат). Необходимо помнить о периоде полувыведения препаратов и путях их выведения из организма при назначении пациентам, в особенности пациентам с ХБП.
Нефропротективный эффект отмечается в большей степени у фебуксостата, что подтверждается данными недавнего метаанализа. В ходе исследований фебуксостат значительно улучшил рСКФ и снизил соотношение альбумин/креатинин в моче по сравнению с плацебо [60].
Данный эффект развивается ввиду того, что аллопуринол выводится преимущественно через почки и при ХБП период его полувыведения может достигать недели. В то время как фебуксостат после приема внутрь до 80 % абсорбируется в желудочно-кишечном тракте и элиминируется в основном через ЖКТ, следовательно, при ХБП нет необходимости в корректировке дозы в зависимости от СКФ. Эффективное снижение уровня МК на фоне приема фебуксостата происходит также вследствие его подавления активности как окисленной, так и восстановленной формы ксантиноксидазы. Фебуксостат образовывает высокоаффинные связи. Аллопуринол связывается только с одной формой фермента, и эта связь значительно слабее [61, 62, 63].
В 26-недельном мультицентровом рандомизированном двойном слепом исследовании фазы III CONFIRMS фебуксостат продемонстрировал большую эффективность в снижении концентрации мочевой кислоты менее 6 мг/дл в сравнении с аллопуринолом в дозе 200-300 мг у пациентов с подагрой и почечной недостаточностью [64].
Таким образом, можно сделать вывод, что повышение уровня мочевой кислоты, отложение кристаллов моноуратов натрия, развитие подагры не только может снизить качество жизни пациента, но и вызвать "ураган" воспалительных реакций в организме, что будет способствовать развитию хронических неинфекционных заболеваний, в частности ХБП. В этом и заключается актуальность ранней диагностики гиперурикемии, уточнения генеза ГУ, выявление факторов риска и своевременной компенсации состояния, а возможно, и назначение уратснижающей терапии.
Список источников |
 |
 1. Гаранина Е.Е., Мартынова Е.В., Иванов К.Я., Ризванов А.А., Хайбуллина С.Ф. Инфламмасомы: роль в патогенезе заболеваний и терапевтический потенциал // Учен. зап. Казан. ун-та. Сер. Естеств. науки. - 2020. - № 1.
1. Гаранина Е.Е., Мартынова Е.В., Иванов К.Я., Ризванов А.А., Хайбуллина С.Ф. Инфламмасомы: роль в патогенезе заболеваний и терапевтический потенциал // Учен. зап. Казан. ун-та. Сер. Естеств. науки. - 2020. - № 1.  2. Елисеев М.С., Чикаленкова Н.А., Денисов И.С., Барскова В.Г. Факторы риска подагры: половые различия // Научно-практическая ревматология. - 2011. - Т. 49, № 6. - С. 28-31.
2. Елисеев М.С., Чикаленкова Н.А., Денисов И.С., Барскова В.Г. Факторы риска подагры: половые различия // Научно-практическая ревматология. - 2011. - Т. 49, № 6. - С. 28-31.  3. Елисеев М.С. Хроническая болезнь почек: роль гиперурикемии и возможности уратснижающей терапии // Современная ревматология. - 2018. - № 12 (1). - С. 60-65.
3. Елисеев М.С. Хроническая болезнь почек: роль гиперурикемии и возможности уратснижающей терапии // Современная ревматология. - 2018. - № 12 (1). - С. 60-65. 4. Клиническая ревматология. 3-е издание, перработанное и дополненное. Руководство для врачей / Под редакцией В.И. Мазурова. - М.: Е-ното, 2021.
4. Клиническая ревматология. 3-е издание, перработанное и дополненное. Руководство для врачей / Под редакцией В.И. Мазурова. - М.: Е-ното, 2021. 5. Клинические рекомендации - Хроническая болезнь почек (ХБП) - 2021-2022-2023 (24.06.2021) - Утверждены Минздравом РФ.
5. Клинические рекомендации - Хроническая болезнь почек (ХБП) - 2021-2022-2023 (24.06.2021) - Утверждены Минздравом РФ. 6. Меньщикова Е. Окислительный стресс. Прооксиданты и антиоксиданты / Е.Б. Меньщикова, В.З. Ланкин, Н.К. Зенков, И.А. Бондарь, Н.Ф. Круговых, В.А. Труфакин. - М.: Фирма "Слово", 2006. - 556 с.
6. Меньщикова Е. Окислительный стресс. Прооксиданты и антиоксиданты / Е.Б. Меньщикова, В.З. Ланкин, Н.К. Зенков, И.А. Бондарь, Н.Ф. Круговых, В.А. Труфакин. - М.: Фирма "Слово", 2006. - 556 с. 7. Молчанова О.В., Бритов А.Н., Платонова Е.В. Значение повышенного уровня мочевой кислоты в развитии и профилактике хронических неинфекционных заболеваний // Профилактическая медицина. - 2020. - № 23 (2). - С. 102-108.
7. Молчанова О.В., Бритов А.Н., Платонова Е.В. Значение повышенного уровня мочевой кислоты в развитии и профилактике хронических неинфекционных заболеваний // Профилактическая медицина. - 2020. - № 23 (2). - С. 102-108. 8. Сороцкая В.Н., Елисеев М.С. Подагра с тофусом, имитирующим опухоль грудного отдела позвоночника // Научно-практическая ревматология. - 2018. - № 56 (1). - С. 113-116.
8. Сороцкая В.Н., Елисеев М.С. Подагра с тофусом, имитирующим опухоль грудного отдела позвоночника // Научно-практическая ревматология. - 2018. - № 56 (1). - С. 113-116. 9. Шальнова С.А., Деев А.Д., Артамонова Г.В. и др. Гиперурикемия и ее корреляты в Российской популяции (результаты эпидемиологического исследования ЭССЕРФ) // Рациональная фармакотерапия в кардиологии - 2014. - № 10 (2). - Р. 153-159.
9. Шальнова С.А., Деев А.Д., Артамонова Г.В. и др. Гиперурикемия и ее корреляты в Российской популяции (результаты эпидемиологического исследования ЭССЕРФ) // Рациональная фармакотерапия в кардиологии - 2014. - № 10 (2). - Р. 153-159. 10. Ames B.N., Cathcart R., Schwiers E. & Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis // Proc. Natl Acad. Sci. - USA 78. - Р. 6858-6862 (1981).
10. Ames B.N., Cathcart R., Schwiers E. & Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis // Proc. Natl Acad. Sci. - USA 78. - Р. 6858-6862 (1981). 11. Antón F.M., García Puig J., Ramos T., et al. Sex differences in uric acid metabolism in adults: evidence for a lack of influence of estradiol-17 beta (E2) on the renal handling of urate // Metabolism. - 1986. - Vol. 35, № 4. - P. 343-348.
11. Antón F.M., García Puig J., Ramos T., et al. Sex differences in uric acid metabolism in adults: evidence for a lack of influence of estradiol-17 beta (E2) on the renal handling of urate // Metabolism. - 1986. - Vol. 35, № 4. - P. 343-348.  12. Bardin T., Nguyen Q.D., Tran K.M., et al. A cross-sectional study of 502 patients found a diffuse hyperechoic kidney medulla pattern in patients with severe gout // Kidney Int. - 2021. - № 99 (1). - Р. 218-226. DOI: 10.1016/j.kint.2020.08.024.
12. Bardin T., Nguyen Q.D., Tran K.M., et al. A cross-sectional study of 502 patients found a diffuse hyperechoic kidney medulla pattern in patients with severe gout // Kidney Int. - 2021. - № 99 (1). - Р. 218-226. DOI: 10.1016/j.kint.2020.08.024. 13. Becker M.A., Schumacher H.R., Espinoza L., et al. A phase III randomized, controlled, multicenter, double-blind trial comparing efficacy and safety of daily febuxostat and allopurinol in subjects with gout // American College of Rheumatology. - 2008. - Abstr. L11.
13. Becker M.A., Schumacher H.R., Espinoza L., et al. A phase III randomized, controlled, multicenter, double-blind trial comparing efficacy and safety of daily febuxostat and allopurinol in subjects with gout // American College of Rheumatology. - 2008. - Abstr. L11. 14. Brooks G.W. & Mueller E. Serum urate concentrations among university professors; relation to drive, achievement, and leadership // JAMA. - № 195. - Р. 415-418 (1966).
14. Brooks G.W. & Mueller E. Serum urate concentrations among university professors; relation to drive, achievement, and leadership // JAMA. - № 195. - Р. 415-418 (1966).  15. Cumpelik A., et al. Neutrophil microvesicles resolve gout by inhibiting C5a-mediated priming of the inflammasome // Annals of the rheumatic diseases. - Vol. 75. - № 6 (2016). - Р. 1236-1245. DOI:10.1136/annrheumdis-2015-207338.
15. Cumpelik A., et al. Neutrophil microvesicles resolve gout by inhibiting C5a-mediated priming of the inflammasome // Annals of the rheumatic diseases. - Vol. 75. - № 6 (2016). - Р. 1236-1245. DOI:10.1136/annrheumdis-2015-207338. 16. Dalbeth N., Phipps-Green A., Frampton C., et al. Relationship between serum urate concentration and clinically evident incident gout: an individual participant data analysis // Ann Rheum Dis. - 2018. - № 77 (7). - Р. 1048-1052. DOI:10.1136/annrheumdis-2017-212288.
16. Dalbeth N., Phipps-Green A., Frampton C., et al. Relationship between serum urate concentration and clinically evident incident gout: an individual participant data analysis // Ann Rheum Dis. - 2018. - № 77 (7). - Р. 1048-1052. DOI:10.1136/annrheumdis-2017-212288. 17. Dalbeth N., House M.E., Aati O., et al. Urate crystal deposition in asymptomatic hyperuricaemia and symptomatic gout: a dual energy CT study // Ann. Rheum. Dis. - 2015. - Vol. 74, № 5. - P. 908-911.
17. Dalbeth N., House M.E., Aati O., et al. Urate crystal deposition in asymptomatic hyperuricaemia and symptomatic gout: a dual energy CT study // Ann. Rheum. Dis. - 2015. - Vol. 74, № 5. - P. 908-911.  18. Dinarello Charles A. A clinical perspective of IL-1β as the gatekeeper of inflammation // European Journal of Immunology. - Vol. 41,5 (2011). - Р. 1203-1217. doi:10.1002/eji.201141550.
18. Dinarello Charles A. A clinical perspective of IL-1β as the gatekeeper of inflammation // European Journal of Immunology. - Vol. 41,5 (2011). - Р. 1203-1217. doi:10.1002/eji.201141550. 19. Duewell P., Kono H., Rayner K.J., Sirois C.M., Vladimer G., Bauernfeind F.G., Abela G.S., Franchi L., Nuñez G., Schnurr M., Espevik T., Lien E., Fitzgerald K.A., Rock K.L., Moore K.J., Wright S.D., Hornung V., Latz E. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals // Nature. - 2010 Apr 29; 464 (7293). - Р. 1357-1361. DOI: 10.1038/nature08938. Erratum in: Nature. 2010 Jul 29. - № 466 (7306): 652. PMID: 20428172; PMCID: PMC2946640.
19. Duewell P., Kono H., Rayner K.J., Sirois C.M., Vladimer G., Bauernfeind F.G., Abela G.S., Franchi L., Nuñez G., Schnurr M., Espevik T., Lien E., Fitzgerald K.A., Rock K.L., Moore K.J., Wright S.D., Hornung V., Latz E. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals // Nature. - 2010 Apr 29; 464 (7293). - Р. 1357-1361. DOI: 10.1038/nature08938. Erratum in: Nature. 2010 Jul 29. - № 466 (7306): 652. PMID: 20428172; PMCID: PMC2946640. 20. Enomoto A., Kimura H., Chairoungdua A., et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels // Nature. - 2002, May 23; № 417 (6887). - Р. 47-52. DOI: 10.1038/nature742.
20. Enomoto A., Kimura H., Chairoungdua A., et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels // Nature. - 2002, May 23; № 417 (6887). - Р. 47-52. DOI: 10.1038/nature742.  21. Frampton J.E. Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout // Drugs. - 2015. - Vol. 75, № 4. - P. 427-438.
21. Frampton J.E. Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout // Drugs. - 2015. - Vol. 75, № 4. - P. 427-438. 22. Gersch C., Palii S.P., Kim K.M., Angerhofer A., Johnson R.J., Henderson G.N. Inactivation of nitric oxide by uric acid. Nucleosides Nucleotides Nucleic Acids. - 2008. Aug; - № 27 (8). - Р. 967-78. DOI: 10.1080/15257770802257952. PMID: 18696365; PMCID: PMC2701227.
22. Gersch C., Palii S.P., Kim K.M., Angerhofer A., Johnson R.J., Henderson G.N. Inactivation of nitric oxide by uric acid. Nucleosides Nucleotides Nucleic Acids. - 2008. Aug; - № 27 (8). - Р. 967-78. DOI: 10.1080/15257770802257952. PMID: 18696365; PMCID: PMC2701227. 23. Ghonime M.G., Shamaa O.R., Das S., Eldomany R.A., Fernandes-Alnemri T., Alnemri E.S., Gavrilin M.A., Wewers M.D. Inflammasome priming by lipopolysaccharide is dependent upon ERK signaling and proteasome function // J Immunol. - 2014. Apr. 15; № 192 (8). - Р. 3881-3888. DOI: 10.4049/jimmunol.1301974. Epub 2014 Mar 12. PMID: 24623131; PMCID: PMC3980013.
23. Ghonime M.G., Shamaa O.R., Das S., Eldomany R.A., Fernandes-Alnemri T., Alnemri E.S., Gavrilin M.A., Wewers M.D. Inflammasome priming by lipopolysaccharide is dependent upon ERK signaling and proteasome function // J Immunol. - 2014. Apr. 15; № 192 (8). - Р. 3881-3888. DOI: 10.4049/jimmunol.1301974. Epub 2014 Mar 12. PMID: 24623131; PMCID: PMC3980013. 24. Goicoechea M., Garcia de Vinuesa S., Verdalles U., et al. Allopurinol and progression of CKD and cardiovascular events: long-term follow-up of a randomized clinical trial // Am J Kidney Dis. - 2015. Apr; № 65 (4). - Р. 543-549. DOI: 10.1053/j.ajkd.2014.11.016. Epub 2015 Jan 13.
24. Goicoechea M., Garcia de Vinuesa S., Verdalles U., et al. Allopurinol and progression of CKD and cardiovascular events: long-term follow-up of a randomized clinical trial // Am J Kidney Dis. - 2015. Apr; № 65 (4). - Р. 543-549. DOI: 10.1053/j.ajkd.2014.11.016. Epub 2015 Jan 13. 25. Grayson P.C., Kim, S.Y., LaValley M. & Choi H.K. Hyperuricemia and incident hypertension: a systematic review and meta-analysis // Arthritis Care Res. - 2011. - № 63. - Р. 102-110.
25. Grayson P.C., Kim, S.Y., LaValley M. & Choi H.K. Hyperuricemia and incident hypertension: a systematic review and meta-analysis // Arthritis Care Res. - 2011. - № 63. - Р. 102-110.  26. Hahn J., et al. Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases // FASEB journal: official publication of the Federation of American Societies for Experimental Biology. - 2019. - Vol. 33 (1). - Р. 1401-1414. DOI:10.1096/fj.201800752R.
26. Hahn J., et al. Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases // FASEB journal: official publication of the Federation of American Societies for Experimental Biology. - 2019. - Vol. 33 (1). - Р. 1401-1414. DOI:10.1096/fj.201800752R. 27. Hahn K., Kanbay M., Lanaspa M.A., Johnson R.J. & Ejaz A.A. Serum uric acid and acute kidney injury: a mini review // J. Adv. Res. - 2017. - № 8. - Р. 529-536.
27. Hahn K., Kanbay M., Lanaspa M.A., Johnson R.J. & Ejaz A.A. Serum uric acid and acute kidney injury: a mini review // J. Adv. Res. - 2017. - № 8. - Р. 529-536. 28. Hediger M.A., Johnson R.J., Miyazaki H., et al. Molecular physiology of urate transport // Physiology (Bethesda). - 2005. Apr; № 20. - Р. 125-33. DOI: 10.1152/physiol.00039.2004.
28. Hediger M.A., Johnson R.J., Miyazaki H., et al. Molecular physiology of urate transport // Physiology (Bethesda). - 2005. Apr; № 20. - Р. 125-33. DOI: 10.1152/physiol.00039.2004.  29. Hsu C.Y., Iribarren C., McCulloch C.E., et al. Risk factors for end-stage renal disease: 25-year follow-up // Arch. Intern. Med. - 2009. - Vol. 169, № 4. - Р. 342-350.
29. Hsu C.Y., Iribarren C., McCulloch C.E., et al. Risk factors for end-stage renal disease: 25-year follow-up // Arch. Intern. Med. - 2009. - Vol. 169, № 4. - Р. 342-350.  30. Jensen T., et al. Fructose and sugar: a major mediator of non-alcoholic fatty liver disease // J. Hepatol. - № 68. - Р. 1063-1075 (2018).
30. Jensen T., et al. Fructose and sugar: a major mediator of non-alcoholic fatty liver disease // J. Hepatol. - № 68. - Р. 1063-1075 (2018).  31. Jhang J.J., Cheng Y.T., Ho C.Y., Yen G.C. Monosodium urate crystals trigger Nrf2- and heme oxygenase-1-dependent inflammation in THP-1 cells // Cell Mol Immunol. - 2015. Jul; № 12 (4). - Р. 424-34. DOI: 10.1038/cmi.2014.65. Epub 2014 Aug 11. PMID: 25109682; PMCID: PMC4496538.
31. Jhang J.J., Cheng Y.T., Ho C.Y., Yen G.C. Monosodium urate crystals trigger Nrf2- and heme oxygenase-1-dependent inflammation in THP-1 cells // Cell Mol Immunol. - 2015. Jul; № 12 (4). - Р. 424-34. DOI: 10.1038/cmi.2014.65. Epub 2014 Aug 11. PMID: 25109682; PMCID: PMC4496538. 32. Johnson R.J., Sanchez Lozada L.G., Lanaspa M.A., et al. Uric Acid and Chronic Kidney Disease: Still More to Do // Kidney Int Rep. - 2022. Dec. 5; № 8 (2). - 229-239. DOI:10.1016/j.ekir. 2022.11.016.
32. Johnson R.J., Sanchez Lozada L.G., Lanaspa M.A., et al. Uric Acid and Chronic Kidney Disease: Still More to Do // Kidney Int Rep. - 2022. Dec. 5; № 8 (2). - 229-239. DOI:10.1016/j.ekir. 2022.11.016. 33. Johnson R.J., et al. Hyperuricemia, acute and chronic kidney disease, hypertension, and cardiovascular disease: report of a scientific workshop organized by the national kidney foundation // Am. J. Kidney Dis. - 2018. - № 71. - Р. 851-865.
33. Johnson R.J., et al. Hyperuricemia, acute and chronic kidney disease, hypertension, and cardiovascular disease: report of a scientific workshop organized by the national kidney foundation // Am. J. Kidney Dis. - 2018. - № 71. - Р. 851-865. 34. Joosten L.A.B., Crişan T.O., Bjornstad P., et al. Asymptomatic hyperuricaemia: a silent activator of the innate immune system // Nat Rev Rheumatol. - 2020. - № 16. - Р. 75-86. https://doi.org/10.1038/s41584-019-0334-3.
34. Joosten L.A.B., Crişan T.O., Bjornstad P., et al. Asymptomatic hyperuricaemia: a silent activator of the innate immune system // Nat Rev Rheumatol. - 2020. - № 16. - Р. 75-86. https://doi.org/10.1038/s41584-019-0334-3. 35. Kahlenberg J.M., Lundberg K.C., Kertesy S.B., Qu Y., Dubyak G.R. Potentiation of caspase-1 activation by the P2X7 receptor is dependent on TLR signals and requires NF-kappaB-driven protein synthesis // J Immunol. - 2005. Dec 1; № 175 (11). - Р. 7611-7622. DOI: 10.4049/jimmunol.175.11.7611. PMID: 16301671.
35. Kahlenberg J.M., Lundberg K.C., Kertesy S.B., Qu Y., Dubyak G.R. Potentiation of caspase-1 activation by the P2X7 receptor is dependent on TLR signals and requires NF-kappaB-driven protein synthesis // J Immunol. - 2005. Dec 1; № 175 (11). - Р. 7611-7622. DOI: 10.4049/jimmunol.175.11.7611. PMID: 16301671. 36. Kanellis J., Watanabe S., Li J.H., Kang D.H., Li P., Nakagawa T., Wamsley A., Sheikh-Hamad D., Lan H.Y., Feng L., Johnson R.J. Uric acid stimulates monocyte chemoattractant protein-1 production in vascular smooth muscle cells via mitogen-activated protein kinase and cyclooxygenase-2 // Hypertension. - 2003 Jun; № 41 (6). - Р. 1287-1293. DOI: 10.1161/01.HYP.0000072820.07472.3B. Epub 2003 May 12. PMID: 12743010.
36. Kanellis J., Watanabe S., Li J.H., Kang D.H., Li P., Nakagawa T., Wamsley A., Sheikh-Hamad D., Lan H.Y., Feng L., Johnson R.J. Uric acid stimulates monocyte chemoattractant protein-1 production in vascular smooth muscle cells via mitogen-activated protein kinase and cyclooxygenase-2 // Hypertension. - 2003 Jun; № 41 (6). - Р. 1287-1293. DOI: 10.1161/01.HYP.0000072820.07472.3B. Epub 2003 May 12. PMID: 12743010. 37. Kim S., Chang Y., Yun K.E., et al. Development of Nephrolithiasis in Asymptomatic Hyperuricemia: A Cohort Study // Am J Kidney Dis. - 2017. - № 70 (2). - Р. 173-181. DOI: 10.1053/j.ajkd.2017.01.053.
37. Kim S., Chang Y., Yun K.E., et al. Development of Nephrolithiasis in Asymptomatic Hyperuricemia: A Cohort Study // Am J Kidney Dis. - 2017. - № 70 (2). - Р. 173-181. DOI: 10.1053/j.ajkd.2017.01.053. 38. Kratzer J.T., Lanaspa M.A., Murphy M.N., et al. Evolutionary history and metabolic insights of ancient mammalian uricases // Proc Natl AcadSci USA. - 2014. Mar 11; № 111 (10). - Р. 3763-3768. DOI: 10.1073/pnas.1320393111. Epub 2014 Feb 18.
38. Kratzer J.T., Lanaspa M.A., Murphy M.N., et al. Evolutionary history and metabolic insights of ancient mammalian uricases // Proc Natl AcadSci USA. - 2014. Mar 11; № 111 (10). - Р. 3763-3768. DOI: 10.1073/pnas.1320393111. Epub 2014 Feb 18. 39. Kuwabara M., et al. Asymptomatic hyperuricemia without comorbidities predicts cardiometabolic diseases: five-year Japanese cohort study // Hypertension. - 2017. - № 69. - Р. 1036-1044.
39. Kuwabara M., et al. Asymptomatic hyperuricemia without comorbidities predicts cardiometabolic diseases: five-year Japanese cohort study // Hypertension. - 2017. - № 69. - Р. 1036-1044.  40. Leyva F., Anker S., Swan J.W., et al. Serum uric acid as an index of impaired oxidative metabolism in chronic heart failure // Eur Heart J. - 1997. - № 18 (5). - Р. 858-865.
40. Leyva F., Anker S., Swan J.W., et al. Serum uric acid as an index of impaired oxidative metabolism in chronic heart failure // Eur Heart J. - 1997. - № 18 (5). - Р. 858-865.  41. Lv Q., et al. High serum uric acid and increased risk of type 2 diabetes: a systemic review and meta-analysis of prospective cohort studies // PLOS ONE 8, e56864 (2013).
41. Lv Q., et al. High serum uric acid and increased risk of type 2 diabetes: a systemic review and meta-analysis of prospective cohort studies // PLOS ONE 8, e56864 (2013). 42. Martinon F., Petrilli V., Mayor A., Tardivel A. & Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome // Nature. - 2006. - № 440. - Р. 237-241.
42. Martinon F., Petrilli V., Mayor A., Tardivel A. & Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome // Nature. - 2006. - № 440. - Р. 237-241. 43. Medzhitov R. Inflammation 2010: new adventures of an old flame // Cell. - 2010. Mar 19; № 140 (6). - Р. 771-776. DOI: 10.1016/j.cell.2010.03.006. PMID: 20303867.
43. Medzhitov R. Inflammation 2010: new adventures of an old flame // Cell. - 2010. Mar 19; № 140 (6). - Р. 771-776. DOI: 10.1016/j.cell.2010.03.006. PMID: 20303867. 44. Netea Mihai G., et al. Inflammasome-independent regulation of IL-1-family cytokines // Annual review of immunology. - 2015. - Vol. 33. - Р. 49-77. DOI: 10.1146/annurev-immunol-032414-112306.
44. Netea Mihai G., et al. Inflammasome-independent regulation of IL-1-family cytokines // Annual review of immunology. - 2015. - Vol. 33. - Р. 49-77. DOI: 10.1146/annurev-immunol-032414-112306. 45. Nieto F.J., Iribarren С., Gross M.D., Comstock G.W. Uric acid and serum antioxidant capacity: а reaction to atherosclerosis // Atherosclerosis. - 2000. - № 148. - Р. 131-139.
45. Nieto F.J., Iribarren С., Gross M.D., Comstock G.W. Uric acid and serum antioxidant capacity: а reaction to atherosclerosis // Atherosclerosis. - 2000. - № 148. - Р. 131-139.  46. Park J.J., Roudier M.P., Soman D., et al. Prevalence of birefringent crystals in cardiac and prostatic tissues, an observational study // BMJ Open. - 2014. - Vol. 4, № 7. ID e005308.
46. Park J.J., Roudier M.P., Soman D., et al. Prevalence of birefringent crystals in cardiac and prostatic tissues, an observational study // BMJ Open. - 2014. - Vol. 4, № 7. ID e005308. 47. Perez-Ruiz F., Dalbeth N., Bardin T. A review of uric acid, crystal deposition disease, and gout // Adv. Ther. - 2015. - Vol. 32, № 1. - P. 31-41.
47. Perez-Ruiz F., Dalbeth N., Bardin T. A review of uric acid, crystal deposition disease, and gout // Adv. Ther. - 2015. - Vol. 32, № 1. - P. 31-41.  48. Pesi R., Micheli V., Jacomelli G., Peruzzi L., et al. Cytosolic 5'-nucleotidase hyperactivity in erythrocytes of Lesch-Nyhan syndrome patients // Neuroreport. - 2000. - № 11 (9). - Р. 1827-1831.
48. Pesi R., Micheli V., Jacomelli G., Peruzzi L., et al. Cytosolic 5'-nucleotidase hyperactivity in erythrocytes of Lesch-Nyhan syndrome patients // Neuroreport. - 2000. - № 11 (9). - Р. 1827-1831. 49. Quiñones Galvan A., Natali A., Baldi S., Frascerra S., Sanna G., Ciociaro D., Ferrannini E. Effect of insulin on uric acid excretion in humans // Am J Physiol. - 1995. Jan; № 268 (1 Pt 1):E1-5. DOI: 10.1152/ajpendo.1995.268.1.E1. PMID: 7840165.
49. Quiñones Galvan A., Natali A., Baldi S., Frascerra S., Sanna G., Ciociaro D., Ferrannini E. Effect of insulin on uric acid excretion in humans // Am J Physiol. - 1995. Jan; № 268 (1 Pt 1):E1-5. DOI: 10.1152/ajpendo.1995.268.1.E1. PMID: 7840165. 50. Sabán-Ruiz J., Alonso-Pacho A., Fabregate-Fuente M., et al. Xanthine oxidase inhibitor febuxostat as a novel agent postulated to act against vascular inflammation // Antiinflamm. Antiallergy Agents Med. Chem. - 2013. - Vol. 12, № 1. - P. 94-99.
50. Sabán-Ruiz J., Alonso-Pacho A., Fabregate-Fuente M., et al. Xanthine oxidase inhibitor febuxostat as a novel agent postulated to act against vascular inflammation // Antiinflamm. Antiallergy Agents Med. Chem. - 2013. - Vol. 12, № 1. - P. 94-99. 51. Sánchez-Lozada L.G., Tapia E., Santamaría J., et al. Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats // Kidney Int. - 2005. - № 67 (1). - Р. 237-247. DOI: 10.1111/j.1523-1755.2005.00074.x.
51. Sánchez-Lozada L.G., Tapia E., Santamaría J., et al. Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats // Kidney Int. - 2005. - № 67 (1). - Р. 237-247. DOI: 10.1111/j.1523-1755.2005.00074.x. 52. Sánchez-Lozada L.G., Lanaspa M.A., Cristóbal-García M., García-Arroyo F., Soto V., Cruz-Robles D., Nakagawa T., Yu M.A., Kang D.H., Johnson R.J. Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations // Nephron Exp Nephrol. - 2012. - № 121 (3-4):e71-8. DOI: 10.1159/000345509. Epub 2012 Dec 7. PMID: 23235493; PMCID: PMC3656428.
52. Sánchez-Lozada L.G., Lanaspa M.A., Cristóbal-García M., García-Arroyo F., Soto V., Cruz-Robles D., Nakagawa T., Yu M.A., Kang D.H., Johnson R.J. Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations // Nephron Exp Nephrol. - 2012. - № 121 (3-4):e71-8. DOI: 10.1159/000345509. Epub 2012 Dec 7. PMID: 23235493; PMCID: PMC3656428. 53. Sautin Y.Y., Nakagawa T., Zharikov S., Johnson R.J. Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress // Am J Physiol Cell Physiol. - 2007. Aug; № 293 (2). - Р. 584-596. DOI: 10.1152/ajpcell.00600.2006. Epub 2007 Apr 11. Erratum in: Am J Physiol Cell Physiol. - 2010. Sep. № 299 (3). - Р. 726. PMID: 17428837.
53. Sautin Y.Y., Nakagawa T., Zharikov S., Johnson R.J. Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress // Am J Physiol Cell Physiol. - 2007. Aug; № 293 (2). - Р. 584-596. DOI: 10.1152/ajpcell.00600.2006. Epub 2007 Apr 11. Erratum in: Am J Physiol Cell Physiol. - 2010. Sep. № 299 (3). - Р. 726. PMID: 17428837. 54. Schreiber A., Pham C.T., Hu Y., Schneider W., Luft F.C., Kettritz R. Neutrophil serine proteases promote IL-1β generation and injury in necrotizing crescentic glomerulonephritis // J Am Soc Nephrol. - 2012. Mar; № 23 (3). - Р. 470-82. DOI: 10.1681/ASN.2010080892. Epub 2012 Jan 12. PMID: 22241891; PMCID: PMC3294298.
54. Schreiber A., Pham C.T., Hu Y., Schneider W., Luft F.C., Kettritz R. Neutrophil serine proteases promote IL-1β generation and injury in necrotizing crescentic glomerulonephritis // J Am Soc Nephrol. - 2012. Mar; № 23 (3). - Р. 470-82. DOI: 10.1681/ASN.2010080892. Epub 2012 Jan 12. PMID: 22241891; PMCID: PMC3294298. 55. Shimada M., et al. A novel role for uric acid in acute kidney injury associated with tumour lysis syndrome // Nephrol. Dial. Transpl. - 2009. - № 24. - Р. 2960-2964.
55. Shimada M., et al. A novel role for uric acid in acute kidney injury associated with tumour lysis syndrome // Nephrol. Dial. Transpl. - 2009. - № 24. - Р. 2960-2964. 56. Staub M. Uric acid as a scavenger in oxidative stress // OrvHetil. - 1999. - № 140 (6). - Р. 275-279.
56. Staub M. Uric acid as a scavenger in oxidative stress // OrvHetil. - 1999. - № 140 (6). - Р. 275-279. 57. Su X., Xu B., Yan B., et al. Effects of uric acid-lowering therapy in patients with chronic kidney disease: A meta-analysis // PLoS One. - 2017. Nov 2. - 2(11):e0187550. DOI:10.1371/journal.pone.0187550. eCollection 2017.
57. Su X., Xu B., Yan B., et al. Effects of uric acid-lowering therapy in patients with chronic kidney disease: A meta-analysis // PLoS One. - 2017. Nov 2. - 2(11):e0187550. DOI:10.1371/journal.pone.0187550. eCollection 2017. 58. Sutin A.R., et al. Impulsivity is associated with uric acid: evidence from humans and mice // Biol. Psychiatry. - 2014. - № 75. - Р. 31-37.
58. Sutin A.R., et al. Impulsivity is associated with uric acid: evidence from humans and mice // Biol. Psychiatry. - 2014. - № 75. - Р. 31-37. 59. Tsukamoto S., Okami N., Yamada T., Azushima K., Yamaji T., Kinguchi S., Uneda K., Kanaoka T., Wakui H., Tamura K. Prevention of kidney function decline using uric acid-lowering therapy in chronic kidney disease patients: a systematic review and network meta-analysis // Clin Rheumatol. - 2022. Mar; № 41 (3). - Р. 911-919. DOI: 10.1007/s10067-021-05956-5. Epub 2021 Oct 12. PMID: 34642880.
59. Tsukamoto S., Okami N., Yamada T., Azushima K., Yamaji T., Kinguchi S., Uneda K., Kanaoka T., Wakui H., Tamura K. Prevention of kidney function decline using uric acid-lowering therapy in chronic kidney disease patients: a systematic review and network meta-analysis // Clin Rheumatol. - 2022. Mar; № 41 (3). - Р. 911-919. DOI: 10.1007/s10067-021-05956-5. Epub 2021 Oct 12. PMID: 34642880. 60. Verzola D., Ratto E., Villaggio B., et al. Uric acid promotes apoptosis in human proximal tubule cells by oxidative stress and the activation of NADPH oxidase NOX 4 // PLoS One. - 2014. - № 9 (12): e115210. DOI: 10.1371/journal.pone.0115210.
60. Verzola D., Ratto E., Villaggio B., et al. Uric acid promotes apoptosis in human proximal tubule cells by oxidative stress and the activation of NADPH oxidase NOX 4 // PLoS One. - 2014. - № 9 (12): e115210. DOI: 10.1371/journal.pone.0115210. 61. Wang Y., Viollet B., Terkeltaub R., Liu-Bryan R. AMP-activated protein kinase suppresses urate crystal-induced inflammation and transduces colchicine effects in macrophages // Ann Rheum Dis. - 2016. Jan; № 75 (1). - Р. 286-294. DOI: 10.1136/annrheumdis-2014-206074. Epub 2014 Oct 31. PMID: 25362043; PMCID: PMC4417082.
61. Wang Y., Viollet B., Terkeltaub R., Liu-Bryan R. AMP-activated protein kinase suppresses urate crystal-induced inflammation and transduces colchicine effects in macrophages // Ann Rheum Dis. - 2016. Jan; № 75 (1). - Р. 286-294. DOI: 10.1136/annrheumdis-2014-206074. Epub 2014 Oct 31. PMID: 25362043; PMCID: PMC4417082. 62. Woodward O.M., Köttgen A., Coresh J., et al. Identification of a urate transporter, ABCG2, with a common functional polymorphism causing gout // Proc Natl Acad Sci USA. - 2009. Jun 23; № 106 (25). - Р. 10338-10342. DOI: 10.1073/pnas.0901249106. Epub 2009 Jun 8.
62. Woodward O.M., Köttgen A., Coresh J., et al. Identification of a urate transporter, ABCG2, with a common functional polymorphism causing gout // Proc Natl Acad Sci USA. - 2009. Jun 23; № 106 (25). - Р. 10338-10342. DOI: 10.1073/pnas.0901249106. Epub 2009 Jun 8. 63. Xiao J., Zhang X.L., Fu C., et al. Soluble uric acid increases NALP3 inflammasome and interleukin-1 expression in human primary renal proximal tubule epithelial cells through the Toll-like receptor 4-mediated pathway // Int J Mol Med. - 2015. May; № 35 (5). - Р. 1347-1354. DOI: 10.3892/ijmm.2015.2148.
63. Xiao J., Zhang X.L., Fu C., et al. Soluble uric acid increases NALP3 inflammasome and interleukin-1 expression in human primary renal proximal tubule epithelial cells through the Toll-like receptor 4-mediated pathway // Int J Mol Med. - 2015. May; № 35 (5). - Р. 1347-1354. DOI: 10.3892/ijmm.2015.2148.  64. Yu K.H. Febuxostat: a novel non-purine selective inhibitor of xanthine oxidase for the treatment of hyperuricemia in gout // Recent Pat. Inflamm. Allergy Drug Discov. - 2007. - Vol. 1, № 1. - P. 69-75.
64. Yu K.H. Febuxostat: a novel non-purine selective inhibitor of xanthine oxidase for the treatment of hyperuricemia in gout // Recent Pat. Inflamm. Allergy Drug Discov. - 2007. - Vol. 1, № 1. - P. 69-75.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Обсуждение |
 |
Список источников |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»