2024 год № 1
Обзоры литературы
1tarakovaolga@gmail.com, https://orcid.org/0000-0002-3113-3995
2pl_nat@hotmail.com, https://orcid.org/0000-0002-8701-7213
3Институт химии ДВО РАН, Владивосток, Россия
3medkov@ich.dvo.ru, https://orcid.org/0000-0002-9417-0312
Аннотация:
Ключевые слова:
1tarakovaolga@gmail.com, https://orcid.org/0000-0002-3113-3995
2pl_nat@hotmail.com, https://orcid.org/0000-0002-8701-7213
3Institute of Chemistry FEB RAS, Vladivostok, Russia
3medkov@ich.dvo.ru, https://orcid.org/0000-0002-9417-0312
Abstract:
Key words:
Введение |
 |
 |
Фотодинамическая терапия зарекомендовала себя как неинвазивный способ лечения ряда онкологических патологий, включая рак поджелудочной железы, пищевода, легких и немеланомный рак кожи [1, 2, 3]. Однако, более широкое клиническое применение этого метода ограничивается возможностью его использования при условии облучения длинами волн инфракрасного диапазона (ИК) [1, 3]. Лечение опухолей, не достижимых для указанных длин волн, требует инвазивные эндоскопические или лапароскопические подходы, которые также могут быть ограничены пределами возможностей используемого источника света из-за лимитированной проницаемости в ткани [4]. В этом случае, в процессе фотодинамической терапии возможны такие побочные эффекты, как болевой синдром, отеки и высокая светочувствительность здоровых тканей [1, 2, 3, 4]. Активация фотосенсибилизатора Х-лучами позволяет проводить неинвазивное лечение глубоко расположенных опухолей, поскольку они относительно слабо поглощаются или рассеиваются в условиях in vivo. В настоящем обзоре рассмотрены основополагающие принципы и эволюция метода синергетической фотодинамической терапии, активируемой Х-лучами, обсужден механизм их действия и перспективы развития метода.
Обсуждение
|
 |
 |
1. Фотохимические и фотофизические аспекты фотодинамической терапии
1.1. Активные формы кислорода: процесс генерации и механизм действия
В отсутствие источников внешнего воздействия ионизирующего излучения активные формы кислорода являются побочными продуктами клеточного метаболизма и образуются в процессе ферментативных реакций. Генерация АФК осуществляется внутри клетки с помощью оксилительно-восстановительного фермента никотинамидадениндинуклеотидфосфат оксидаза (НАДФН-оксидаза) [5]. Инициировать возникновение АФК возможно также экзогенными способами, например, фотовозбуждением хромофорных молекул в ультрафиолетовом и видимом диапазоне длин волн. Индуцированное повышение уровня АФК запускает механизмы окислительного стресса в клетке, что может привести к воспалению, апоптозу, некрозу и аутофагии [6]. Системное введение и оптическое возбуждение экзогенных светочувствительных молекул, приводящее к продукции активных форм кислорода с подавлением антиоксидантной реакции организма и последующей гибелью клеток, является основой метода фотодинамической терапии [7].
1.2. Механизм клеточной гибели при фотодинамической терапии
При поглощении фотона молекулой хромофора в диапазоне 600-850 нм (согласно принципа ФДТ) осуществляется переход электрона из основного низкоэнергетического синглетного состояния S0 на орбиталь с более высокой энергией без изменения спина. Переход в состояние S1 занимает ~10-15 с. Прямой переход из промежуточного состояния S1 в триплетное возбужденное состояние T1 невозможен за счет сохранения спинового момента [8].
При ФДТ молекула фотосенсибилизатора (ФС) в возбужденном триплетном состоянии может подвергаться одному из двух типов фотохимических реакций [9, 10]. В реакциях Типа I фотосенсибилизатор взаимодействует с находящейся рядом молекулой, передавая либо протон (H+), c образованием анион-радикала, либо электрон, образуя катион-радикал. Далее эти радикалы могут реагировать с близлежащими субстратами, такими как мембраны клеток/органелл или с молекулярным кислородом, результатом чего является генерация активных форм кислорода. Согласно многочисленным исследованиям в ходе реакции Типа I продуцируется супероксидный анион (О2-) посредством переноса из возбужденного триплетного состояния фотосенсибилизатора в молекулярный кислород [11, 12, 13, 14, 15]. Несмотря на то, что О2- не способен вызывать значительного окислительного повреждения, он в присутствии супероксиддисмутазы может подвергаться дисмутации с другой соседней молекулой супероксида с образованием кислорода и перекиси водорода (H2O2), которые легко проницаемы для мембраны и имеют ограниченную скорость диффузии. Супероксид может также проявлять свойства восстановителя, отдавая электрон ионам металлов, например, при восстановлении трехвалентного железа (Fe3+) до двухвалентного железа (Fe2+) посредством реакции Фентона [16]. Восстановленное Fe2+ легко окисляется H2O2 до Fe3+, образуя в процессе гидроксильный радикал (HO·) и гидроксид-ион (OH-). Затем Fe3+ можно восстановить обратно до Fe2+ либо другой молекулой H2O2, либо молекулой O2-. Супероксид также может реагировать с гидроксильным радикалом с образованием синглетного кислорода (1O2) или с оксидом азота (NO-) с образованием мощной окисляющей молекулы пероксинитрита (OONO-). Однако, в отличие от супероксида, гидроксильные радикалы не могут быть удалены ферментативной реакцией. Несмотря на короткое время жизни in vivo (~10-9 с), HO· может повреждать практически все формы макромолекул, включая углеводы, нуклеиновые кислоты, липиды, жирные кислоты и аминокислоты, зачастую генерируя свободные радикалы и запуская в организме процесс свободнорадикальных цепных реакций [16, 17].
В реакциях Типа II в результате прямой передачи энергии от фотосенсибилизатора к молекулярному кислороду образуется синглетный кислород (1O2). Эта молекула обладает высокой реакционной способностью и легко взаимодействует с большим количеством биологических субстратов, включая нуклеиновые кислоты (особенно гуанин), ненасыщенные липиды и аминокислоты [12, 19]. Биологические реакции 1O2 часто приводят к образованию эндопероксидов, разложение которых приводит к образованию радикалов, инициирующих множество разрушительных химических реакций [18, 20].
Из-за высокой реакционной способности и короткого периода полураспада синглетного кислорода (и гидроксильных радикалов) непосредственное разрушение клеток при ФДТ осуществляется вблизи области образования 1O2, то есть в месте локализации фотосенсибилизатора. Период полураспада синглетного кислорода в биологических системах обычно составляет <40 нс, что в значительной степени обусловлено эффектом тушения. Это приводит к тому, что радиус действия синглетного кислорода составляет всего 20 нм, что намного меньше размера среднестатистической клетки и меньше размера большинства клеточных органелл [19]. Даже в отсутствие химического тушения (например, в сверхчистой воде) максимальные расстояния диффузии 1O2 не могут превышать 150 нм [4, 19]. Несмотря на то, что синглетный кислород, образующийся в результате реакций Типа II, признан основой цитотоксического эффекта при ФДТ, недавние исследования показали, что радикалы, образующиеся в результате реакций Типа I, способны приводить к усиленным эффектам ФДТ, особенно, в условиях гипоксии [21, 22].
Гидроксидные радикалы НО· имеют еще более короткий период жизни in vivo, чем 1
После возбуждения источником света локализация ФС в значительной степени влияет на клеточный ответ. Гидрофильные ФС усваиваются клетками либо путем транспорта, опосредованного липидами/белками, либо путем эндоцитоза, в то время как гидрофобные молекулы способны быстро диффундировать через плазматические мембраны для проникновения в клетку. Внутриклеточными субстратами для ФС являются: мембраны органелл эндоплазматического ретикулума, митохондрии, комплекс Гольджи, лизосомы и плазматическая мембрана [23, 24]. Растворимость синглетного кислорода в липидах и высокое содержание ненасыщенных жирных кислот в этих субстратах приводит к увеличению скорости реакций образования синглетного кислорода до 0,74-2,4×105 М-1 с-1 и образованию радикалов - производных кислорода [19, 23]. Перекисные соединения липидов в присутствии микроэлементов могут разлагаться с образованием алкоксильных и пероксильных радикалов, которые приводят к дополнительным свободнорадикальным цепным реакциям, разрушающим липидные мембраны, влияющим на клеточный метаболизм и передачу сигналов [25]. Несмотря на короткий период полураспада in vivo и скорость диффузии 1O2, фотоокисление аминокислотных остатков белка обычно происходит быстрее (~107 М-1 с-1) благодаря наличию в белковых структурах двойных связей и серы [19, 25].
О2 несмотря на то, что они гораздо менее избирательны по своей активности, так как способны связываться с большинством аминокислот с ограниченной скоростью диффузии. Гидроксильные радикалы могут вступать в несколько типов реакций с аминокислотами, пептидами и белками, а именно, реакции соединения, переноса электронов и выделения водорода [25, 26]. Гидроксильные радикалы повреждают как пептидные остовы, так и боковые цепи аминокислот, образуя при этом разнообразный набор радикальных производных белка [25, 26]. Расщепление пептидной цепи, в первую очередь, инициируется выделением ионов протонов Н+ в α-углеродном положении с последующей реакцией с O2 с образованием пероксильного радикала. В результате происходит фрагментация и расщепление белковых структур с образованием амидных и карбонильных фрагментов, а также связанных с пептидами гидропероксидов [26]. Гидроксильнорадикальное окисление пептидов и белков также может приводить к образованию свободных аминокислот с помощью реакций, в которых используются азотцентрированные радикалы, не связанные с расщеплением α-углеродной цепи [26]. Одним из интересных направлений современных исследований является изучение окисления белковых структур, катализируемое металлами, за счет избирательного связывания [27, 28].
Окислительные повреждения и разрывы ДНК могут быть реализованы либо через окисление ДНК напрямую, либо косвенно, путем образования O2-, HO· и 1O2[29, 30]. Одноэлектронное окисление происходит, когда фотосенсибилизатор по механизму реакции Типа I в возбужденном триплетном состоянии "отрывает" электрон/атом водорода от основания ДНК. Гуанин особенно восприимчив к одноэлектронному окислению из-за низкого значения потенциала ионизации, образуя промежуточный катион-радикал гуанина, который может либо непосредственно реагировать с лизином, аргинином или серином в белках, и тем самым вызывать перекрестное связывание ДНК и белка, либо подвергаться превращению в 8-Оксогуанин или депротонированию в высокореакционноспособные гуаниновые радикалы (G(-H)·) [25].
Известно, что синглетный кислород не вступает в реакцию с 2-дезоксирибозой, и, следовательно, не способен вызывать двухцепочечные разрывы ДНК, в то время как вызванные окислительным стрессом повреждения фрагментов системы репарации ДНК могут приводить к одноцепочечным разрывам [31]. Индуцированное ФДТ перекисное окисление липидов мембран клеток/органелл приводит к образованию реактивных альдегидов и гидроксиалкеналей, которые могут реагировать с основаниями ДНК с образованием производных гуанина и экзоциклических аддуктов ДНК, обладающих высокой мутагенной активностью [4]. В отличие от синглетного кислорода, гидроксильные радикалы могут легко вызывать модификации оснований путем присоединения к двойным связям, конкурируя с реакциями отрыва водорода от метильной группы тимина и 2-аминогруппы гуанина [25]. Гидроксильное отщепление любого водорода от 2-дезоксирибозы приводит к разрывам цепи ДНК [25].
2. Фотосенсибилизаторы для фотодинамической терапии
Оптимальными для клинического применения фотосенсибилизатора являются следующие свойства: простота получения, химическая чистота, высокая фотохимическая стабильность, низкая темновая токсичность, селективное накопление в целевых клетках. Как упоминалось раннее, важным критерием для более глубокого проникновения в ткани является поглощение молекулами ФС света в области 630-930 нм, а также повышение вероятности межсистемного спинового перехода между возбужденным синглетным и триплетным состояниями, которые обуславливают более интенсивное продуцирование синглетного кислорода [32].
В фотодинамической терапии применяются как природные, так и синтетические фотосенсибилизаторы, большинство из которых представляют собой тетрапиррольные макроциклические структуры (порфирины, хлорины, бактериохлорины и фталоцианины) [34, 35, 36]. Такие соединения имеют сопряженные π-электронные системы, что обусловливает уникальные фотофизические и фотохимические свойства. Существуют различные классификации ФС. Согласно мнению большинства исследователей в области ФДТ соединения могут быть разделены на три поколения (рис. 1) [34, 35, 36].
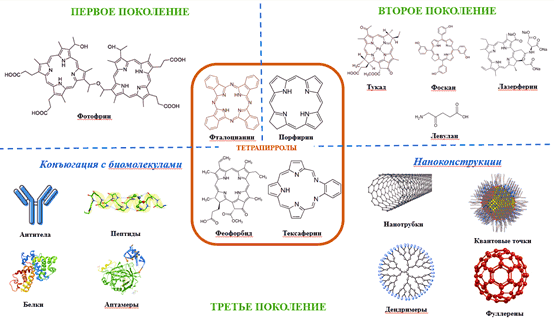 Рис. 1. Поколения фотосенсибилизаторов тетрапирроловой структуры
Рис. 1. Поколения фотосенсибилизаторов тетрапирроловой структуры
Фотосенсибилизаторы первого поколения стали известны благодаря открытию гематопорфирина в 1841 году. Позднее были получены его производные, являющиеся основой широко применяемого с 1993 года фотофрина для лечения рака мочевого пузыря, пищевода и желудка [35]. Несмотря на то, что порфирины обладают относительно высокими квантовыми выходами образования АФК при возбуждении в видимом диапазоне длин волн, их общая восприимчивость к воздействию света (фотообесцвечивание), низкие значения поглощения в инфракрасном диапазоне, гидрофобность, склонность к агрегации и низкая селективность значительно ограничивают их клиническое применение. Для устранения этих недостатков к 1980 году было положено начало разработке препаратов второго поколения. На сегодняшний день к ним относят синтетические ФС тетрапирроловой структуры, которые в зависимости от химических модификаций делятся на порфирины, хлорины, 5-аминолевулиновую кислоту, производные бензопорфирина, фталоцианины, нафталоцианины, тексафирины, производные тиопурина и аналоги бактериохлорина. Многие из этих ФС одобрены для лечения различных видов рака, однако, такие соединения также обладают рядом недостатков, например, плохой растворимостью в воде, что значительно ограничивает внутривенное введение и биодоступность. Это обусловливает необходимость поиска новых стратегий для разработки более совершенных фотосенсибилизаторов [35].
Целенаправленный синтез ФС третьего поколения подразумевает конъюгацию соединений второго поколения с биологическими компонентами для селективной локализации и таргетной доставки в очаг опухоли с уменьшением повреждения окружающих здоровых тканей. Такими компонентами могут быть: моносахариды, пептиды, белки, липопротеины, моноклональные антитела, направленные к специфическому антигену раковой клетки, маркерам поверхности опухоли (рецепторы фактора роста, рецепторы трансферрина или гормоны). Внедрение нанотехнологий также является актуальным способом разработки ФС. Нано-ФС обладают рядом преимуществ: высокая стабильность, высокая эффективность загрузки (инкапсуляция) или биоконъюгации, регулируемый размер, улучшенные оптические свойства, простота функционализации поверхности, медленная деградация, длительное время циркуляции, высокая биосовместимость и контролируемое высвобождение, что является возможностью повышения эффективности ФДТ [37, 38].
Одной из современных стратегий получения соединений 3-го поколения является введение элементов с высоким зарядом атомного ядра в структуру ФС для улучшения фотостабильности, фотофизических и фотохимических свойств по сравнению с их аналогами, представляющими собой "свободные" молекулы. Такой подход приводит к усиленному образованию триплетных возбужденных состояний, что, в конечном счете, повышает эффективность генерации АФК [39]. Некоторые такие потенциальные ФС уже получены, в настоящее время находятся на стадии клинических испытаний или уже одобрены для применения (таблица).
| Наименование субстанции | Химическая структура и название субстанции | Длина волны поглощения, нм | Статус испытаний |
|---|---|---|---|
| TLD-1433/Ruvidar (Рувидар) | 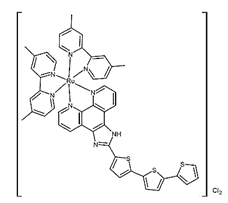 Рутений-полипиридин Рутений-полипиридин | 525 нм | Проводятся на модели немышечно-инвазивного рака мочевого пузыря [40, 41] |
| Purlytin (Пурлитин) | 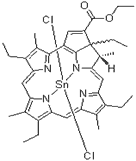
Этилэтиопурпурин олова | 664 | Проводятся на моделях базальноклеточного рака, саркомы Капоши, рака предстательной железы и аденокарциномы молочной железы [41, 42] |
| Photosens (Фотосенс) | 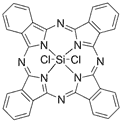
Фталоцианин кремния | 675 | Проводятся на модели рака кожи [43] |
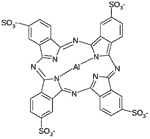
Хлорид тетрасульфоната фталоцианина алюминия | 676 | Проводятся на моделях рака желудка, кожи, губ, полости рта и молочной железы [44] | |
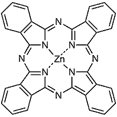
Фталоцианин цинка | 676 | Проводятся на модели рака кожи и плоскоклеточного рака [45] | |
| Lutrin (Лутрин) | 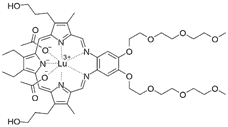 Мотексафин лютеций Мотексафин лютеций | 732 | Проводятся на моделях рака предстательной железы, молочной железы, шейки матки, головного мозга, кожи и поверхностного рака [46] |
| Stakel (Штакел) | 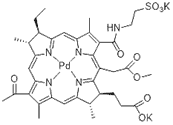
Палладий-бактериофеофорбид (WST11) | 750 | Проводятся на модели рака простаты [47] |
| TOOKAD soluble/Padeliporfin (Паделипорфин) | 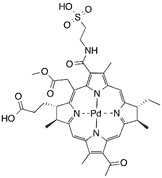
Палладий-бактериофеофорбид (WST09) | 763 | Одобрен для лечения рака простаты [41] |
3. Фотосенсибилизаторы, активируемые X-лучами
Поглощение и рассеяние фотонов в области ближнего ИК-диапазона является одним из основных ограничений ФДТ. С целью обойти этот недостаток разрабатываются подходы, подразумевающие включениЕ хемилюминесцентных или биолюминесцентных молекул в структуры фотосенсибилизаторов для резонансной передачи энергии на расположенные рядом фотонеактивные центры.
Известно, что Х-лучи сравнительно слабо поглощают или рассеивают фотоны при прохождении через ткани, особенно в зоне терапевтических энергий (от 25 кэВ до 25 МэВ). Следовательно, существует значительный интерес к разработке ФС, активируемых Х-лучами, что позволит проводить лечение глубоко расположенных опухолей, избегая при этом инвазивного лапароскопического/эндоскопического вмешательства, исключая световую цитотоксичность (например, воздействие солнечного света) и устраняя продолжительный фототоксический эффект на пациента. Традиционные ФС не способны поглощать фотоны такой энергии, поэтому необходимо введение молекул, поглощающих и преобразующих часть энергии падающего излучения в свет с длиной волны, подходящей для его возбуждения [48, 49, 50, 51].
3.1. Принцип действия Х-лучевой ФДТ
В 2000 году была предложена идея проведения ФДТ, активируемой Х-лучами (подразумевалось воздействие рентгеновским излучением) и лишь в 2016 году впервые были начаты исследования механизма Х-ФДТ [52]. В 2006 году Чен и Чжан предложили новую стратегию лечения, используя потенциал глубокого проникновения Х-излучения в ткани для фотоактивации ФС. Сочетание традиционной лучевой и фотодинамической терапии позволило снизить дозы облучения, тем самым предотвратив сопутствующие повреждения здоровых тканей [52, 53]. Новая система средств для ФДТ, основана на применении люминесцентных наночастиц, образующих комплексы с ФС [52]. Преимущества этой системы по сравнению с лучевой или фотодинамической терапией следующие:
- не требуется источник света для ФС;
- активация под действием одного источника света;
- использование низких доз воздействия для достижения эффекта;
- уменьшение стоимости при проведении сеанса терапии.
Энергия рентгеновских лучей, используемых в клинической лучевой терапии, находится в диапазоне от сотен килоэлектронвольт (КэВ) до мегаэлектронвольт (МэВ). Большинство традиционных ФС не могут быть эффективно активированы действием Х-лучей. В связи с этим требуется физический преобразователь для поглощения энергии Х-лучей и передачи ее ФС для индукции цитотоксического синглетного кислорода, необходимого для разрушения опухоли. В классической модели Х-ФДТ такая передача энергии достигается путем преобразования поглощенной энергии в оптические фотоны соответствующей длины волны, которые могут эффективно поглощаться фотосенсибилизаторами. Эти преобразователи принято называть сцинтилляторами, проявляющими оптическую люминесценцию, возбуждаемую Х-лучами (X-ray excited optical luminescence, XEOL). Кроме того, существуют и другие возможные механизмы передачи энергии между поглотителями Х-лучей и фотосенсибилизаторами. Например, природный ФС акридиновый оранжевый, который как было показано на моделях саркомы, эффективен при низких дозах излучения без использования специального сцинтилляционного преобразователя [52, 54].
Как показано на рисунке 2, классический процесс Х-ФДТ можно разделить на три основные части.
1. Воздействие на молекулу сцинтиллятора Х-лучей от внешнего источника - процесс XEOL.
2. Энергия XEOL поглощается находящимися в непосредственной близости от сцинтиллятора ФС, которые индуцируют генерацию опухолевыми клетками синглетного кислорода 1O2 с повреждением фосфолипидов их мембран, причем, в то же время ионизирующее излучение вызывает образование радикалов, оказывающих разрушительное действие на молекулы ДНК.
3. Энергия XEOL и возбужденного ФС индуцируют гибель раковых клеток с помощью комбинации фотодинамических процессов и радиотерапии для достижения более эффективного лечения рака [52].
Таким образом, эффективный перенос энергии в загруженных ФС наносцинтилляторах (называемых наносенсибилизаторами) осуществляется Х-лучами, которые могут использоваться в качестве источника возбуждающего света для применения ФДТ глубоко расположенных опухолей. Исследования подтверждают, что по сравнению с радиотерапией в дозе 0-5 Гр комбинированная Х-ФДТ индуцирует гибель клеток и снижает клоногенность опухолей. Причем, отмечается, что при радиотерапии клетки, преимущественно, гибнут путем апоптоза в течение суток после воздействия, тогда как при Х-ФДТ, демонстрируется обширный некроз. Уровень перекисного окисления липидов и повреждение клеток (метод ДНК-комет) при воздействии Х-ФДТ в 1,5 раза превышает таковой для радиотерапии [55].
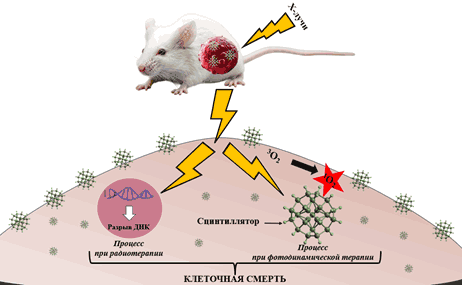
Рис. 2. Схема действия Х-лучевой и ФДТ
Эксперименты in vitro подтвердили генерацию синглетного кислорода в процессе ФДТ, в то время как радиотерапия индуцирует радиолиз воды с образованием гидроксильных радикалов (OH•). Комбинация радио- и ФДТ может приводить к усилению продукции АФК, которые играют важную роль в повреждении клеточной мембраны и ДНК [56, 57]. Стратегия X-ФДТ обладает рядом преимуществ по сравнению с традиционной лучевой терапией. Во-первых, Х-ФДТ может убивать клетки, устойчивые только к ЛТ (например, клетки глиобластомы, клетки рака предстательной железы и клетки колоректального рака), так как нарушение клеточной мембраны вместе с повреждением ДНК, вызванные действием комбинированного излучения, синхронно индуцируют апоптоз и некроз опухолевых клеток. Во-вторых, доза облучения, используемая при Х-ФДТ (общая доза <5 Гр), намного ниже, чем принято при традиционной клинической лучевой терапии (общая доза 60-80 Гр), что оказывает меньший побочный повреждающий эффект на нормальные ткани [49].
3.2. Современные достижения в разработке фотосенсибилизаторов для Х-ФДТ
Большинство первоначальных исследований продемонстрировали возможность усиленной генерации синглетного кислорода с помощью сцинтилляторов на основе фторидов и оксидов металлов. Являясь одним из наиболее изученных сцинтилляторов, наноматериалы, допированные редкоземельными элементами, могут поглощать внешнее излучение высокой энергии и переносить его на люминесцентные центры, что приводит к эффективной флуоресценции в области видимого света [51].
В 2008 году группа исследователей синтезировала мезо-тетра(4-карбоксифенил) порфин (MTCP), конъюгированный с 10-15 нм частицами фторида лантаноида LaF3:Tb (LaF3:Tb-MTCP) [58]. При облучении 0,44 Гр в течение мин-1, (13,2 Гр) флуоресценция 9,10-антрацендипропионовой кислоты под влиянием как MTCP, так и LaF3:Tb-MTCP подавлялась, причем тушение последним удвоилось. При нанесении слоя кремнезема на мезопористый сцинтиллятор LaF3:Tb и конъюгации с хромофором бенгальским розовым наносенсибилизатор показал эффективную генерацию 1O2 при Х-облучении [59]. Длина волны поглощения интегрированного кремнезема внутрь частицы со структурой ядро-оболочка-(Tb2O3@SiO2)-порфирин совпадала с таковой для порфирина, что объясняло интенсивную генерацию 1O2 после воздействия этой наночастицы и Х-лучей (5,4 мГр х сек-1) и было подтверждено увеличением эмиссии зонда 3-п-(аминофенил)флуоресцеина [60]. Проведенные исследования подтвердили возможность генерации активных форм кислорода в растворах на модельных Х-ФДТ экспериментах. Полученные результаты явились основой для дальнейший разработки и исследований на моделях in vitro потенциальных ФС, эффективно проникающих в клетку и индуцирующих генерирацию цитотоксических АФК в них. Исследование in vitro на клетках рака молочной железы человека (MCF-7) воздействия комплекса медь-цистеамин (Cu-Cy), размером 3-10 мкм, показало значительную гибель клеток при активации Х-лучами, а результаты экспериментов in vivo, полученные на модели подкожной опухоли, продемонстрировали ингрибирование ее роста после инъекции частицами Cu-Cy и облучения в дозе 5 Гр [61]. Несмотря на положительный результат, механизм выработки АФК остался неясным по причине отсутствия в структуре комплекса молекулы ФС. Недавнее исследование продемонстрировало, что наночастицы Cu-Cy могут регулировать микроокружение опухоли для активируемой глутатионом in situ усиленной генерации H2O2 при химиотерапии лекарственно-устойчивого рака молочной железы [62]. При воздействии однократной дозы 0,5 Гр наносенсибилизатор, состоящий из ядра SrAl2O4:Eu (SAO) и оболочки SiO2, испускает ярко-зеленую люминесценцию, поглощаемую ФС мероцианином 540 (МС540) с последующей индукцией генерации 1O2 по механизму ФДТ Типа II. По сравнению с низкой цитотоксичностью воздействия облучения на клетки радиорезистентной глиобластомы человека (U87MG), предварительная их инкубация с наносенсибилизатором, а именно, ФС MC540, покрытым мезопористым кремнеземом, с последующим облучением вызывало снижение жизнеспособности до 38 %. Кроме того, почти полностью подавлялся рост подкожной опухоли U87MG, привитой животным, после внутриопухолевой инъекции наносенсибилизатора M-SAO@SiO2 и облучения [63]. Были также синтезированы силикатные наносцинтилляторы с контролируемым размером и оптической люминесценцией, возбуждаемой излучением в диапазоне 450-900 нм, модифицированные фотосенсибилизатором бенгальским розовым. При низкой дозе воздействия в 0,75 Гр эти частицы вызывали интенсивную генерацию АФК со значительными ингибирующим эффектом в отношении опухоли при минимальном воздействии на нормальные ткани [64]. С целью повышения эффективности терапии для разработки радиосенсибилизаторов также используют атомы йода в структуре ФС, которые оказывают влияние на продукцию клетками OH0-радикалов [65].
За последние десятилетия произошли значительные изменения применения ФДТ в качестве нового подхода в стратегии лечения рака. ФДТ, активируемая Х-лучами, продемонстрировала многообещающий терапевтический эффект благодаря сочетанию свойств соединений, используемых для синтеза комплексов, с целью достижения возможности облучения глубоко расположенных опухолей. На сегодняшний день разработка и изучение действия сцинтилляторов и механизмов преобразования энергии является областью интереса многих исследовательских групп. Определен перечень свойств, которыми должен обладать потенциальный сцинтиллятор, к которым относятся высокая эффективность преобразования энергии X-лучей, гидрофильность и оптимальный размер молекул для внутриклеточного поглощения, высокая стабильность молекулы к действию ионизирующего излучения и отсутствие токсичности при деградации. Использование Х-ФДТ с синергетическим действием позволяет преодолеть ограничение глубины проникновения света, характерное для традиционной ФДТ, и значительно снижать токсичное действие доз облучения при радиотерапии. Тем не менее, по причине сложности на современном этапе технологий синтеза комплексов соединений для такого типа терапии, реальные клинические испытания и применение Х-ФДТ для лечения онкологических заболеваний находятся на стадии научных разработок и доклинических испытаний.
Список источников |
 |
 1. Alberto M.E., De Simone B.C., Sicilia E., et al. Rational design of modified oxobacteriochlorins as potential photodynamic therapy photosensitizers // International Journal of Molecular Sciences. - 2019. - № 20 (8). - Р. 2002. DOI: https://doi.org/10.3390/ijms20082002.
1. Alberto M.E., De Simone B.C., Sicilia E., et al. Rational design of modified oxobacteriochlorins as potential photodynamic therapy photosensitizers // International Journal of Molecular Sciences. - 2019. - № 20 (8). - Р. 2002. DOI: https://doi.org/10.3390/ijms20082002. 2. Algorri J.F., Ochoa M., Roldán-Varona P., et al. Photodynamic therapy: A compendium of latest reviews // Cancers. - 2021. - № 13 (17). - Р. 4447. DOI: https://doi.org/10.3390/cancers13174447.
2. Algorri J.F., Ochoa M., Roldán-Varona P., et al. Photodynamic therapy: A compendium of latest reviews // Cancers. - 2021. - № 13 (17). - Р. 4447. DOI: https://doi.org/10.3390/cancers13174447. 3. Al Nu'airat J., Oluwoye I., Zeinali N., et al. Review of chemical reactivity of singlet oxygen with organic fuels and contaminants // The Chemical Record. - 2021. - № 21 (2). - Р. 315-342. DOI: https://doi.org/10.1002/tcr.202000143.
3. Al Nu'airat J., Oluwoye I., Zeinali N., et al. Review of chemical reactivity of singlet oxygen with organic fuels and contaminants // The Chemical Record. - 2021. - № 21 (2). - Р. 315-342. DOI: https://doi.org/10.1002/tcr.202000143.  4. Asadian E., Jannesari M., Shahbazi M.A. Application of infrared waves in cancer therapy. In Electromagnetic Waves-Based Cancer Diagnosis and Therapy. Academic Press. - 2023: 151-237. DOI: https://doi.org/10.1016/B978-0-323-99628-0.00006-X.
4. Asadian E., Jannesari M., Shahbazi M.A. Application of infrared waves in cancer therapy. In Electromagnetic Waves-Based Cancer Diagnosis and Therapy. Academic Press. - 2023: 151-237. DOI: https://doi.org/10.1016/B978-0-323-99628-0.00006-X. 5. Baptista M.S., Cadet J., Greer A., et al. Photosensitization reactions of biomolecules: definition, targets and mechanisms // Photochemistry and Photobiology. - 2021. - № 97 (6). - Р. 1456-1483. DOI: https://doi.org/10.1111/php.13470.
5. Baptista M.S., Cadet J., Greer A., et al. Photosensitization reactions of biomolecules: definition, targets and mechanisms // Photochemistry and Photobiology. - 2021. - № 97 (6). - Р. 1456-1483. DOI: https://doi.org/10.1111/php.13470. 6. Baskaran R., Lee J., Yang S.G. Clinical development of photodynamic agents and therapeutic applications // Biomaterials research. - 2018; 22(1): 1-8. DOI: https://doi.org/10.1186/s40824-018-0140-z.
6. Baskaran R., Lee J., Yang S.G. Clinical development of photodynamic agents and therapeutic applications // Biomaterials research. - 2018; 22(1): 1-8. DOI: https://doi.org/10.1186/s40824-018-0140-z. 7. Cai H., Huang Y.L., Li D. Biological metal-organic frameworks: Structures, host-guest chemistry and bio-applications // Coordination Chemistry Reviews. - 2019. - № 378. - Р. 207-221. DOI: https://doi.org/10.1016/j.ccr.2017.12.003.
7. Cai H., Huang Y.L., Li D. Biological metal-organic frameworks: Structures, host-guest chemistry and bio-applications // Coordination Chemistry Reviews. - 2019. - № 378. - Р. 207-221. DOI: https://doi.org/10.1016/j.ccr.2017.12.003. 8. Chen C., Wu C., Yu J., Zhu X., et al. Photodynamic-based combinatorial cancer therapy strategies: Tuning the properties of nanoplatform according to oncotherapy needs // Coordination Chemistry Reviews. - 2022. № 461. - Р. 214495. DOI: https://doi.org/10.1016/j.ccr.2022.214495.
8. Chen C., Wu C., Yu J., Zhu X., et al. Photodynamic-based combinatorial cancer therapy strategies: Tuning the properties of nanoplatform according to oncotherapy needs // Coordination Chemistry Reviews. - 2022. № 461. - Р. 214495. DOI: https://doi.org/10.1016/j.ccr.2022.214495. 9. Chen D., Xu Q., Wang W., et al. Type I photosensitizers revitalizing photodynamic oncotherapy // Small. - 2021. - № 17 (31). - Р. 2006742. DOI: https://doi.org/10.1002/smll.202006742.
9. Chen D., Xu Q., Wang W., et al. Type I photosensitizers revitalizing photodynamic oncotherapy // Small. - 2021. - № 17 (31). - Р. 2006742. DOI: https://doi.org/10.1002/smll.202006742. 10. Chen D., Xu Q., Wang W., et al. Type I photosensitizers revitalizing photodynamic oncotherapy // Small. - 2021. - № 17 (31). - Р. 2006742. DOI: https://doi.org/10.1002/smll.202006742.
10. Chen D., Xu Q., Wang W., et al. Type I photosensitizers revitalizing photodynamic oncotherapy // Small. - 2021. - № 17 (31). - Р. 2006742. DOI: https://doi.org/10.1002/smll.202006742. 11. Chen Z., Tian R., She Z., et al. Role of oxidative stress in the pathogenesis of nonalcoholic fatty liver disease // Free Radical Biology and Medicine. - 2020. - № 152. - Р. 116-141. DOI: https://doi.org/10.1016/j.jpba.2021.114477.
11. Chen Z., Tian R., She Z., et al. Role of oxidative stress in the pathogenesis of nonalcoholic fatty liver disease // Free Radical Biology and Medicine. - 2020. - № 152. - Р. 116-141. DOI: https://doi.org/10.1016/j.jpba.2021.114477. 12. Cline B.L., Jiang W., Lee C., et al. Potassium Iodide Nanoparticles Enhance Radiotherapy against Breast Cancer by Exploiting the Sodium-Iodide Symporter. ACS nano. - 2021. - № 15 (11). - Р. 17401-17411. DOI: https://doi.org/10.1021/acsnano.1c01435.
12. Cline B.L., Jiang W., Lee C., et al. Potassium Iodide Nanoparticles Enhance Radiotherapy against Breast Cancer by Exploiting the Sodium-Iodide Symporter. ACS nano. - 2021. - № 15 (11). - Р. 17401-17411. DOI: https://doi.org/10.1021/acsnano.1c01435. 13. Crous A., Abrahamse H. Aluminium (III) phthalocyanine chloride tetrasulphonate is an effective photosensitizer for the eradication of lung cancer stem cells // Royal Society Open Science. - 2021. - № 8 (9). - Р. 210148. DOI: https://doi.org/10.1098/rsos.210148.
13. Crous A., Abrahamse H. Aluminium (III) phthalocyanine chloride tetrasulphonate is an effective photosensitizer for the eradication of lung cancer stem cells // Royal Society Open Science. - 2021. - № 8 (9). - Р. 210148. DOI: https://doi.org/10.1098/rsos.210148. 14. Delcanale P., Abbruzzetti S., Viappiani C. Photodynamic treatment of pathogens. La Rivista del Nuovo Cimento. - 2022. - № 45 (6). - Р. 407-459. DOI: https://doi.org/10.1007/s40766-022-00031-4.
14. Delcanale P., Abbruzzetti S., Viappiani C. Photodynamic treatment of pathogens. La Rivista del Nuovo Cimento. - 2022. - № 45 (6). - Р. 407-459. DOI: https://doi.org/10.1007/s40766-022-00031-4. 15. Dhaini B., Wagner L., Moinard M., et al. Importance of Rose Bengal Loaded with Nanoparticles for Anti-Cancer Photodynamic Therapy // Pharmaceuticals. - 2022. - № 15 (9). - Р. 1093. DOI: https://doi.org/10.3390/ph15091093.
15. Dhaini B., Wagner L., Moinard M., et al. Importance of Rose Bengal Loaded with Nanoparticles for Anti-Cancer Photodynamic Therapy // Pharmaceuticals. - 2022. - № 15 (9). - Р. 1093. DOI: https://doi.org/10.3390/ph15091093. 16. Di Mascio P., Martinez G.R., Miyamoto S., et al. Singlet molecular oxygen reactions with nucleic acids, lipids, and proteins // Chemical reviews. - 2019. - № 119 (3). - Р. 2043-2086. DOI: https://doi.org/10.1021/acs.chemrev.8b00554.
16. Di Mascio P., Martinez G.R., Miyamoto S., et al. Singlet molecular oxygen reactions with nucleic acids, lipids, and proteins // Chemical reviews. - 2019. - № 119 (3). - Р. 2043-2086. DOI: https://doi.org/10.1021/acs.chemrev.8b00554. 17. dos Santos A.F., de Almeida D.Q., Terra L.F., et al. Photodynamic therapy in cancer treatment-an update review // J. Cancer Metastasis Treat. - 2019. - № 5 (25). - Р. 10-20517, DOI: http://dx.doi.org/10.20517/2394-4722.2018.83.
17. dos Santos A.F., de Almeida D.Q., Terra L.F., et al. Photodynamic therapy in cancer treatment-an update review // J. Cancer Metastasis Treat. - 2019. - № 5 (25). - Р. 10-20517, DOI: http://dx.doi.org/10.20517/2394-4722.2018.83. 18. Ferrer-Sueta G., Campolo N., Trujillo M., et al. Biochemistry of peroxynitrite and protein tyrosine nitration // Chemical Reviews. - 2018. - № 118 (3). - Р. 1338-1408. DOI: https://doi.org/10.1021/acs.chemrev.7b00568.
18. Ferrer-Sueta G., Campolo N., Trujillo M., et al. Biochemistry of peroxynitrite and protein tyrosine nitration // Chemical Reviews. - 2018. - № 118 (3). - Р. 1338-1408. DOI: https://doi.org/10.1021/acs.chemrev.7b00568. 19. Gulcin İ. Antioxidants and antioxidant methods: An updated overview // Archives of toxicology. - 2020. - № 94 (3). - Р. 651-715. DOI: https://doi.org/10.1007/s00204-020-02689-3.
19. Gulcin İ. Antioxidants and antioxidant methods: An updated overview // Archives of toxicology. - 2020. - № 94 (3). - Р. 651-715. DOI: https://doi.org/10.1007/s00204-020-02689-3. 20. Hajagos T.J., Liu C., Cherepy N.J., et al. High Z sensitized plastic scintillators: a review // Advanced Materials. - 2018. - № 30 (27). - Р. 1706956. DOI: https://doi.org/10.1002/adma.201706956.
20. Hajagos T.J., Liu C., Cherepy N.J., et al. High Z sensitized plastic scintillators: a review // Advanced Materials. - 2018. - № 30 (27). - Р. 1706956. DOI: https://doi.org/10.1002/adma.201706956. 21. He L., Yu X., Li W. Recent progress and trends in X-ray-induced photodynamic therapy with low radiation doses. ACS nano. - 2022. - № 16 (12). - Р. 19691-19721. DOI: https://doi.org/10.1021/acsnano.2c07286.
21. He L., Yu X., Li W. Recent progress and trends in X-ray-induced photodynamic therapy with low radiation doses. ACS nano. - 2022. - № 16 (12). - Р. 19691-19721. DOI: https://doi.org/10.1021/acsnano.2c07286. 22. Hu J.J., Lei Q., Zhang X.Z. Recent advances in photonanomedicines for enhanced cancer photodynamic therapy // Progress in Materials Science. - 2020. - № 114: 100685. DOI: https://doi.org/10.1016/j.pmatsci.2020.100685.
22. Hu J.J., Lei Q., Zhang X.Z. Recent advances in photonanomedicines for enhanced cancer photodynamic therapy // Progress in Materials Science. - 2020. - № 114: 100685. DOI: https://doi.org/10.1016/j.pmatsci.2020.100685. 23. Jakubaszek M., Goud B., Ferrari S., et al. Mechanisms of action of Ru (II) polypyridyl complexes in living cells upon light irradiation // Chemical Communications. - 2018. - № 54 (93). - Р. 13040-13059. DOI: https://doi.org/10.1039/C8CC05928D.
23. Jakubaszek M., Goud B., Ferrari S., et al. Mechanisms of action of Ru (II) polypyridyl complexes in living cells upon light irradiation // Chemical Communications. - 2018. - № 54 (93). - Р. 13040-13059. DOI: https://doi.org/10.1039/C8CC05928D. 24. Jia P., Dai C., Cao P., et al. The role of reactive oxygen species in tumor treatment // RSC advances. - 2020. - № 10 (13). - Р. 7740-7750. DOI: https://doi.org/10.1039/C9RA10539E.
24. Jia P., Dai C., Cao P., et al. The role of reactive oxygen species in tumor treatment // RSC advances. - 2020. - № 10 (13). - Р. 7740-7750. DOI: https://doi.org/10.1039/C9RA10539E. 25. Karges J. Clinical development of metal complexes as photosensitizers for photodynamic therapy of cancer // Angewandte Chemie International Edition. - 2022. - № 61 (5). - e202112236. DOI: https://doi.org/10.1002/anie.202112236.
25. Karges J. Clinical development of metal complexes as photosensitizers for photodynamic therapy of cancer // Angewandte Chemie International Edition. - 2022. - № 61 (5). - e202112236. DOI: https://doi.org/10.1002/anie.202112236. 26. Kim M.M., Darafsheh A. Light sources and dosimetry techniques for photodynamic therapy // Photochemistry and Photobiology. - 2020. - № 96 (2). - Р. 280-294. DOI: https://doi.org/10.1111/php.13219.
26. Kim M.M., Darafsheh A. Light sources and dosimetry techniques for photodynamic therapy // Photochemistry and Photobiology. - 2020. - № 96 (2). - Р. 280-294. DOI: https://doi.org/10.1111/php.13219. 27. Kirsanova D.Y., Gadzhimagomedova Z.M., Maksimov A.Y., et al. Nanomaterials for deep tumor treatment. Mini Reviews in Medicinal Chemistry. - 2021. - № 21 (6). - Р. 677-688. DOI: https://doi.org/10.2174/1389557520666201111161705.
27. Kirsanova D.Y., Gadzhimagomedova Z.M., Maksimov A.Y., et al. Nanomaterials for deep tumor treatment. Mini Reviews in Medicinal Chemistry. - 2021. - № 21 (6). - Р. 677-688. DOI: https://doi.org/10.2174/1389557520666201111161705. 28. Koju N., Taleb A., Zhou J., et al. Pharmacological strategies to lower crosstalk between nicotinamide adenine dinucleotide phosphate (NADPH) oxidase and mitochondria // Biomedicine & Pharmacotherapy. - 2019. - № 111. - Р. 478-1498. DOI: https://doi.org/10.1016/j.biopha.2018.11.128.
28. Koju N., Taleb A., Zhou J., et al. Pharmacological strategies to lower crosstalk between nicotinamide adenine dinucleotide phosphate (NADPH) oxidase and mitochondria // Biomedicine & Pharmacotherapy. - 2019. - № 111. - Р. 478-1498. DOI: https://doi.org/10.1016/j.biopha.2018.11.128. 29. Kołodziej U., Maciejczyk M., Zalewska A. Oxidative stress-repair systems of oxidatively damaged biomolecules // Progress in Health Sciences. - 2018. - № 8. - Р. 141-150. DOI: https://doi.org/10.5604/01.3001.0012.1118.
29. Kołodziej U., Maciejczyk M., Zalewska A. Oxidative stress-repair systems of oxidatively damaged biomolecules // Progress in Health Sciences. - 2018. - № 8. - Р. 141-150. DOI: https://doi.org/10.5604/01.3001.0012.1118. 30. Korać J., Stanković D.M., Stanić M., et al. Coordinate and redox interactions of epinephrine with ferric and ferrous iron at physiological pH. Scientific reports. - 2018. - № 8 (1). - 3530. DOI: https://doi.org/10.1038/s41598-018-21940-7.
30. Korać J., Stanković D.M., Stanić M., et al. Coordinate and redox interactions of epinephrine with ferric and ferrous iron at physiological pH. Scientific reports. - 2018. - № 8 (1). - 3530. DOI: https://doi.org/10.1038/s41598-018-21940-7. 31. Köse G.G., Karaoğlan G.K., Maden Y.E., et al. Novel silicon phthalocyanine photosensitizers containing carboxylic acid based axial anchoring groups: Electrochemistry, spectroelectrochemistry, and dye sensitized solar cell performance // Dyes and Pigments. - 2022. - № 207. - Р. 110686. DOI: https://doi.org/10.1016/j.dyepig.2022.110686.
31. Köse G.G., Karaoğlan G.K., Maden Y.E., et al. Novel silicon phthalocyanine photosensitizers containing carboxylic acid based axial anchoring groups: Electrochemistry, spectroelectrochemistry, and dye sensitized solar cell performance // Dyes and Pigments. - 2022. - № 207. - Р. 110686. DOI: https://doi.org/10.1016/j.dyepig.2022.110686. 32. Kwiatkowski S., Knap B., Przystupski D., et al. Photodynamic therapy-mechanisms, photosensitizers and combinations // Biomedicine & Pharmacotherapy. - 2018. - № 106. - Р. 1098-1107. DOI: https://doi.org/10.1016/j.biopha.2018.07.049.
32. Kwiatkowski S., Knap B., Przystupski D., et al. Photodynamic therapy-mechanisms, photosensitizers and combinations // Biomedicine & Pharmacotherapy. - 2018. - № 106. - Р. 1098-1107. DOI: https://doi.org/10.1016/j.biopha.2018.07.049. 33. Lan M., Zhao S., Liu W., et al. Photosensitizers for photodynamic therapy. Advanced healthcare materials. - 2029. - № 8 (13). - Р. 1900132. DOI: https://doi.org/10.1002/adhm.201900132.
33. Lan M., Zhao S., Liu W., et al. Photosensitizers for photodynamic therapy. Advanced healthcare materials. - 2029. - № 8 (13). - Р. 1900132. DOI: https://doi.org/10.1002/adhm.201900132. 34. Li X., Lovell J.F., Yoon J., et al. Clinical development and potential of photothermal and photodynamic therapies for cancer // Nature reviews Clinical oncology. - 2020. - № 17 (11). - Р. 657-674. DOI: https://doi.org/10.1038/s41571-020-0410-2.
34. Li X., Lovell J.F., Yoon J., et al. Clinical development and potential of photothermal and photodynamic therapies for cancer // Nature reviews Clinical oncology. - 2020. - № 17 (11). - Р. 657-674. DOI: https://doi.org/10.1038/s41571-020-0410-2. 35. Li X., Luo R., Liang X., et al. Recent advances in enhancing reactive oxygen species based chemodynamic therapy // Chinese Chemical Letters. - 2022. - № 33 (5). - Р. 2213-2230. DOI: https://doi.org/10.1016/j.cclet.2021.11.048.
35. Li X., Luo R., Liang X., et al. Recent advances in enhancing reactive oxygen species based chemodynamic therapy // Chinese Chemical Letters. - 2022. - № 33 (5). - Р. 2213-2230. DOI: https://doi.org/10.1016/j.cclet.2021.11.048. 36. Li Z., Hao S., Ji W., et al. Mechanism of long afterglow in SrAl2O4: Eu phosphors. Ceramics International. - 2021. - № 47 (23). - Р. 32947-32953. DOI: https://doi.org/10.1016/j.ceramint.2021.08.193.
36. Li Z., Hao S., Ji W., et al. Mechanism of long afterglow in SrAl2O4: Eu phosphors. Ceramics International. - 2021. - № 47 (23). - Р. 32947-32953. DOI: https://doi.org/10.1016/j.ceramint.2021.08.193. 37. Lin L., Song X., Dong X., et al. Nano-photosensitizers for enhanced photodynamic therapy // Photodiagnosis and Photodynamic Therapy. - 2021; 36: 102597. DOI: https://doi.org/10.1016/j.pdpdt.2021.102597.
37. Lin L., Song X., Dong X., et al. Nano-photosensitizers for enhanced photodynamic therapy // Photodiagnosis and Photodynamic Therapy. - 2021; 36: 102597. DOI: https://doi.org/10.1016/j.pdpdt.2021.102597. 38. Luo T., Nash G.T., Xu Z., et al. Nanoscale metal-organic framework confines zinc-phthalocyanine photosensitizers for enhanced photodynamic therapy // Journal of the American Chemical Society. - 2021. - Р. 143 (34). - Р. 13519-13524. DOI: https://doi.org/10.1021/jacs.1c07379.
38. Luo T., Nash G.T., Xu Z., et al. Nanoscale metal-organic framework confines zinc-phthalocyanine photosensitizers for enhanced photodynamic therapy // Journal of the American Chemical Society. - 2021. - Р. 143 (34). - Р. 13519-13524. DOI: https://doi.org/10.1021/jacs.1c07379. 39. Ma L., Chen W., Schatte G., et al. A new Cu-cysteamine complex: structure and optical properties // Journal of Materials Chemistry C. - 2014. - Р. 2 (21). - Р. 4239-4246. DOI: https://doi.org/10.1039/C4TC00114A.
39. Ma L., Chen W., Schatte G., et al. A new Cu-cysteamine complex: structure and optical properties // Journal of Materials Chemistry C. - 2014. - Р. 2 (21). - Р. 4239-4246. DOI: https://doi.org/10.1039/C4TC00114A. 40. Martemucci G., Costagliola C., Mariano M., et al. Free radical properties, source and targets, antioxidant consumption and health // Oxygen. - 2020. - № 2 (2). - Р. 48-78. DOI: https://doi.org/10.3390/oxygen2020006.
40. Martemucci G., Costagliola C., Mariano M., et al. Free radical properties, source and targets, antioxidant consumption and health // Oxygen. - 2020. - № 2 (2). - Р. 48-78. DOI: https://doi.org/10.3390/oxygen2020006. 41. Moldogazieva N.T., Mokhosoev I.M., Feldman N.B., et al. ROS and RNS signalling: adaptive redox switches through oxidative/nitrosative protein modifications // Free Radical Research. - 2018. - Р. 52 (5). - Р. 507-543. DOI: https://doi.org/10.1080/10715762.2018.1457217.
41. Moldogazieva N.T., Mokhosoev I.M., Feldman N.B., et al. ROS and RNS signalling: adaptive redox switches through oxidative/nitrosative protein modifications // Free Radical Research. - 2018. - Р. 52 (5). - Р. 507-543. DOI: https://doi.org/10.1080/10715762.2018.1457217. 42. Morita S.Y., Ikeda Y. Regulation of membrane phospholipid biosynthesis in mammalian cells // Biochemical Pharmacology. - 2022. - Р. 115296. DOI: https://doi.org/10.1016/j.bcp.2022.115296.
42. Morita S.Y., Ikeda Y. Regulation of membrane phospholipid biosynthesis in mammalian cells // Biochemical Pharmacology. - 2022. - Р. 115296. DOI: https://doi.org/10.1016/j.bcp.2022.115296. 43. Ni J., Wang Y., Zhang H., Sun J.Z., et al. Aggregation-induced generation of reactive oxygen species: mechanism and photosensitizer construction // Molecules. - 2021. - № 26 (2). - Р. 268. DOI: https://doi.org/10.3390/molecules26020268.
43. Ni J., Wang Y., Zhang H., Sun J.Z., et al. Aggregation-induced generation of reactive oxygen species: mechanism and photosensitizer construction // Molecules. - 2021. - № 26 (2). - Р. 268. DOI: https://doi.org/10.3390/molecules26020268.  44. Niculescu A.G., Grumezescu A.M. Photodynamic therapy - an up-to-date review // Applied Sciences. - 2021. - № 1 (8). - Р. 3626. DOI: https://doi.org/10.3390/app11083626.
44. Niculescu A.G., Grumezescu A.M. Photodynamic therapy - an up-to-date review // Applied Sciences. - 2021. - № 1 (8). - Р. 3626. DOI: https://doi.org/10.3390/app11083626. 45. Nogueira L., Tracey A., Alvim R., et al. PD43-01 Updated treatment results from a Phase I study of WST11 phototherapy (VTP) for upper tract urothelial carcinoma // The Journal of Urology. - 2021. - № 206 (Supplement 3): e730-e730. DOI: https://doi.org/10.1097/JU.0000000000002057.01.
45. Nogueira L., Tracey A., Alvim R., et al. PD43-01 Updated treatment results from a Phase I study of WST11 phototherapy (VTP) for upper tract urothelial carcinoma // The Journal of Urology. - 2021. - № 206 (Supplement 3): e730-e730. DOI: https://doi.org/10.1097/JU.0000000000002057.01. 46. Olszowy M., Nowak-Perlak M., Woźniak M. Current Strategies in Photodynamic Therapy (PDT) and Photodynamic Diagnostics (PDD) and the Future Potential of Nanotechnology in Cancer Treatment // Pharmaceutics. - 2023. - № 15 (6). - Р. 1712. DOI: https://doi.org/10.3390/pharmaceutics15061712.
46. Olszowy M., Nowak-Perlak M., Woźniak M. Current Strategies in Photodynamic Therapy (PDT) and Photodynamic Diagnostics (PDD) and the Future Potential of Nanotechnology in Cancer Treatment // Pharmaceutics. - 2023. - № 15 (6). - Р. 1712. DOI: https://doi.org/10.3390/pharmaceutics15061712. 47. Pallavi P., Girigoswami A., Girigoswami K., et al. Photodynamic therapy in cancer. Handbook of Oxidative Stress in Cancer: Therapeutic Aspects. - 2022. - Р. 1-24. DOI: https://doi.org/10.1007/978-981-16-1247-3_232-1.
47. Pallavi P., Girigoswami A., Girigoswami K., et al. Photodynamic therapy in cancer. Handbook of Oxidative Stress in Cancer: Therapeutic Aspects. - 2022. - Р. 1-24. DOI: https://doi.org/10.1007/978-981-16-1247-3_232-1. 48. Perego J., Villa I., Pedrini A., Padovani E.C., et al. Composite fast scintillators based on high-Z fluorescent metal-organic framework nanocrystals // Nature Photonics. - 2021. - № 15 (5). - Р. 393-400. DOI: https://doi.org/10.1038/s41566-021-00769-z.
48. Perego J., Villa I., Pedrini A., Padovani E.C., et al. Composite fast scintillators based on high-Z fluorescent metal-organic framework nanocrystals // Nature Photonics. - 2021. - № 15 (5). - Р. 393-400. DOI: https://doi.org/10.1038/s41566-021-00769-z. 49. Plekhova N., Shevchenko O., Korshunova O., et al. Development of Novel tetrapyrrole structure Photosensitizers for cancer Photodynamic therapy // Bioengineering. - 2022. - № 9 (2). - Р. 82. DOI: https://doi.org/10.3390/bioengineering9020082.
49. Plekhova N., Shevchenko O., Korshunova O., et al. Development of Novel tetrapyrrole structure Photosensitizers for cancer Photodynamic therapy // Bioengineering. - 2022. - № 9 (2). - Р. 82. DOI: https://doi.org/10.3390/bioengineering9020082. 50. Poetsch A.R. The genomics of oxidative DNA damage, repair, and resulting mutagenesis // Computational and Structural Biotechnology Journal. - 2020. - № 18. - Р. 207-219. DOI: https://doi.org/10.1016/j.csbj.2019.12.013.
50. Poetsch A.R. The genomics of oxidative DNA damage, repair, and resulting mutagenesis // Computational and Structural Biotechnology Journal. - 2020. - № 18. - Р. 207-219. DOI: https://doi.org/10.1016/j.csbj.2019.12.013. 51. Ren X.D., Hao X.Y., Li H.C., et al. Progress in the development of nanosensitizers for X-ray-induced photodynamic therapy // Drug Discovery Today. - 2018. - № 23 (10). - Р. 1791-1800. DOI: https://doi.org/10.1016/j.drudis.2018.05.029.
51. Ren X.D., Hao X.Y., Li H.C., et al. Progress in the development of nanosensitizers for X-ray-induced photodynamic therapy // Drug Discovery Today. - 2018. - № 23 (10). - Р. 1791-1800. DOI: https://doi.org/10.1016/j.drudis.2018.05.029. 52. Singh A.K., Malviya R., Moharana A., et al. Photodynamic Therapy of Cancer: Quality and Prospective of Therapy based on Photosensitizer // Current Cancer Therapy Reviews. - 2023. - № 19 (3). - Р. 223-236. DOI: https://doi.org/10.2174/1573394719666230119142053.
52. Singh A.K., Malviya R., Moharana A., et al. Photodynamic Therapy of Cancer: Quality and Prospective of Therapy based on Photosensitizer // Current Cancer Therapy Reviews. - 2023. - № 19 (3). - Р. 223-236. DOI: https://doi.org/10.2174/1573394719666230119142053. 53. Souris J.S., Leoni L., Zhang H.J., et al. X-ray Activated Nanoplatforms for Deep Tissue Photodynamic Therapy // Nanomaterials. - 2023. - № 13 (4). - Р. 673. DOI: https://doi.org/10.3390/nano13040673.
53. Souris J.S., Leoni L., Zhang H.J., et al. X-ray Activated Nanoplatforms for Deep Tissue Photodynamic Therapy // Nanomaterials. - 2023. - № 13 (4). - Р. 673. DOI: https://doi.org/10.3390/nano13040673. 54. Srinivas U.S., Tan B.W, Vellayappan B.A., et al. ROS and the DNA damage response in cancer. Redox biology. - 2019. - № 25. - Р. 101084. DOI: https://doi.org/10.1016/j.redox.2018.101084.
54. Srinivas U.S., Tan B.W, Vellayappan B.A., et al. ROS and the DNA damage response in cancer. Redox biology. - 2019. - № 25. - Р. 101084. DOI: https://doi.org/10.1016/j.redox.2018.101084.  55. Sun W., Zhou Z., Pratx G., et al. Nanoscintillator-mediated X-ray induced photodynamic therapy for deep-seated tumors: from concept to biomedical applications // Theranostics. - 2020. - Р. 10 (3). - Р. 1296. DOI: https://doi.org/10.7150/thno.41578.
55. Sun W., Zhou Z., Pratx G., et al. Nanoscintillator-mediated X-ray induced photodynamic therapy for deep-seated tumors: from concept to biomedical applications // Theranostics. - 2020. - Р. 10 (3). - Р. 1296. DOI: https://doi.org/10.7150/thno.41578. 56. Teng K.X., Chen W.K., Niu L.Y., et al. BODIPY-based photodynamic agents for exclusively generating superoxide radical over singlet oxygen // Angewandte Chemie International Edition. - 2021. - № 60 (36). - Р. 19912-19920. DOI: https://doi.org/10.1002/anie.202106748.
56. Teng K.X., Chen W.K., Niu L.Y., et al. BODIPY-based photodynamic agents for exclusively generating superoxide radical over singlet oxygen // Angewandte Chemie International Edition. - 2021. - № 60 (36). - Р. 19912-19920. DOI: https://doi.org/10.1002/anie.202106748. 57. Tsubone T.M., Martins W.K., Franco M.S., et al. Cellular compartments challenged by membrane photo-oxidation // Archives of Biochemistry and Biophysics. - 2021. - № 697. - Р. 108665. DOI: https://doi.org/10.1016/j.abb.2020.108665.
57. Tsubone T.M., Martins W.K., Franco M.S., et al. Cellular compartments challenged by membrane photo-oxidation // Archives of Biochemistry and Biophysics. - 2021. - № 697. - Р. 108665. DOI: https://doi.org/10.1016/j.abb.2020.108665.  58. Wang J.X., Gutiérrez-Arzaluz L., Wang X., et al. Heavy-atom engineering of thermally activated delayed fluorophores for high-performance X-ray imaging scintillators // Nature Photonics. - 2022. -№ 16 (12). - Р. 869-875. DOI: https://doi.org/10.1038/s41566-022-01092-x.
58. Wang J.X., Gutiérrez-Arzaluz L., Wang X., et al. Heavy-atom engineering of thermally activated delayed fluorophores for high-performance X-ray imaging scintillators // Nature Photonics. - 2022. -№ 16 (12). - Р. 869-875. DOI: https://doi.org/10.1038/s41566-022-01092-x. 59. Wang Z., Zou Y., Li Y., Cheng Y. Metal containing polydopamine nanomaterials: catalysis, energy, and theranostics // Small. - 2020. - № 16 (18). - Р. 1907042. DOI: https://doi.org/10.1002/smll.201907042.
59. Wang Z., Zou Y., Li Y., Cheng Y. Metal containing polydopamine nanomaterials: catalysis, energy, and theranostics // Small. - 2020. - № 16 (18). - Р. 1907042. DOI: https://doi.org/10.1002/smll.201907042. 60. Xiao J., Cong H., Wang S., et al. Recent research progress in the construction of active free radical nanoreactors and their applications in photodynamic therapy // Biomaterials science. - 2021. - № 9 (7). - Р. 2384-2412. DOI: DOI https://doi.org/10.1039/D0BM02013C.
60. Xiao J., Cong H., Wang S., et al. Recent research progress in the construction of active free radical nanoreactors and their applications in photodynamic therapy // Biomaterials science. - 2021. - № 9 (7). - Р. 2384-2412. DOI: DOI https://doi.org/10.1039/D0BM02013C. 61. Yang L., Gao P., Huang Y., et al. Boosting the photodynamic therapy efficiency with a mitochondria-targeted nanophotosensitizer // Chinese Chemical Letters. - 2019. - № 30 (6). - Р. 1293-1296. DOI: https://doi.org/10.1016/j.cclet.2019.03.032.
61. Yang L., Gao P., Huang Y., et al. Boosting the photodynamic therapy efficiency with a mitochondria-targeted nanophotosensitizer // Chinese Chemical Letters. - 2019. - № 30 (6). - Р. 1293-1296. DOI: https://doi.org/10.1016/j.cclet.2019.03.032. 62. Yong-Fang Z., Yong-Li Y., Ning Z., et al. LaF3: Tb Nanoparticles Coated with 5-Aminoisophthalic Acid Sensitizer and Their Applications in Immunolabeling and Imaging of Hela Cells // Chinese Journal of Inorganic Chemistry. - 2014. - № 30 (10). - Р. 2315-2322. DOI: https://doi.org/10.11862/CJIC.2014.328
62. Yong-Fang Z., Yong-Li Y., Ning Z., et al. LaF3: Tb Nanoparticles Coated with 5-Aminoisophthalic Acid Sensitizer and Their Applications in Immunolabeling and Imaging of Hela Cells // Chinese Journal of Inorganic Chemistry. - 2014. - № 30 (10). - Р. 2315-2322. DOI: https://doi.org/10.11862/CJIC.2014.328 63. Zhang J., Jiang C., Longo J.P.F., et al. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy // Acta Pharmaceutica Sinica B. - 2018. - № 8 (2). - Р. 137-146. DOI: https://doi.org/10.1016/j.apsb.2017.09.003.
63. Zhang J., Jiang C., Longo J.P.F., et al. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy // Acta Pharmaceutica Sinica B. - 2018. - № 8 (2). - Р. 137-146. DOI: https://doi.org/10.1016/j.apsb.2017.09.003.  64. Zhao X., Liu J., Fan J., et al. Recent progress in photosensitizers for overcoming the challenges of photodynamic therapy: from molecular design to application // Chemical Society Reviews. - 2021. - № 50 (6). - Р. 185-4219. DOI: https://doi.org/10.1039/D0CS00173B.
64. Zhao X., Liu J., Fan J., et al. Recent progress in photosensitizers for overcoming the challenges of photodynamic therapy: from molecular design to application // Chemical Society Reviews. - 2021. - № 50 (6). - Р. 185-4219. DOI: https://doi.org/10.1039/D0CS00173B. 65. Zhu W., Ma W., Su Y., et al. Low-dose real-time X-ray imaging with nontoxic double perovskite scintillators // Light: Science & Applications. - 2020. - № 9 (1). - Р. 112. DOI: https://doi.org/10.1038/s41377-020-00353-0.
65. Zhu W., Ma W., Su Y., et al. Low-dose real-time X-ray imaging with nontoxic double perovskite scintillators // Light: Science & Applications. - 2020. - № 9 (1). - Р. 112. DOI: https://doi.org/10.1038/s41377-020-00353-0.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Обсуждение |
 |
Список источников |
Оригинальная верстка  |
|
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»