2024 год № 3
Медико-биологические науки
1gusilia99@mail.ru, https://orcid.org/0000-0002-6199-4278
2mishanya_percev@mail.ru, https://orcid.org/0009-0009-2729-1323
3malofey2009@mail.ru, https://orcid.org/0000-0001-5698-3665
4habmed@rambler.ru, https://orcid.org/0000-0002-3074-6706
5basset_2004@mail.ru, https://orcid.org/0000-0002-4054-1675
5sazen@mail.ru, https://orcid.org/0000-0002-8668-492X
6Хабаровский филиал ФГБНУ "Дальневосточный научный центр физиологии и патологии дыхания" - Научно-исследовательский институт охраны материнства и детства, Хабаровск, Россия
Аннотация:
Ключевые слова:
1gusilia99@mail.ru, https://orcid.org/0000-0002-6199-4278
2mishanya_percev@mail.ru
3malofey2009@mail.ru, https://orcid.org/0000-0001-5698-3665
6sazen@mail.ru, https://orcid.org/0000-0002-8668-492X
6Khabarovsk branch of the Far Eastern Scientific Center for Physiology and Pathology of Respiration - Research Institute for the Protection of Motherhood and Childhood, Khabarovsk, Russia
Abstract:
Key words:
Введение |
 |
 |
Внутриутробная гипоксия (ВУГ) индуцирует кардиальные нарушения, которые диагностируются в 40-70 % случаев ВУГ и занимают одно из ведущих мест в структуре перинатальной заболеваемости и смертности [1]. Морфологические проявления повреждения сердца после ВУГ включают деструкцию митохондрий в сочетании с уменьшением количества митохондриально-нексусных комплексов [2], лизис миофибрилл, снижение экспрессии кардиальных тропонинов T и I [3]. Постгипоксические повреждения вызывают активацию апоптоза [4] и снижение уровня пролиферации кардиомиоцитов (КМЦ) [5], что приводит к выраженному структурному дефициту сердца. Структурный дефицит, в дальнейшем, сочетается с ремоделированием интерстиция миокарда в виде утолщения коллагеновых волокон [6], увеличения доли коллагена I типа [4].
Ранее работами нашей лаборатории было показано, что у 7-суточных белых крыс, перенесших ВУГ, регистрируется уменьшение массы сердца, снижение ДНК-синтетической активности КМЦ и количества ядрышек в ядрах КМЦ [7]; достоверное уменьшение размеров ядер КМЦ, увеличение в КМЦ экспрессии маркера макроаутофагии беклин-1 [8]. Также нами было зарегистрировано отдалённое последствие ВУГ в виде фиброза миокарда у половозрелых крыс [9]. Сведений литературы о раннем ремоделировании межклеточного матрикса миокарда, а также роли синтеза оксида азота в миокарде новорожденных животных, перенесших ВУГ, нами выявлено не было.
Цель настоящего исследования - экспериментальное изучение ранних постнатальных структурных нарушений сердца, индуцированных ВУГ.
Материалы и методы
|
 |
 |
В исследовании использовали 3-месячных беременных самок белых крыс Вистар и их 7-суточное потомство. Постановку опытов и содержание животных выполняли в соответствии с ГОСТ 33216-2014 "Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами". Исследование одобрено этическим комитетом ФГБОУ ВО ДВГМУ Минздрава России (протокол № 1 от 15.11.2021). Внутриутробную гипоксию (ВУГ) моделировали путём 4-часового гипобарического воздействия на беременных самок белых крыс в экспериментальной гипобарической камере ежесуточно с 15-х по 19-е сутки гестации (давление воздуха - 310 мм рт. ст., парциальное давление кислорода - 55 мм рт. ст., что соответствует "высоте" 7 000 м над уровнем моря). После рождения потомства формировали следующие экспериментальные группы:
1) "Контроль"(n=10): 7-суточное потомство интактных самок белых крыс.
2) "ВУГ"(n=10): 7-суточное потомство самок белых крыс, подвергнутых гипобарической гипоксии с 15 по 19 сутки гестации.
В каждую экспериментальную группу входили 7-суточные животные из 4 выводков (по 2-3 животных из выводка). Всего в эксперименте было использовано 30 белых крыс.
После выведения 7-суточных животных из эксперимента путём быстрой декапитации, сердце извлекали из грудной клетки, промывали изотоническим раствором хлорида натрия, обсушивали фильтровальной бумагой и взвешивали на электронных весах. Затем орган фиксировали в 10 % забуференном нейтральном формалине, после фиксации проводили препаровку сердец: выполняли вскрытие полостей правого и левого желудочков путём продольного разреза от основания сердца к верхушке для получения гистотопографического среза. Полученные биоптаты подвергали стандартной гистологической обработке для изготовления парафиновых срезов.
Для оценки количества ядрышек в ядрах КМЦ, срезы сердца окрашивали нитратом серебра по методике AgNOR в модификации Коржевского Д.Э. [10]. Проводили подсчёт количества ядрышек в ядрах КМЦ субэндокардиальных зон миокарда левого и правого желудочков сердца на основании оценки не менее 200 КМЦ каждой зоны. В оцениваемых зонах анализировали среднее количество ядрышек на ядро КМЦ, а также доли субпопуляций КМЦ с различным количеством ядрышек (в %).
Для оценки содержания ретикулярных волокон гистотопографические срезы сердца окрашивали методом импрегнации серебром по Гомори с использованием диагностического набора ("Эрго-Продакшн", Россия). Полученные препараты оценивали в программе-анализаторе изображений ToupView (Touptek, США), при увеличении 100×10 с использованием точечной сетки по методике Г.Г. Автандилова [11]. Объёмную плотность ретикулярных волокон определяли как отношение числа точек, занятых ретикулярными волокнами, к общему количеству точек в сетке, и выражали в %.
Для иммуногистохимического исследования срезы сердца монтировались на предметные стёкла с адгезивным электростатическим покрытием Super Frost Plus (Thermo Fisher Scientific, Германия). Выявляли КМЦ, меченные поликлональными антителами к белку эндотелиальной NO-синтазы (eNOS) (Affinity Biosciences, Китай), окрашивание меченых КМЦ проводили с помощью набора Novolink TM Polymer Detection System ("Leica Biosystems", Великобритания) в соответствии с протоколом производителя. Подсчёт eNOS+ КМЦ проводили на световом микроскопе Микмед-6 (АО "ЛОМО", Россия) при увеличении 10х100 при анализе не менее 500 клеток субэндокардиального слоя миокарда левого и правого желудочков.
Статистическую обработку полученных данных выполняли в программе "Statistica 6.0". Гипотезу о нормальности распределения проверяли при помощи тестов Шапиро-Уилка и Колмогорова-Смирнова. При нормальности распределения данных достоверность отличий оценивали с использованием t-критерия Стьюдента, данные представляли в виде M±m. Если распределение отличалось от нормального, значимость отличий определяли при расчёте непараметрического критерия Манна-Уитни и выражали результаты в виде Me (Q1;Q3). Различия между группами считали статистически достоверными при р≤0,05.
Результаты и обсуждение
|
 |
 |
Количество ядрышек в ядрах КМЦ косвенно отражает активность анаболических (пролиферативных и белок-синтетических) процессов в клетках миокарда [12], а также является чувствительным критерием уровня клеточного стресса [13, 14].У 7-суточных крыс, перенесших ВУГ, в КМЦ левого желудочка не было выявлено достоверного изменения показателей среднего количества ядрышек на ядро. Также отсутствовали достоверные изменения соотношения субпопуляций КМЦ с разным количеством ядрышек (рис. 1а). Вместе с тем следует отметить тенденцию к снижению среднего количества ядрышек на ядро и возрастанию доли одноядрышковых КМЦ с уменьшением доли двуядрышковых КМЦ в подопытной группе животных.
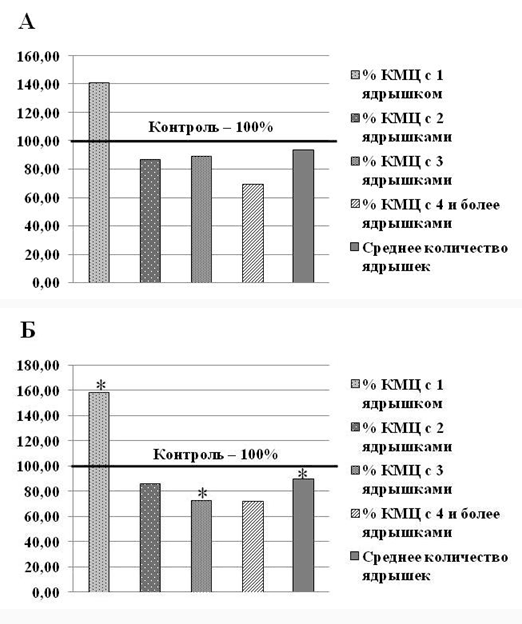
Рис. 1. Показатели количества ядрышек в ядрах кардиомиоцитов (КМЦ) и доля (%) КМЦ с разным количеством ядрышек в субэндокардиальной зоне миокарда желудочков у белых крыс в группе "ВУГ" (в % от контрольных значений): А - левый желудочек; Б - правый желудочек. Примечание. * - р<0,05 по отношению к группе "Контроль".
Анализ нуклеолярного аппарата КМЦ правого желудочка в группе "ВУГ" выявил достоверное снижение среднего количества ядрышек на ядро, достоверное повышение количества одноядрышковых КМЦ на 58 %, при статистически значимом уменьшении доли КМЦ с тремя ядрышками на 27 % (рис. 1б). Зарегистрированный эффект совпадает с полученными нами ранее сведениями о влиянии ВУГ на нуклеолярный аппарат КМЦ [7]. В ранее проведенных исследованиях нами были зарегистрированы выраженные проявления окислительного стресса на органном уровне у новорожденных белых крыс, перенесших ВУГ [7, 8]. Дестабилизация ядрышек на фоне клеточного стресса вызывает нарушения транскрипции рРНК и белок-синтетической функции клеток, приводит к накоплению проапоптотического белка р53 [13].
Большая тяжесть структурных последствий ВУГ в правом желудочке по сравнению с левым желудочком в нашем исследовании подтверждает данные литературы [1]. Низкое парциальное давление кислорода в альвеолах на фоне гипоксии индуцирует гипертензию в сосудах малого круга, которая способна привести к селективной перегрузке правого желудочка давлением и вызвать его структурные изменения [15].
На фоне постгипоксического ремоделирования миокарда соотношение компонентов стромы может измениться в пользу волокон, содержащих коллаген [16]. Начальные этапы миокардиального фиброза проявляются увеличением количества коллагена III типа [17]. Данный вид коллагена является главным компонентом ретикулярных волокон, образующих сеть в строме миокарда [18].
В нашем исследовании, мы не выявили достоверных отличий у 7-суточных животных подопытной группы от контроля по количеству ретикулярных волокон в строме миокарда обоих желудочков сердца (рис. 2). Отсутствие признаков ремоделирования миокарда за счёт ретикулярных волокон можно объяснить тем, что основной вклад в фиброз миокарда после ВУГ вносит накопление коллагена I типа [6].
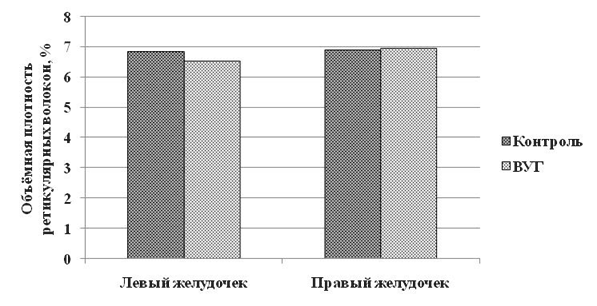
Рис. 2. Объёмная плотность ретикулярных волокон в межклеточном матриксе миокарда белых крыс исследуемых групп
Ремоделирование миокардиальной стромы может регулироваться синтезом оксида азота. По данным литературы, на фоне "нокаута" NO-синтаз наблюдается усиленный миокардиальный фиброз, что позволяет предположить наличие антифиброгенной активности у NO в межклеточном матриксе миокарда [19]. В связи с этими данными, мы провели исследование активности экспрессии eNOS в миокарде исследуемых животных. Внутриутробное гипоксическое воздействие привело к росту экспрессии эндотелиальной синтазы оксида азота: наблюдалось повышение количества eNOS+ КМЦ на 37 % и на 27 % в миокарде правого и левого желудочка, соответственно (рис. 3).
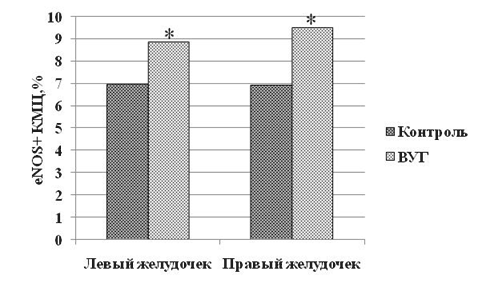
Рис. 3. Доля eNOS+КМЦ в миокарде белых крыс исследуемых групп Примечание. * - р<0,05 по отношению к группе "Контроль".
Оксид азота (NO), продуцируемый эндотелиальной NO-синтазой (eNOS), тесно вовлечён как в процессы морфогенеза коронарных артерий и микроциркуляторного русла фетального миокарда, так и в созревание ткани сердца в раннем неонатальном периоде [20]. NO может обладать кардиопротективной активностью [21]. Увеличение экспрессии eNOS в КМЦ, после ВУГ может быть компенсаторным механизмом, направленным на адекватное обеспечение тканевой перфузии, уменьшение избыточной активности катехоламинов и других вазоконстрикторных молекул [22].
Вместе с тем прямые эффекты NO в миокарде могут иметь различную направленность. Избыточный синтез NO, индуцированный ВУГ, приводит к накоплению пероксинитрита в ткани сердца, что может усугубить окислительный стресс миокарда [23]. С другой стороны, повышение уровня NO на фоне ранних последствий ВУГ может нести адаптивный характер и улучшать выживаемость КМЦ за счёт регулирования активности проапоптотического фермента каспазы-3 [24]. Кроме того, NO может предотвращать деградацию фактора HIF-1α в протеасомах, который активирует синтез ряда кардиопротективных молекул: эритропоэтина, индуцибельной NO-синтазы, гемоксигеназы-1 [23]. Поскольку высокая экспрессия NO-синтазы не сопровождалась выраженным структурным повреждением миокарда новорожденных животных, полученные результаты свидетельствуют о компенсаторном повышении синтеза оксида азота.
Выводы
|
 |
 |
1. Воздействие ВУГ приводит к нарушениям со стороны нуклеолярного аппарата КМЦ белых крыс в неонатальном периоде.
2. ВУГ не привела к значимому накоплению ретикулярных волокон в межклеточном матриксе миокарда в неонатальном периоде у белых крыс, перенесших ВУГ.
3. ВУГ индуцирует повышение экспрессии эндотелиальной NO-синтазы (eNOS) в КМЦ подопытных животных, что может иметь компенсаторное значение.
Список источников |
 |
 1. Кулида Л.В., Малышева М.В., Перетятко Л.П., Сарыева О.П., Проценко Е.В. Патоморфология гипоксически-ишемических повреждений миокарда у новорожденных 22-27 недель гестации // Архив патологии. - 2021. - Т. 83, № 4. - С. 29-34.
1. Кулида Л.В., Малышева М.В., Перетятко Л.П., Сарыева О.П., Проценко Е.В. Патоморфология гипоксически-ишемических повреждений миокарда у новорожденных 22-27 недель гестации // Архив патологии. - 2021. - Т. 83, № 4. - С. 29-34. 2. Петрук Н.С., Иванченко М.В., Твердохлеб И.В. Взаимосвязь реакций митохондриального аппарата и распределения нексусов сократительных кардиомиоцитов в постнатальном онтогенезе в ответ на воздействие хронической внутриутробной гипоксии в эксперименте // Вестник ВолгГМУ. - 2014. - Т. 50, № 2. - С. 97-100.
2. Петрук Н.С., Иванченко М.В., Твердохлеб И.В. Взаимосвязь реакций митохондриального аппарата и распределения нексусов сократительных кардиомиоцитов в постнатальном онтогенезе в ответ на воздействие хронической внутриутробной гипоксии в эксперименте // Вестник ВолгГМУ. - 2014. - Т. 50, № 2. - С. 97-100. 3. Кулида Л.В., Проценко Е.В., Сарыева О.П. Морфологическая характеристика миокарда глубоконедоношенных новорожденных, развивавшихся в условиях хроничeской внутриутробной гипоксии // Современные проблемы науки и образования. - 2023. - № 1. - С. 66.
3. Кулида Л.В., Проценко Е.В., Сарыева О.П. Морфологическая характеристика миокарда глубоконедоношенных новорожденных, развивавшихся в условиях хроничeской внутриутробной гипоксии // Современные проблемы науки и образования. - 2023. - № 1. - С. 66. 4. Chai N., Zhang H., Li L., Yu X., Liu Y., Lin Y., Wang L., Yan J., Nikolaevna S.E., Zhao Y. Spermidine Prevents Heart Injury in Neonatal Rats Exposed to Intrauterine Hypoxia by Inhibiting Oxidative Stress and Mitochondrial Fragmentation. // Oxid Med Cell Longev. - 2019 - Vol. 2019 - P. 5406468.
4. Chai N., Zhang H., Li L., Yu X., Liu Y., Lin Y., Wang L., Yan J., Nikolaevna S.E., Zhao Y. Spermidine Prevents Heart Injury in Neonatal Rats Exposed to Intrauterine Hypoxia by Inhibiting Oxidative Stress and Mitochondrial Fragmentation. // Oxid Med Cell Longev. - 2019 - Vol. 2019 - P. 5406468.  5. Tong W., Xue Q., Li Y., Zhang L. Maternal hypoxia alters matrix metalloproteinase expression patterns and causes cardiac remodeling in fetal and neonatal rats. // Am J Physiol Heart Circ Physiol. - 2011 - Vol. 301, № 5 - P. H2113-21.
5. Tong W., Xue Q., Li Y., Zhang L. Maternal hypoxia alters matrix metalloproteinase expression patterns and causes cardiac remodeling in fetal and neonatal rats. // Am J Physiol Heart Circ Physiol. - 2011 - Vol. 301, № 5 - P. H2113-21. 6. Kumar P., Morton J. S., Shah A. [et al.]Intrauterine exposure to chronic hypoxia in the rat leads to progressive diastolic function and increased aortic stiffness from early postnatal developmental stages / // Physiol Rep. - 2020. - Vol. 8, № 1 - P. e14327.
6. Kumar P., Morton J. S., Shah A. [et al.]Intrauterine exposure to chronic hypoxia in the rat leads to progressive diastolic function and increased aortic stiffness from early postnatal developmental stages / // Physiol Rep. - 2020. - Vol. 8, № 1 - P. e14327. 7. Sazonova E.N., Tcimbalist N.A., Kaplieva O.V., Lebed'ko O.A. The influence of non-opiate analogue of leu-enkephalin to the cardiac consequences of intrauterine hypoxia of albino rats// Russian Open Medical Journal. - 2019. - Vol. 8 - № 4. - P. е0401
7. Sazonova E.N., Tcimbalist N.A., Kaplieva O.V., Lebed'ko O.A. The influence of non-opiate analogue of leu-enkephalin to the cardiac consequences of intrauterine hypoxia of albino rats// Russian Open Medical Journal. - 2019. - Vol. 8 - № 4. - P. е0401 8. Sazonova E.N., Lebedko O.A., Tsimbalist N.A., Gusev I.A., Samarina E.Yu., Malofey Yu.B. The role of amino acid arginine and nitric oxide system in implementing cardioprotective effect of non-opioid analogue of leu-enkephalin in newborn albino rats after intrauterine hypoxia // Russian Open Medical Journal. - 2020. - Vol. 9, № 4. - P. 404.
8. Sazonova E.N., Lebedko O.A., Tsimbalist N.A., Gusev I.A., Samarina E.Yu., Malofey Yu.B. The role of amino acid arginine and nitric oxide system in implementing cardioprotective effect of non-opioid analogue of leu-enkephalin in newborn albino rats after intrauterine hypoxia // Russian Open Medical Journal. - 2020. - Vol. 9, № 4. - P. 404. 9. Зубенко С.И., Лю Янь, Жульков М.О., Лебедько О.А., Сазонова Е.Н. Влияние антенатальной гипоксии на тканевой гомеостаз миокарда белых крыс: ранние и отдаленные последствия // Бюллетень экспериментальной биологии и медицины. - 2014. - Т. 157, № 3. - С. 294-297.
9. Зубенко С.И., Лю Янь, Жульков М.О., Лебедько О.А., Сазонова Е.Н. Влияние антенатальной гипоксии на тканевой гомеостаз миокарда белых крыс: ранние и отдаленные последствия // Бюллетень экспериментальной биологии и медицины. - 2014. - Т. 157, № 3. - С. 294-297. 10. Коржевский Д.Э. Гилерович Е.Г., Кирик О.В., Сухорукова Е.Г., Григорьев И.П. Морфологическая диагностика. Подготовка материала для гистологического исследования и электронной микроскопии: руководство - СПб.: СпецЛит, 2013 - 127 с.
10. Коржевский Д.Э. Гилерович Е.Г., Кирик О.В., Сухорукова Е.Г., Григорьев И.П. Морфологическая диагностика. Подготовка материала для гистологического исследования и электронной микроскопии: руководство - СПб.: СпецЛит, 2013 - 127 с. 11. Автандилов, Г. Г. Медицинская морфометрия - М.: Медицина, 1990. - 383 с.
11. Автандилов, Г. Г. Медицинская морфометрия - М.: Медицина, 1990. - 383 с. 12. Boisvert F.M., van Koningsbruggen S., Navascués J., Lamond A.I. The multifunctional nucleolus. // Nat Rev Mol Cell Biol. - 2007 - Vol. 8, № 7 - P. 574-585.
12. Boisvert F.M., van Koningsbruggen S., Navascués J., Lamond A.I. The multifunctional nucleolus. // Nat Rev Mol Cell Biol. - 2007 - Vol. 8, № 7 - P. 574-585.  13. Boulon S., Westman B.J., Hutten S., Boisvert F.M., Lamond A.I. The nucleolus under stress // Mol Cell. - 2010 - Vol. 40, № 2 - P. 216-227.
13. Boulon S., Westman B.J., Hutten S., Boisvert F.M., Lamond A.I. The nucleolus under stress // Mol Cell. - 2010 - Vol. 40, № 2 - P. 216-227. 14. Hariharan N., Sussman M.A. Stressing on the nucleolus in cardiovascular disease // Biochim Biophys Acta. - 2014 - Vol. 1842, № 6 - P. 798-801.
14. Hariharan N., Sussman M.A. Stressing on the nucleolus in cardiovascular disease // Biochim Biophys Acta. - 2014 - Vol. 1842, № 6 - P. 798-801. 15. Ball M.K., Waypa G.B., Mungai P.T., Nielsen J.M., et al. Regulation of hypoxia-induced pulmonary hypertension by vascular smooth muscle hypoxia-inducible factor-1α // Am J Respir Crit Care Med. - 2014 - Vol. 189, № 3 - P. 314-324.
15. Ball M.K., Waypa G.B., Mungai P.T., Nielsen J.M., et al. Regulation of hypoxia-induced pulmonary hypertension by vascular smooth muscle hypoxia-inducible factor-1α // Am J Respir Crit Care Med. - 2014 - Vol. 189, № 3 - P. 314-324. 16. Каде А.Х., Поляков П.П., Муратова А.Ю., Богданова Ю.А., Вчерашнюк С.П., Туровая А.Ю., Занина Е.С. Механизмы миокардиального фиброза // Современные проблемы науки и образования. - 2021. - № 2. - С. 192.
16. Каде А.Х., Поляков П.П., Муратова А.Ю., Богданова Ю.А., Вчерашнюк С.П., Туровая А.Ю., Занина Е.С. Механизмы миокардиального фиброза // Современные проблемы науки и образования. - 2021. - № 2. - С. 192. 17. Shimizu M. Umeda K., Sugihara N., et al. Collagen remodelling in myocardia of patients with diabetes //Journal of Clinical Pathology. - 1993. - Vol. 46 - P. 32-36.
17. Shimizu M. Umeda K., Sugihara N., et al. Collagen remodelling in myocardia of patients with diabetes //Journal of Clinical Pathology. - 1993. - Vol. 46 - P. 32-36. 18. Frangogiannis N.G. The Extracellular Matrix in Ischemic and Nonischemic Heart Failure // CircRes. - 2019 - Vol. 125, № 1. - P. 117-146.
18. Frangogiannis N.G. The Extracellular Matrix in Ischemic and Nonischemic Heart Failure // CircRes. - 2019 - Vol. 125, № 1. - P. 117-146. 19. Liu Y., Feng Q. NOing the heart: role of nitric oxide synthase-3 in heart development // Differentiation. - 2012. - Vol. 84, № 1 - P. 54-61.
19. Liu Y., Feng Q. NOing the heart: role of nitric oxide synthase-3 in heart development // Differentiation. - 2012. - Vol. 84, № 1 - P. 54-61. 20. Oyama J., Frantz S., Blais C., Jr, Kelly R., Bourcier T. Nitric oxide, cell death, and heart failure // Heart Fail Rev. - 2002. - Vol. 7, № 4. - P. 327-334.
20. Oyama J., Frantz S., Blais C., Jr, Kelly R., Bourcier T. Nitric oxide, cell death, and heart failure // Heart Fail Rev. - 2002. - Vol. 7, № 4. - P. 327-334. 21. Tsutsui M., Tanimoto A., Tamura M., Mukae H., Yanagihara N., Shimokawa H., Otsuji Y. Significance of nitric oxide synthases: Lessons from triple nitric oxide synthases null mice // J Pharmacol Sci. - 2015. - Vol. 127, № 1. - P. 42-52.
21. Tsutsui M., Tanimoto A., Tamura M., Mukae H., Yanagihara N., Shimokawa H., Otsuji Y. Significance of nitric oxide synthases: Lessons from triple nitric oxide synthases null mice // J Pharmacol Sci. - 2015. - Vol. 127, № 1. - P. 42-52. 22. Sutovska H., Babarikova K., Zeman M., Molcan L. Prenatal Hypoxia Affects Foetal Cardiovascular Regulatory Mechanisms in a Sex- and Circadian-Dependent Manner: A Review // Int J Mol Sci. - 2022. - Vol. 23, № 5. - P. 2885.
22. Sutovska H., Babarikova K., Zeman M., Molcan L. Prenatal Hypoxia Affects Foetal Cardiovascular Regulatory Mechanisms in a Sex- and Circadian-Dependent Manner: A Review // Int J Mol Sci. - 2022. - Vol. 23, № 5. - P. 2885. 23. Figueroa H., Alvarado C., Cifuentes J., Lozano M., Rocco J., Cabezas C., Illanes S.E., Eixarch E., Hernández-Andrade E., Gratacós E., Irarrazabal C.E. Oxidative damage and nitric oxide synthase induction by surgical uteroplacental circulation restriction in the rabbit fetal heart // Prenat Diagn. - 2017. - Vol. 37, № 5. - P. 453-459.
23. Figueroa H., Alvarado C., Cifuentes J., Lozano M., Rocco J., Cabezas C., Illanes S.E., Eixarch E., Hernández-Andrade E., Gratacós E., Irarrazabal C.E. Oxidative damage and nitric oxide synthase induction by surgical uteroplacental circulation restriction in the rabbit fetal heart // Prenat Diagn. - 2017. - Vol. 37, № 5. - P. 453-459.  24. Evans L.C., Liu H., Thompson L.P. Differential effect of intrauterine hypoxia on caspase 3 and DNA fragmentation in fetal guinea pig hearts and brains // Reprod Sci. - 2012. - Vol. 19, № 3. - P. 298-305.
24. Evans L.C., Liu H., Thompson L.P. Differential effect of intrauterine hypoxia on caspase 3 and DNA fragmentation in fetal guinea pig hearts and brains // Reprod Sci. - 2012. - Vol. 19, № 3. - P. 298-305.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

