2024 год № 4
Медико-биологические науки
1steblevskaya@ich.dvo.ru, https://orcid.org/0000-0003-3114-443X
2rita@ich.dvo.ru, https://orcid.org/0000-0003-3705-0848
3medkov@ich.dvo.ru, https://orcid.org/0000-0002-9417-0312
4shevchenko.ov@tgmu.ru, https://orcid.org/0000-0002-3113-3995
6all_vl@mail.ru, https://orcid.org/0000-0002-4562-017X
4,5,7Тихоокеанский государственный медицинский университет, Владивосток, Россия
5eliseeva@tgmu.ru, https://orcid.org/0000-0001-6126-1253
7shumatovvb@tgmu.ru, https://orcid.org/0000-0002-9645-3471
Аннотация:
Ключевые слова:
1steblevskaya@ich.dvo.ru, https://orcid.org/0000-0003-3114-443X
2rita@ich.dvo.ru, https://orcid.org/0000-0003-3705-0848
3medkov@ich.dvo.ru, https://orcid.org/0000-0002-9417-0312
4shevchenko.ov@tgmu.ru, https://orcid.org/0000-0002-3113-3995
6all_vl@mail.ru, https://orcid.org/0000-0002-4562-017X
4,5,7Pacific State Medical University, Vladivostok, Russia
5eliseeva@tgmu.ru, https://orcid.org/0000-0001-6126-1253
7shumatovvb@tgmu.ru, https://orcid.org/0000-0002-9645-3471
Abstract:
Key words:
Введение |
 |
 |
Фотодинамическая терапия (ФДТ) в последнее время эффективно применяется в медицинских учреждениях многих стран при лечении заболеваний различной природы [1, 2]. К настоящему времени обозначены основные тенденции использования ФДТ в некоторых областях медицины: предлагается большой массив экспериментального и клинического материала, демонстрирующий эффективность и безопасность применения ФДТ при лечении опухолей различных локализаций [2, 3, 4, 5, 6, 7, 8]. Данный метод лечения основан на селективном накоплении в поврежденных тканях веществ - фотосенсибилизаторов (ФС), которые при облучении светом определенной длины волны способны стимулировать образование активного кислорода [2, 3, 4, 5, 6, 7, 8]. Одними из широко используемых в методе ФДТ фотосенсибилизаторов являются препараты на основе порфиринов [9].
Эффективно работающий в методе ФДТ фотосенсибилизатор должен обладать довольно большим набором свойств [10]: интенсивно поглощать свет с длиной волны 680-800 нм, селективно накапливаться в опухолевых тканях в достаточно высокой концентрации, демонстрировать высокий выход синглетного кислорода, иметь низкую темновую токсичность, быть доступным, стабильным и растворимым в физиологических жидкостях, легко доставляться в организм, например, в виде инъекций, и выводиться из него.
Улучшение свойств известных и поиск новых препаратов для ФДТ идет несколькими путями. В одних случаях проводят модификацию свойств фотосенсибилизаторов за счет синтеза производных представителя первого поколения ФС гематопорфирина и, в том числе, их коньюгирования с различными биомолекулами [11, 12]. В других - ФС инкапсулируют в различные носители: мицеллы, металлокаркасы, наночастицы золота или оксида кремния, квантовые точки, углеродные нанотрубки [13, 14]. Ведутся исследования о возможности использования в качестве перспективных препаратов для диагностики онкозаболеваний, ФДТ композиций на основе известных ФС и комплексных соединений ряда металлов, в частности редкоземельных, таких как Eu и Yb [15, 16, 17, 18, 19, 20, 21].
Авторами [15] изучена система, представляющая собой мицеллу Hyp-GdEuC12 с гиперицином (Hyp) в качестве ФС после воздействия рентгеновскими лучами. При возбуждении указанной системы излучением с длиной волны 275 нм в спектре люминесценции наблюдаются характерные для иона Eu3+ полосы при λ=595 и 618 нм. При этом за счет перекрывания данных полос с полосами в спектре поглощения Hyp происходит эффективная передача энергии от ионов лантаноидов фотосенсибилизатору и индуцируется образование синглетного кислорода. Синтезированы и исследованы нанолюминофоры на основе ортофосфатов цинка и бария, допированные двухвалентными ионами европия и марганца [16]. Фосфатные люминофоры малотоксичны и при возбуждении рентгеновским излучением с длинами волн 0,12-0,31 характеризуются высокой интенсивностью свечения [16]. Нанолюминофоры предложено использовать в виде коллоидного раствора совместно с ФС хлорином Е6 в методе ФДТ. Полосы излучения полученных нанолюминофоров Zn3 (PO4) 2:Mn2+ и Ba3 (PO4) 2:Eu2+ находятся в области длин волн полос поглощения хлорина Е6, что повышает эффективность работы данного фотосенсибилизатора при лечении онкологических заболеваний.
Одним из современных направлений биомедицины является тераностика - использование препаратов, сочетающих в себе диагностические и терапевтические функции [15, 17, 18]. К таким препаратам относятся малотоксичные ФС на основе некоторых люминесцирующих комплексных соединений ионов лантанидов (Yb, Ho, Er, Nd, Eu) с порфиринами. Так, например, комплексное соединение иттербия с 2,4-ди(α-метоксиэтил)дейтеропорфирином (Yb-ДМДП) имеет высокие фотофизические характеристики (время жизни и квантовый выход люминесценции, коэффициент экстинкции) [17]. К тому же, благодаря порфирину в составе ФС идет достаточно интенсивное накопление препарата в патологических тканях.
Синтезирован и исследован композит аналогичного действия, включающий липосому, комплексное соединение европия с диэтилентриаминпентауксусной кислотой (Eu-DTPA) и в качестве ФС-краситель викторианский синий [20]. Под действием рентгеновского излучения ион Eu3+ люминесцирует в красной области, а ФС генерирует активный кислород, в результате двойного эффекта композит может быть использован для люминесцентной диагностики и ФДТ. Поскольку рентгеновские лучи в отличие от видимых проникают в биологические ткани на гораздо большую глубину, сочетание методов радиотерапии и ФДТ устраняет необходимость во внешнем источнике видимого света. При этом область применения радиофотодинамической терапии по сравнению с ФДТ расширяется и охватывает не только поверхностные, но и глубокие ткани. Комбинация радиотерапии и ФДТ более эффективна, чем любая из методик в отдельности, также и за счет снижения дозы рентгеновского излучения. Для радиотерапии и ФДТ глубоких опухолей предлагаются композиции, состоящие из радиолюминесцентной молекулы и фотосенсибилизатора [19, 21], используемые в методе так называемой SLPDT - "самосветящейся фотодинамической терапии". В данном случае облучение радиолюминесцентной наночастицы рентгеновским излучением вызывает люминесцентное излучение в видимой области вблизи ФС, который его поглощает и высвобождает синглетный кислород, а также другие его активные формы. В качестве люминесцентной части композиции используют хлориды лантаноидов LnCl3. Фотосенсибилизаторами являются Al (III) фталоцианин, mTHPC, хлорин Е6 (ХЕ6), гиперицин, гипокрин, нильский синий, оксазин 170, оксазин 1, протопорфирин IX, 7-метоксикумарин-4, бактериохлорофилл, аурамин. В фармацевтическом растворе содержится молекулярный конъюгат из LnCl3 в свободной или агрегированной форме, ковалентно связанный с ФС. Фотосенсибилизатор выбирают с учетом того, чтобы максимизировать передачу энергии от рентгеновского излучения, поглощенного радиолюминесцентным лантанидом и фотосенсибилизатором, как уже отмечалось выше.
Несмотря на массив исследований в области ФДТ, истинный потенциал метода еще не достигнут. Требуется продолжать исследования по получению, модификации и использованию ФС в методе ФДТ. Для расширения возможностей "самосветящейся ФДТ" не последнюю роль играют сведения о физико-химических свойствах и механизме взаимодействия фотосенсибилизатора и вводимых в раствор люминесцирующих молекулярных агентов.
В настоящем сообщении приведены данные о синтезе, изучении состава и свойств комплексного соединения европия (III) c широко используемым в методе клинической ФДТ фотосенсибилизатором - хлорином Е6.
Материалы и методы
|
 |
 |
Для синтеза комплексного соединения европия (III) использовали коммерческий препарат "Фотодитазин", содержащий димеглюмин хлорина Е6 (15-(карбоксиметил)-17-(2-карбоксиэтил)-2,7,12,18-тетраметил-3-этенил-8-этил-17,18-дигидропорфирин-13-карбоновая кислота, 1-дезокси-1-(метил-амино)-D-глюцит(1/2) - препарат для инфузий производства ООО "Вета-Гранд" (Россия) и хлорид европия EuCl3 6Н2О (х.ч.). Методика получения комплекса описана в [22].
Комплексное соединение было исследовано методами сканирующей электронной микроскопии (СЭМ), ИК-, люминесцентной и рентгеновской фотоэлектронной спектроскопии (РФЭС) на приборах: электронном сканирующем микроскопе Hitachi S 5500, спектрофлуориметре Shimadzu RF-5301 PC, спектрометре SPECS.
Процессы опухолеобразования моделировали клетками асцитной карциномы Эрлиха у половозрелых мышей. Все манипуляции осуществляли в соответствии с положениями Хельсинкской декларации, требованиями Европейской конвенции по содержанию, кормлению и уходу за подопытными животными. Работа одобрена Междисциплинарным комитетом по этике ФГБОУ ВО ТГМУ Минздрава России (протокол № 8 от 08.04.2024 г.). Культивирование клеточной линии осуществляли согласно методике [23]. МТТ-тест для изучения жизнеспособности клеток после контакта с веществами в концентрациях 12,5; 25,0; 50,0; 100,0; 200,0; 400,0 мкг/мл.
Построение диаграммы и статистическую обработку осуществляли в программе GraphPad Prism 7,01 с применением однофакторного дисперсионного анализа 52 (One Way ANOVA) и критерия Даннетта (Dunnett's post hoc test). Статистически значимыми признавались значения *р<0,5; **р<0,01; ***p<0,001.
Результаты и обсуждение
|
 |
 |
При синтезе комплексного соединения цвет реакционной смеси после образования осадка меняется с темно-зеленого (цвет раствора исходной димеглюминовой соли хлорина Е6) на бесцветный (цвет фильтрата), в фильтрате методом масс-спектрометрии обнаружен свободный метилглюкамин. По данным рентгенофазового анализа полученное в виде осадка комплексное соединение европия с хлорином Е6 является рентгеноаморфным. По результатам СЭМ образец состоит из частиц, собранных в агломераты (рис. 1а). После диспергирования в этиловом спирте или ацетоне размеры сферических частиц в образцах составляют менее 100 нм (рис. 1б).
Комплексные соединения с порфиринами (Пор) изучены для всех лантаноидов Ln (III). Ионы Ln (III) из-за своего размера, превышающего радиус полости макроцикла порфирина, и координационного числа, варьирующегося между 6 и 12 [24], обычно располагаются над основной плоскостью ядра порфирина, координируясь четырьмя атомами азота, а несколько молекул растворителя связаны с катионом Ln (III), завершая его координационную сферу [24]. Эти комплексы обычно нестабильны в растворе и разлагаются с образованием свободного порфирина и/или таких соединений как Ln(Пор) 2 или Ln2 (Пор) 3 [25]. Для стабилизации комплексов в координационную сферу иона Ln3+, состоящую из четырех атомов азота в макроциклическом ядре порфирина, вводят дополнительные кислородсодержащие монодентатные или хелатирующие лиганды [25]. В качестве лигандов используют, как правило ацетилацетонатные или ацетатные группы, диметилформамид, диметилсульфоксид, гидрохинолин и т. п. С учетом наличия в молекуле хлорина Е6 нескольких координационных центров, возможна различная координация его ионами Eu3+.

Рис. 1. Микрофотографии твердого образца комплекса EuХЕ6
Известны димерные комплексы лантаноидов, в которых атом Ln (Eu, Sm, Y) координирует по четыре атома азота двух макроциклов в металлофталоцианинов [26]. С учетом значения координационного числа европия, который обычно больше шести [24], вероятно образование димерных или полимерных комплексов, в которых в качестве мостиковых групп выступают карбоксилат-ионы [24, 26, 27].
В исследованных ранее ИК-спектрах [22] обнаружены дополнительные полосы поглощения (в области 480-630 см-1, 770-1 300 см-1 и 1 540-1 630 см-1) и изменения в положении отдельных полос в ИК-спектре комплекса европия (III) с ХЕ6 в области валентных и деформационных колебаний СОО-- и NH- групп хлорина Е6, что также свидетельствует об участии этих групп в образовании связей с ионом европия.
На рисунке 2 представлен энергодисперсионный спектр полученного комплексного соединения.
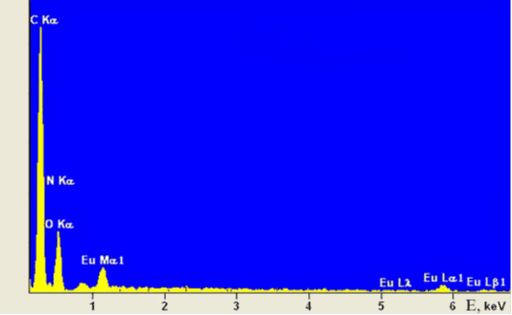
Рис. 2. Энергодисперсионный спектр комплексного соединения европия с хлорином Е6
На основании данных элементного анализа, полученных СЭМ методом, можно сделать вывод об образовании комплексного соединения европия с хлорином Е6 с соотношением в нем Eu: ХЕ6=1:1. С учетом выше сказанного и наиболее вероятных для лантаноидов координационных чисел от 8 до 12 в полученном комплексном соединении может быть реализована координация европия четырьмя атомами азота и бидентатная координация атомами кислорода карбоксильных групп хлорина Е6. При этом возможна реализация димерной или полимерной структуры.
В рентгеновских фотоэлектронных спектрах исследованных соединений - димеглюминовой соли хлорина Е6 и комплекса, выделялись линии глубоких (остовных) уровней С 1s, N 1s, О1s, Eu 3d и Eu 4d (рис. 3).
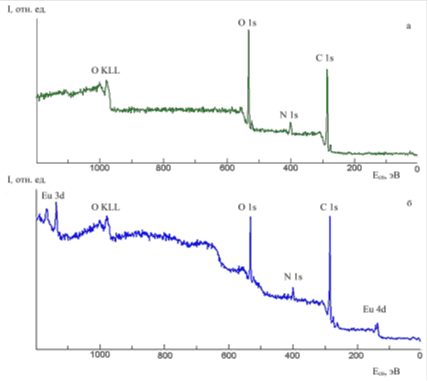
Рис. 3. Обзорные РФЭС-спектры димеглюмина хлорина Е6 (а) и комплексного соединения европия с хлорином Е6 (б)
В обзорном спектре комплекса европия с хлорином Е6 имеются линии уровней Eu 3d и Eu 4d (рис. 3б), которых нет в РФЭС-спектре прекурсора - димеглюминовой соли хлорина Е6 (рис. 3а). Присутствующие загрязнения на поверхности незначительны. Относительные концентрации элементов, в первом приближении, соответствуют составу комплексного соединения европия с хлорином Е6 с соотношением в нем Eu:ХЕ6=1:1.
В РФЭС-спектре исходного образца димеглюминовой соли хлорина Е6 в области остовных уровней N 1s состояний присутствуют соответствующие стехиометрии линии, относящиеся к трем выраженным азотсодержащим формам (рис. 4а).
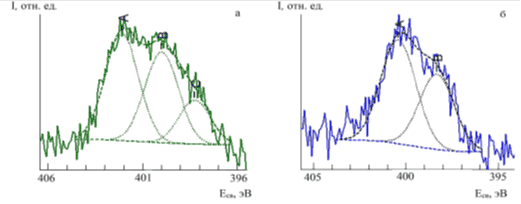
Рис. 4. Разложение спектральной линии N 1s фотоэлектронного спектра димеглюмина хлорина Е6 (а) и комплексного соединения европия с хлорином Е6 (б)
В РФЭС-спектре наблюдается трехпиковая структура с энергиями связи 402.1(С), 400.0 (В) и 398.3 (А) эВ, отвечающая азоту меглюминовой группы (С), азоту в пиррольной группе (В, конфигурация связи sp3) и азоту в аза-группе (А, sp2). Данные для азота с конфигурацией связи sp3 и sp2 хорошо согласуются с результатами для порфиринов [17, 28].
В РФЭС-спектре димеглюминовой соли хлорина Е6 линии О1s 531.6 и 533.0 эВ (рис. 5а) отвечают кислороду карбоксильных и меглюминовых групп соответственно. Большее количество кислорода, чем можно ожидать исходя из структуры демеглюмина хлорина Е6, возможно связано с присутствием адсорбированной воды в образце. Избыточным является и содержание углерода в поверхностных слоях частиц образца, что, по-видимому, связано с сохранившимися после синтеза углеродсодержащими соединениями.
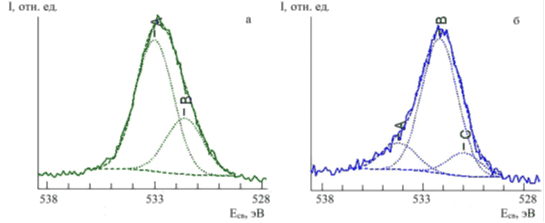
Рис. 5. Разложение спектральной линии О1s фотоэлектронного спектра димеглюмина хлорина Е6 (а) и комплексного соединения европия с хлорином Е6 (б)
В РФЭС-спектрах основного С1s-уровня образцов димеглюминовой соли хлорина Е6 (рис.6а) и комплексного соединения европия с хлорином Е6 (рис. 6б) наблюдаются линии 288,2, 286,6, 285,0 эВ и 288,7, 286,4, 285,0 эВ соответственно, обусловленные фотоэмиссией различных состояний углерода, находящихся в неэквивалентных положениях в молекуле: OCO, COC, CNC, CC, CH. Аналогичные значения С1s-состояний получены ранее для различных порфиринов и их комплексов с лантаноидами [28, 29].
РФЭС-спектры комплексного соединения европия с хлорином Е6 в области остовных N1s- и О1s-уровней (рис. 4б и 5б) значительно отличаются от спектра исходного лиганда (рис. 4а и 5а). В области N1s-уровней остается характерная для порфиринов и их комплексных соединений двухпиковая структура с энергиями связи 400.4 и 398.4 эВ для азота в пиррольной и аза-группе соответственно (рис. 4б) [28, 29]. Наблюдаемые в РФЭС-спектре лишь две формы азота указывают на отрыв двух меглюминовых групп при комплексообразовании. При этом при комплекообразовании практически не изменяются энергии связи и соотношение форм соответствующих атомов азота.
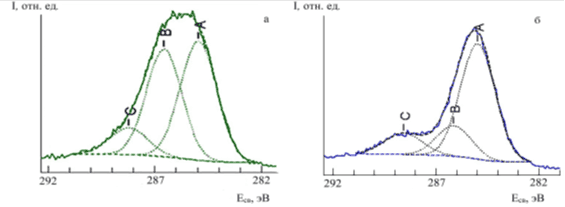
Рис. 6. Разложение спектральной линии С 1s фотоэлектронного спектра димеглюмина хлорина Е6 (а) и комплексного соединения европия с хлорином Е6 (б)
В РФЭС-спектрах комплексного соединения в О1s-уровней вместо двухпиковой появляется трехпиковая структура с энергиями связи 534.2, 532.2 и 531.0 эВ (рис. 5б), что свидетельствует об увеличении форм кислорода в комплексе по сравнению с исходным лигандом (рис. 5а).
РФЭС-спектры комплексного соединения европия с хлорином Е6 характеризуются наличием линии европия Eu 3d и Eu 4d (рис. 7а, б), энергии связи которого свидетельствуют о трехвалентном состоянии и сильном электроотрицательном ближайшем окружении типа N и/или О.
Присутствие в комплексе, по данным РФЭС, двух форм азота в пиррольной и аза-группе, аналогичных азотам в исходном лиганде, характеризует неэквивалентность связей Eu-N, а наличие в спектре O1s низкоэнергетической компоненты в области 531 эВ может указывать на координационную связь европия с кислородом.
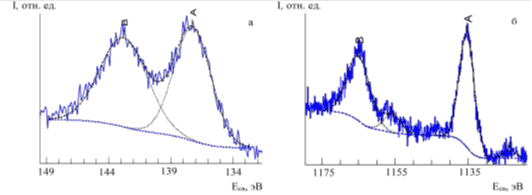
Рис. 7. Разложение спектральной линии Eu 4d (а) и Eu 3d (b) фотоэлектронного спектра комплексного соединения европия с хлорином Е6
Необходимым условием для эффективной работы препарата в методе ФДТ является перекрытие полос поглощения фотосенсибилизатора и полос излучения люминофора [4, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23]. В спектре поглощения используемого в медицине ФС Хлорина Е6 наблюдаются две широкие полосы с максимумами ~400 и 650нм (рис. 8, кривая 3), перекрывающиеся со спектром люминесценции Eu3+, максимальная интенсивность которого приходится на 5D0-7F1,2 переходы (рис. 8, кривая 2).
Следует отметить, что в области ~700 нм в спектрах люминесценции на полосу 5D0-7F4 перехода иона европия может накладываться самая интенсивная полоса люминесценции хлорина Е6 (рис. 8, кривая 1).
Для исследования жизнеспособности клеток асцитной карциномы Эрлиха твердый комплекс Eu3+ с хлорином Е6 диспергировали в воде с образованием суспензии. Исследование проводили через 1 сутки контакта клеток с растворами комплексного соединения европия с ХЕ6 в диапазоне вносимых концентраций 12,5-400 мкг/мл с разведением в 2 раза, в условиях отсутствия светового воздействия. Определено, что при таких условиях для раствора 100-400 мкг/мл EuХЕ6 жизнеспособность клеток менее 50 %, в то время как концентрации от 50 мкг/мл и ниже высокая жизнеспособность сохраняется (рис. 9).
Для клеток отрицательного контроля обнаружено 99,97±4,99 % жизнеспособности.
Получено рентгеноаморфное комплексное соединение европия (III) с хлорином Е6 с соотношением в нем Eu:ХЕ6=1:1. С учетом сложного строения молекулы хлорина Е6, наличия в его составе нескольких координационных центров и свидетельствующей об образовании полимера значения молекулярной массы, можно предположить многообразие координации хлорина Е6 ионами Eu3+ четырьмя атомами азота порфиринового кольца и бидентатно и/или монодентатно координированными атомами кислорода карбоксильных групп хлорина Е6. Энергии связи европия в РФЭС-спектрах комплексного соединения европия с хлорином Е6 области Eu 3d- и Eu 4d-уровней свидетельствуют о его трехвалентном состоянии и сильном электроотрицательном ближайшем окружении типа N и/или О.
В спектре люминесценции комплексного соединения регистрируются характерные для иона Eu3+ полосы в области 5D0-7Fj (j=0, 1, 2, 3, 4) переходов. Максимум люминесценции Eu3+ приходится на 5D0-5F2,4 переходы. Полосы люминесценции λ~400-700 нм частично перекрываются с полосами поглощения хлорина Е6, что приводит к увеличению интенсивности люминесценции при возбуждении УФ-светом и, следовательно, более эффективному генерированию реактивных форм кислорода.
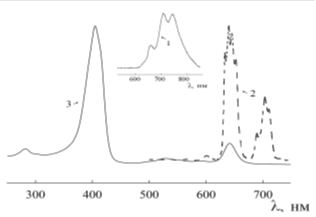
Рис. 8. Спектры люминесценции хлорина Е6 (кривая 1, вставка - увеличение); комплексного соединения с хлорином Е6 (кривая 2) (λeх= 406 нм, 300 К) и поглощения хлорина Е6 (кривая 3)
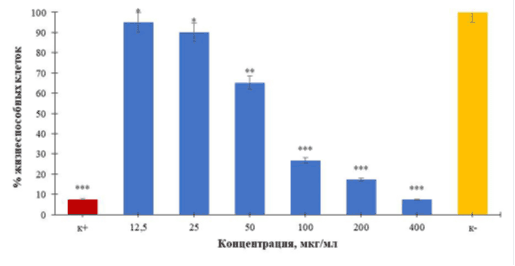
Рис. 9. Количество метаболически-активных клеток опухоли Эрлиха после суточного контакта с EuХЕ6 (темновая токсичность), ***р<0,001; **р<0,01)
Список источников |
 |
 1. Correia J.H., Rodrigues J.A., Pimenta S., et al. // Pharmaceutics. - 2021. - Vol. 13, № 9. - P. 1332. doi: 10.3390/pharmaceutics13091332.
1. Correia J.H., Rodrigues J.A., Pimenta S., et al. // Pharmaceutics. - 2021. - Vol. 13, № 9. - P. 1332. doi: 10.3390/pharmaceutics13091332. 2. Niculescu A.G., Grumezescu A.M. // Appl. Sci. - 2021. Vol. 11, № 8. Article ID 3626. https://doi.org/10.3390/app11083626.
2. Niculescu A.G., Grumezescu A.M. // Appl. Sci. - 2021. Vol. 11, № 8. Article ID 3626. https://doi.org/10.3390/app11083626. 3. Gunaydin G., Gedik M.E., Ayan S. // Front Chem. - 2021. - Vol. 9. - P. 691. doi: 10.3389/fchem.2021.691697.
3. Gunaydin G., Gedik M.E., Ayan S. // Front Chem. - 2021. - Vol. 9. - P. 691. doi: 10.3389/fchem.2021.691697. 4. Кузнецов В.В. Исследования и практика в медицине. - 2015. - Т. 2, № 4. - С. 98. doi: 10.17709/2409-2231-2015-2-4-98-105.
4. Кузнецов В.В. Исследования и практика в медицине. - 2015. - Т. 2, № 4. - С. 98. doi: 10.17709/2409-2231-2015-2-4-98-105. 5. Hillemans P., Garcia F., Petry K.U., et al. // J. Obstet Gynecol. - 2015. - Vol. 4, № 212. - P. 465. doi: 10.1016/j.ajog.2014.10.1107.
5. Hillemans P., Garcia F., Petry K.U., et al. // J. Obstet Gynecol. - 2015. - Vol. 4, № 212. - P. 465. doi: 10.1016/j.ajog.2014.10.1107. 6. Ostanska E., Aebisher D., Bartusik-Aebisher D. // Biomed. Pharmacother. - 2021. - Vol. 137. - E111302. doi: 10.1016/j.biopha.2021.111302.
6. Ostanska E., Aebisher D., Bartusik-Aebisher D. // Biomed. Pharmacother. - 2021. - Vol. 137. - E111302. doi: 10.1016/j.biopha.2021.111302. 7. Agostinis P., Berg K., Cengel K.A., et al. // CA Cancer J. Clin. - 2011. - Vol. 61, № 4. - Р. 250. doi:10.3322/caac.20114.
7. Agostinis P., Berg K., Cengel K.A., et al. // CA Cancer J. Clin. - 2011. - Vol. 61, № 4. - Р. 250. doi:10.3322/caac.20114. 8. Railkar R., Agarwal P.K. // Eur. urol. focus. - 2018. - Vol. 4. - P. 509. doi:10.1016/j.euf.2018.08.005.
8. Railkar R., Agarwal P.K. // Eur. urol. focus. - 2018. - Vol. 4. - P. 509. doi:10.1016/j.euf.2018.08.005. 9. Zhang Q., He J., Yu W., Li., et al. // SC Medicinal Chem. - 2020. - Vol. 11, № 4. - Р. 427. doi:10.1039/c9md00558g.
9. Zhang Q., He J., Yu W., Li., et al. // SC Medicinal Chem. - 2020. - Vol. 11, № 4. - Р. 427. doi:10.1039/c9md00558g. 10. Bonett R. // Chem. Soc. Rev. - 1995. - Vol. 24. - P. 19.
10. Bonett R. // Chem. Soc. Rev. - 1995. - Vol. 24. - P. 19. 11. Turubanova V.D., Balalaeva I.V., Mishchenko T.A., et al. // J. Immunoteher. Cancer. - 2019. - Vol. 7, № 1. е350. doi: 10.1186/s40425-019-0826-3.
11. Turubanova V.D., Balalaeva I.V., Mishchenko T.A., et al. // J. Immunoteher. Cancer. - 2019. - Vol. 7, № 1. е350. doi: 10.1186/s40425-019-0826-3. 12. Alzeibak R., Peskova N.N., Kutova O.M., et al. // Opera Med.Physiol. - 2021. - Vol. 8, № 1. - Р. 51. doi: 10.24412/2500-2295-2021-1-51-61.
12. Alzeibak R., Peskova N.N., Kutova O.M., et al. // Opera Med.Physiol. - 2021. - Vol. 8, № 1. - Р. 51. doi: 10.24412/2500-2295-2021-1-51-61. 13. Chizenga E.P., Abramse Y. // Pharmaceutics. - 2020. - Vol. 12, № 7. е632. doi: 10.3390/pharmaceutics12070632.
13. Chizenga E.P., Abramse Y. // Pharmaceutics. - 2020. - Vol. 12, № 7. е632. doi: 10.3390/pharmaceutics12070632. 14. Rani R., Malik P., Dhania S., et al. /// Pharmaceutics. - 2023. - Vol. 15, № 1. Е227. doi: 10.3390/pharmaceutics15010227.
14. Rani R., Malik P., Dhania S., et al. /// Pharmaceutics. - 2023. - Vol. 15, № 1. Е227. doi: 10.3390/pharmaceutics15010227. 15. Kaščáková S., Giuliani A., Lacerda S., et al. // Nano Research. - 2015. - Vol. 8. - P. 2373. https://doi.org/10.1007/s12274-015-0747-5.
15. Kaščáková S., Giuliani A., Lacerda S., et al. // Nano Research. - 2015. - Vol. 8. - P. 2373. https://doi.org/10.1007/s12274-015-0747-5. 16. Бахметьев В., Сычев М., Орлова А. и др. // Наноиндустрия. - 2013. - Т. 46. - № 8. - С. 46.
16. Бахметьев В., Сычев М., Орлова А. и др. // Наноиндустрия. - 2013. - Т. 46. - № 8. - С. 46. 17. Shilov I.P., Gorshkova A.S., Rumyantseva V.D., et al. // Quantum Electron. - 2022. - Vol. 52, № 1. - P. 56. doi: 10.1070/QEL17966.
17. Shilov I.P., Gorshkova A.S., Rumyantseva V.D., et al. // Quantum Electron. - 2022. - Vol. 52, № 1. - P. 56. doi: 10.1070/QEL17966. 18. Шилов И.П., Румянцева В.Д., Алексеев Ю.В. и др. // Известия РАН. Серия физическая. - 2020. - T. 84, № 11. - С. 1643. doi: 10.31857/S0367676520110253.
18. Шилов И.П., Румянцева В.Д., Алексеев Ю.В. и др. // Известия РАН. Серия физическая. - 2020. - T. 84, № 11. - С. 1643. doi: 10.31857/S0367676520110253. 19. Шевченко О.В., Плехова Н.Г., Медков М.А. и др. // Журн. неорган. химии. - 2022. - Т. 67, № 9. - С. 1361. doi: 10.31857/S0044457X22090112.
19. Шевченко О.В., Плехова Н.Г., Медков М.А. и др. // Журн. неорган. химии. - 2022. - Т. 67, № 9. - С. 1361. doi: 10.31857/S0044457X22090112.  20. Im H.J., Lee W. S., Jeon M.Y., et al. Патент KR WO №2020138805. 16.12.2019.
20. Im H.J., Lee W. S., Jeon M.Y., et al. Патент KR WO №2020138805. 16.12.2019. 21. Kascakova S., Refregiers M., Giuliani A. Патент FR WO № 2015059379 A. 30.09.2014.
21. Kascakova S., Refregiers M., Giuliani A. Патент FR WO № 2015059379 A. 30.09.2014.  22. Стеблевская Н.И., Медков М.А., Белобелецкая М.В. // Журн. неорган. химии. - 2020. - Т. 65, № 3. - С. 327. doi: 10.31857/S0044457X20030174.
22. Стеблевская Н.И., Медков М.А., Белобелецкая М.В. // Журн. неорган. химии. - 2020. - Т. 65, № 3. - С. 327. doi: 10.31857/S0044457X20030174.  23. Шевченко О.В., Коршунова О.В., Плехова Н.Г. Изучение цитотоксического действия молекулярного конъюгата на основе хлорина Е6 // Медико-фармацевтический журнал "Пульс". - 2022. - Т. 24, № 11. - С. 18-22.
23. Шевченко О.В., Коршунова О.В., Плехова Н.Г. Изучение цитотоксического действия молекулярного конъюгата на основе хлорина Е6 // Медико-фармацевтический журнал "Пульс". - 2022. - Т. 24, № 11. - С. 18-22. 24. Yu X., Pavlov D.I., Ryadun A.A., et al. // Molecules. - 2022. - Vol. 27. - P. 7849. doi.org: 10.3390. molecules 27227849.
24. Yu X., Pavlov D.I., Ryadun A.A., et al. // Molecules. - 2022. - Vol. 27. - P. 7849. doi.org: 10.3390. molecules 27227849. 25. Bulach V., Sguerra F., Hosseini M.W. // Coord. Chem. Rev. - 2012. - № 256. - P. 1468. https://doi.org/10.1016/j.ccr.2012.02.027.
25. Bulach V., Sguerra F., Hosseini M.W. // Coord. Chem. Rev. - 2012. - № 256. - P. 1468. https://doi.org/10.1016/j.ccr.2012.02.027. 26. Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds: Part A - Theory and Applications in Inorganic Chemistry /6th Edition. John Wiley and Sons, Inc. N.-Y. 2009.
26. Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds: Part A - Theory and Applications in Inorganic Chemistry /6th Edition. John Wiley and Sons, Inc. N.-Y. 2009.  27. Зиминов А.В., Рамш С.М., Теруков Е.И. и др. // Физика и техника полупроводников. - 2006. - Т. 40, № 10. - С. 1161.
27. Зиминов А.В., Рамш С.М., Теруков Е.И. и др. // Физика и техника полупроводников. - 2006. - Т. 40, № 10. - С. 1161. 28. Nishimura N., Ooi M., Shimazu K., et al. // J. Electroanalyt. Chem. - 1999. - Vol. 473. - P. 75.
28. Nishimura N., Ooi M., Shimazu K., et al. // J. Electroanalyt. Chem. - 1999. - Vol. 473. - P. 75.  29. Можчиль Р.Н., Менушенков А.П., Ионов А.Н. и пр. // Макрогетероциклы. - 2015. - Т. 8, № 3. - С. 252. DOI: 10.6060/mhc141244m.
29. Можчиль Р.Н., Менушенков А.П., Ионов А.Н. и пр. // Макрогетероциклы. - 2015. - Т. 8, № 3. - С. 252. DOI: 10.6060/mhc141244m.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

