2025 год № 3
Клиническая медицина
1pestrikova75@mail.ru
2niiem_vl@mail.ru, https//orcid.org/0000-0002-8879-8496
3lnbogd@mail.ru
4spk1211dvo@mail.ru, https://orcid.org/0000-0002-1981-1079
Аннотация:
Ключевые слова:
1pestrikova75@mail.ru
2niiem_vl@mail.ru, https//orcid.org/0000-0002-8879-8496
3lnbogd@mail.ru
4spk1211dvo@mail.ru, https://orcid.org/0000-0002-1981-1079
Abstract:
Key words:
Введение |
 |
 |
Актуальными вопросами современной офтальмологии остаются профилактика и лечение возрастной макулярной дегенерации (ВМД), социально-медицинская значимость которой обусловлена центральной локализацией патологического процесса, двусторонним характером поражения, значительным снижением остроты зрения. В России заболеваемость ВМД составляет более 15 случаев на 1 000 населения. В структуре первичной инвалидности по ВМД больные в трудоспособном возрасте составляют 21 %, а в пенсионном - 32 %. Прогрессирование ВМД наблюдается в 4,2 % случаев в возрасте 43-54 лет, в 46,2 % - у пациентов 75 лет и старше [3].
Механизмы, лежащие в основе ВМД, являются сложными, многофакторными и включают генетическую восприимчивость, связанную со старением дисфункцию нормального гомеостаза сетчатки, нарушение липидного обмена, иммунную активацию и прогрессирование хронического воспаления, окислительный стресс и формирование неоваскулярной мембраны [5, 9, 10, 13].
Общий принцип лечения мультифакторных заболеваний заключается, прежде всего, в коррекции патогенетических факторов. Современные терапевтические стратегии ВМД включают, в зависимости от стадии и формы заболевания, наблюдение, правильное питание, целенаправленное подавление иммунитета или модуляцию специфических иммунных клеток, интравитреальные инъекции антиангиогенных препаратов, фокальную лазерную коагуляцию, фотодинамическую терапию, хирургическое лечение [8], назначение периодических курсов поливитаминов и препаратов, состав которых оптимизирован для заболеваний сетчатки (в том числе содержащих лютеин и зеаксантин) [1, 4, 7]. Хотя понимание точного механизма положительных эффектов этих соединений требует дальнейшего изучения, клинические исследования показали, что применение в комплексной терапии ВМД витаминно-минеральных комплексов способствует стабилизации структурных изменений сетчатки [6, 11, 12].
Одним из препаратов, рекомендованных НМИЦ "Глазных болезней им. Гельмгольца" [2] для широкого использования в клинической практике врача-офтальмолога, является витаминно-минеральный комплекс Офтолик®, содержащий не только витамины, микроэлементы, но и активные антиоксиданты - ресвератрол и коэнзим Q10.
Цель настоящей работы - оценка клинико-функциональной значимости применения биологически активной добавки Офтолик® - Витамины для глаз (Ophtholique Vitamins for eyes) у пациентов среднего и пожилого возраста на разных стадиях развития ВМД.
Материалы и методы
|
 |
 |
Исследования проведены на базе ФГБУЗ МО ДВО РАН совместно с клиникой ООО "Глазной центр" (г. Владивосток).
В исследование были включены 23 пациента (46 глаз) с ранней и поздней стадиями ВМД, (средний возраст 64,3±7,1), 17 % мужчин, 83 % женщин.
Критерии включения: пациенты с ВМД на разных стадиях развития заболевания (ранняя, поздняя) от 50 до 75 лет.
Критерии исключения: пациенты с тяжелыми заболеваниями, в том числе онкологическими, с декомпенсацией хронических заболеваний, требующими интенсивной терапии, неспособные полностью понять объяснения исследователя относительно процедуры самого исследования, отказавшихся дать письменное согласие на участие в исследовании.
Дифференциацию форм и стадий ВМД проводили в соответствии с классификацией AREDS.
Материал исследования: данные индивидуальных карт пациентов, биологический материал пациентов (кровь), протоколы инструментальных методов исследования, протоколы методов врачебного контроля.
Методы исследования: общеклинические, клинико-биохимические, офтальмологические. До и после курса лечения определяли остроту зрения, оценивали светочувствительность сетчатки, выполняли биомикроскопию, авторефрактометрию, тонометрию, офтальмоскопию глазного дна, оптическую когерентную томографию (ОКТ) сетчатки, тест Шимера.
БАД Офтолик® - Витамины для глаз (Ophtholique Vitamins for eyes), дополнительный источник лютеина, зеаксантина, ликопина, ресвератрола, коэнзима Q10 (убихинона), бета-каротина, витаминов С, Е, В1, В2, В3/РР, В6, В9, В12, микроэлементов (меди, цинка, селена), назначался ежедневно по 2 капсулы в день во время еды в течение месяца.
Производитель "ВТФ ООО", РФ, 601125, Владимирская обл., Петушинский р-н, пос. Вольгинский, ул. Заводская, стр. 107, соответствует требованиям полной безопасности для здоровья. Форма выпуска продукта - 2 блистера 30 капсул по 0,4 г. в картонной пачке. Хранить в защищенном от света месте. Свидетельство о государственной регистрации № RU.77.99.11.003.R.000330.02.20 от 10.02.2020 г., ТУ 10.89.19-001-11410149-2019. Срок годности - 2 года. Противопоказания: индивидуальная непереносимость компонентов, беременность, кормление грудью.
Математическая обработка результатов проводилась с помощью пакета программ "Statistica 10". Использовали W-критерия Шапиро-Уилка, t-критерий Стьюдента, критерий W-Вилкоксона, критерий Манна-Уитни. Выборочные параметры, приводимые далее в таблицах, имеют следующие обозначения: W - критерий Shapiro-Wilk, средняя арифметическая (М), стандартное отклонение (σ), ошибка среднего арифметического (m), объем анализируемой подгруппы (n), Ме - медиана; нижний (LQ) и верхний (UQ) квартили, p - достигнутый уровень значимости. Результаты считали статистически значимыми при p<0,05.
Результаты и обсуждение
|
 |
 |
Оценку эффективности и безопасности БАД "Офтолик" проводили на основании изменения лабораторных показателей клинического, биохимического анализа крови, а также данных офтальмологического обследования до и через 2 недели после окончания лечения.
Основными критериями эффективности лечения являлись клиническая картина очага, состояние зрительных функций, изменение толщины сетчатки в макулярной области по данным ОКТ, а также сведения пациентов о переносимости препарата, удобстве его применения, возникновении побочных эффектов.
Пациенты были разделены на 2 подгруппы: ОГ-1 (опытная группа-1) (n=18), пациенты с ВМД на ранней стадии развития и ОГ-2 (n=5) - пациенты с ВМД на поздней стадии развития. Пациенты группы ОГ-2 не были привержены к более радикальной терапии, рекомендуемой для поздней стадии развития, но согласились на проведение поддерживающей профилактической терапии.
В сочетании с ВМД у пациентов ОГ-1 обнаружены гиперметропия (28 %), миопия (44 %), эпиретинальная мембрана (ЭРМ) (17 %), катаракта (14 %), и другие нарушения органа зрения в единичных случаях. Из сопутствующих заболеваний чаще всего регистрировали гипертоническую болезнь (39 %), ишемическую болезнь сердца (ИБС) (6 %), желчнокаменную болезнь, мочекаменную болезнь, сахарный диабет 2 типа (по 6 %), а также другие заболевания в единичных случаях.
На поздней стадии развития ВМД у пациентов регистрировали миопию (40 %), периферическую дистрофию сетчатки (20 %) и астигматизм (20 %); из сопутствующих заболеваний - гипертоническую болезнь у (80 %), ИБС (40 %).
Для оценки состояния хориоретинального комплекса и структурно функциональных изменений органа зрения было проведено обследование пациентов методом оптической когерентной томографии (ОКТ), позволяющем получать двух- и трехмерные карты глазного дна, а также оптические "срезы" сетчатки. Средняя толщина сетчатки в макулярной области от внутренней пограничной мембраны до внутреннего слоя пигментного эпителия до начала лечения у пациентов группы ОГ-1 составила (245,30±8,90 мкм) и находилась в границах нормальных значений (208-245 мкм), а в подгруппе ОГ-2 (285,32±29,41 мкм) значительно их превышала (p<0,05). После курса лечения средние значения толщины сетчатки в центральной зоне у пациентов обеих подгрупп значимо не изменялись, что свидетельствует о стабилизации процесса (рис.1, табл. 1).
Зрительные дисфункции анализировали по максимально корригированной остроте зрения и данным периметрии. Острота зрения пациентов во всех исследуемых группах до начала лечения соответствовала стадии заболевания: наиболее выраженное снижение остроты зрения (до 40 %) было отмечено у пациентов в группе ОГ-2. Средние значения показателей остроты зрения пациентов в обеих подгруппах после 30 дней стандартного курса лечения значимо не изменялись (табл. 1). Вместе с тем, у части пациентов (в 33 % случаев) регистрировалось улучшение остроты зрения (с 0,70±0,05 до 0,87±0,04), (p=0,001).
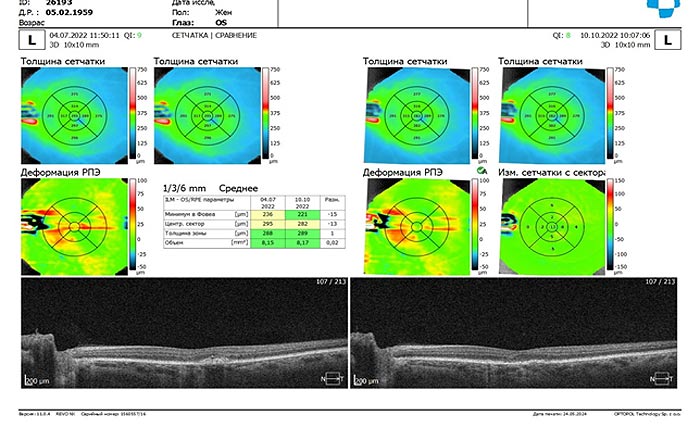
Рис. 1. Протокол ОКТ пациентки Ц. - группа ОГ-1 до и после лечения
Степень тяжести нарушений светочувствительности оценивали с помощью компьютерной периметрии по среднему повышению или снижению световой чувствительности в обобщенном поле зрения MD (Mean defect) по сравнению с возрастной нормой и sLV - маркеру степени однородности дефектов поля зрения (Loss variance). У пациентов в подгруппе ОГ-1 MD регистрировались в пределах нормы (0,65±0,7 дБ), после лечения наблюдалось значительное улучшение светочувствительности сетчатки: MD составила 0,21±0,6 дБ, (р=0,03), а в подгруппе ОГ-2 значимых изменений не обнаружено (рис. 2, табл. 1).
Индекс sLV в подгруппах ОГ-1 и ОГ-2 выходил за рамки референсных значений (>2,5 дБ). После лечения зарегистрировано значимое улучшение - уменьшение дефекта в подгруппе ОГ-1 от 3,05±0,36 до 2,59±0,20, р=0,04 и тенденция к улучшению в подгруппе ОГ-2 с 4,93±1,09 до 4,63±1,13, р=0,05 (рис. 2, табл. 1).
| Показатели (нормальные значения) | Подгруппа ОГ-1 (ранняя стадия) | Подгруппа ОГ-2 (поздняя стадия) | ||
|---|---|---|---|---|
| до лечения | после лечения | до лечения | после лечения | |
| Сравнительные данные остроты зрения | ||||
| Vis OD=1,0 | 0,80±0,05 | 0,84±0,05 | 0,41±0,16 | 0,42±0,14 |
| Vis OS=1,0 | 0,81±0,05 | 0,82±0,05 | 0,43±0,15 | 0,48±0,21 |
| Vis OS/OD=1,0/1,0 | 0,81±0,05 | 0,83±0,05 | 0,42±0,16 | 0,45±0,18 |
| Периметрия. Средний дефект (MD) | ||||
| OD (до 2,0 дБ) | 0,64±0,90 | 0,35±0,77 | 3,68±3,41 | 3,42±2,91 |
| OS (до 2,0 дБ) | 0,65±0,51 | 0,06±0,42 | 3,28±1,43 | 4,10±1,50 |
| Периметрия. Локальный дефект (sLV) | ||||
| OD (менее 2,5 дБ) | 3,05±0,36 | 2,59±0,20 | 4,30±1,17 | 4,12±1,16 |
| OS (менее 2,5 дБ) | 3,15±0,34 | 2,47±0,14 | 5,56±1,00 | 5,14±1,10 |
| Толщина сетчатки в центральной зоне (208-245 мкм) | 245,30±8,90 | 247,40±9,49 | 285,32±29,41 | 285,72±26,32 |
| Тонометрия (10-21 мм рт. ст.) | 15,03±0,68 | 15,08±0,76 | 14,80±1,79 | 15,70±1,88 |
| Тест Ширмера (≥15 мм) | 12,61±2,26 | 13,64±2,21 | 12,86±4,42 | 12,92±4,51 |
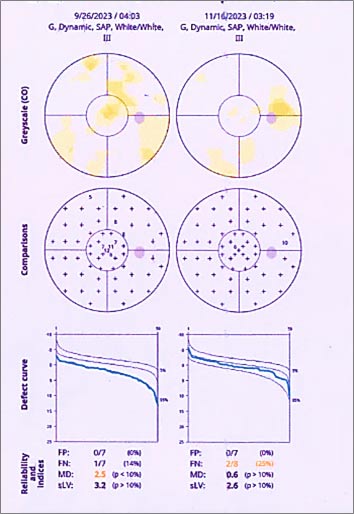
Рис. 2. Протокол компьютерной периметрии пациента Г. группы ОГ-1 до и после лечения
Cредние значения показателей внутриглазного давления у пациентов в обеих подгруппах до начала терапии варьировали от 11 до 23 мм рт. ст., находились в пределах нормальных значений и существенно не изменялись после курса лечения.
В 48 % случаев у пациентов обеих групп была снижена слезопродукция (менее 9 мм), что соответствовало средней степени синдрома сухого глаза, после курса лечения в 12 % случаев было отмечено увеличение слезопродукции. Средние значения показателя значимо не изменялись независимо от стадии ВМД.
Результаты значений показателей клинико-лабораторных методов исследования сравнивали с таковыми у условно здоровых пожилых людей, проживающих в Приморском крае, определяемые как интервал исследуемого признака, включающего по одному и двум среднему квадратическому отклонению от среднего значения (M±1SD, M±2SD), при ненормальном распределении - как интервал значений между установленными произвольно нижними и верхними процентилями общего диапазона Ме (25-75 %), Ме (5-95 %).
Показатели клинического анализа крови пациентов опытной группы в целой выборке до начала исследований находились в границах значений диапазона показателей у условно здоровых пожилых людей и не выходили за рамки широкого нормативного диапазона, за исключением СОЭ (скорости оседания эритроцитов). Медиана СОЭ значимо превышала показатели в контрольной группе и оставалась повышенной после лечения (p<0,05) (табл. 2). Значимых различий между показателями на ранней и поздней стадиями заболеваний не выявлено.
Средние значения биохимических показателей всех обследуемых пациентов с ВМД также находились в пределах референсных значений и значимо не отличались от таковых у условно здоровых людей (табл. 2). В то же время уровень общего холестерина в сыворотке крови всех обследуемых пациентов с ВМД в 50 % случаев был выше верхней границы широкого нормативного диапазона. После курса лечения значимого изменения в содержании холестерина не отмечено, в том числе у пациентов с исходно повышенными показателями (6,35±0,11 ммоль/л и 6,09±0,26 ммоль/л). Содержание глюкозы в сыворотке крови всех обследуемых пациентов с ВМД находились в интервале от 4,00 ммоль/л до 8,20 ммоль/л. Повышенные уровни глюкозы регистрировались у 4 пациентов. Средние значения показателей, характеризующих функциональное состояние гепатобилиарной системы и функцию почек, находились в границах нормативного диапазона.
До начала лечения у всех обследуемых пациентов с ВМД выявлены значимые различия средних значений показателей азотистого обмена (мочевины) по сравнению с показателями у условно здоровых людей. У пациентов с поздней стадией ВМД изменения были более выраженными, показатели значимо отличались от таковых у пациентов с ранней стадией ВМД и условно здоровых людей, и оставались повышенными после окончания терапии (табл. 2).
Показатели общей антиоксидантной активности сыворотки крови (ОАО) пациентов с ВМД до лечения значимо не отличались от таковой у условно здоровых пожилых людей и не изменились после терапии.
Средние значения показателя, характеризующего базовый уровень С-реактивного белка (СРБ) и концентрацию фибриногена - маркеров воспаления - до начала лечения в обеих подгруппах находились в пределах нормативного диапазона, вместе с тем, значимо отличаясь от такового у условно здоровых пожилых людей, и не изменялись после лечения (табл. 2).
До начала терапии уровень провоспалительных цитокинов и фактора роста эндотелия сосудов (VEGF) в сыворотке крови пациентов обеих подгрупп значимо не отличался от такового у условно здоровых людей, находился в пределах референсных значений метода и не изменялся после курса лечения, за исключением IL-1β, концентрация которого снижалась во всех случаях (табл. 3). Следует отметить, что наши данные согласуются с данными научных публикаций о невысоких уровнях системной продукции провоспалительных цитокинов при ВМД [12].
Вместе с тем, у пациентов с высоким уровнем VEGF в сыворотке крови до начала лечения, после окончания терапии наблюдалась положительная динамика показателя (рис. 3).
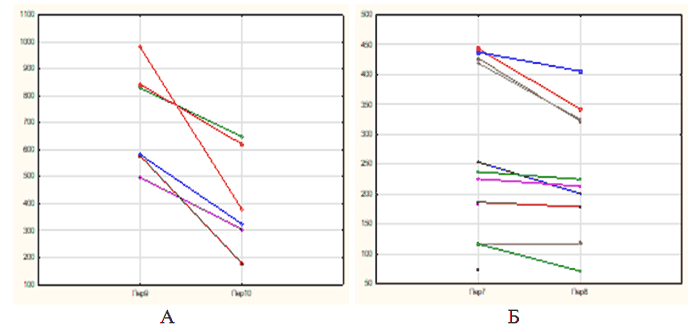
Рис. 3. Содержание VEGF в сыворотке крови пациентов с ранней и поздней стадиями ВМД с исходно повышенными (А) и нормальными (Б) показателями до и после лечения. По оси ординат - концентрация VEGF (ммоль/л)
| Показатель (референсные значения метода) | Контрольная группа | Подгруппа ОГ-1 | Подгруппа ОГ-2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M±σ Ме* (LQ-UQ) 1 | M±2σ (LQ-UQ) 2 | до лечения | после лечения | до лечения | после лечения | |||||
| W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | |||
| Общий белок (60-80 г/л) | 69,70±2,99 | 63,72-75,68 | 0,97 | 69,68±3,57 (67,61-71,16) | 0,95 | 68,78±4,39 (68,09-72,57) | 0,88 | 71,70±2,81 (68,20-75,19) | 0,82 | 68,78±4,39 (63,31-74,24) |
| Общий билирубин (1,0-25 ммоль/л) | 12,87±5,18 | 2,51-23,23 | 0,88 | 9,92±4,17 (6,13-27,50) | 0,94 | 9,80±4,11 (8,2-18,90) | 0,98 | ##16,82±8,60# (6,13-27,50) | 0,85 | 13,58±4,33≠ (8,2-18,90) |
| Креатинин (50-124 мкмоль/л) | 78,00* (74,00-89,00) | 0,85** | 79,64# (61,00-121,00) | 0,94 | 81,05±12,82# (73,65-88,54) | 0,98 | ##96,00±13,92# (78,70-113,29) | 0,93 | ##100,40±17,31≠ (78,90-121,89) | |
| Мочевина (1,8-8,3 ммоль/л) | 4,65±0,57 | 2,09-7,21 | 0,92 | 4,61±0,98# (4,11-5,10) | 0,93 | 4,50±1,09 (3,87-5,13) | 0,95 | ##5,79±1,71 (3,54-7,79) | 0,97 | ##6,38±2,70 (3,01-9,74) |
| Глюкоза (3,3-6,0 ммоль/л) | 5,10±0,31 | 4,54-5,98 | 0,92 | 5,08±0,79 (4,68-5,48) | 0,70** | 5,05±0,97 (4,48-5,61) | 0,82 | 5,26±1,71 (3,13-7,79) | 0,87 | 5,26±1,09 (3,90-6,62) |
| АЛТ (0,0-46 Ме/л) | 21,62±5,03 | 18,17-25,07 | 0,95 | 21,70±8,55 (17,44-25,95) | 0,95 | 19,82±7,76 (15,34-24,31) | 0,96 | 19,10±10,84 (15,63-32,56) | 0,92 | 18,15±8,14 (15,19-31,10) |
| АСТ (0,0-49 Ме/л) | 23,30±8,94 | 5,42-41,88 | 0,88** | 27,25# (21,70-48,00) | 0,92 | 26,93±5,33 (23,91-29,35) | 0,80 | 30,82±5,10# (24,48-27,15) | 0,92 | 29,94±9,8 (17,69-42,18) |
| ОХС (3,0-5,72 ммоль/л | 5,41±0,94 | 4,99-5,83 | 0,96 | 5,79±0,94 (5,32-6,26) | 0,95 | 5,64±0,84 (5,15-6,13) | 0,90 | 5,13±1,27 (3,54-6,51) | 0,87 | 4,96±0,86 (3,88-6,04) |
| СРБ (0-5,0 мг/л) | 1,22* (0,53-2,66) | 0,59** | 1,17* (0,33-11,43) | 0,86** | 1,39* (0,41-4,81) | 0,76** | 2,63*# (1,35-3,66) | 0,85 | 2,06* (1,10-4,51) | |
| Фибриноген (2,0-4,0 г/л) | 3,45±0,51 | 2,80-4,20 | 0,92 | 3,60±0,63 (3,28-3,92) | 0,96 | 3,37±0,58 (3,05-3,69) | 0,84 | 3,76±0,76 (3,18-4,33) | 0,89 | 3,62±0,53 (2,95-4,28) |
| ОАО (1,5-2,8 ммоль/л) | 2,16±0,20 | 2,05-2,21 | 0,95 | 2,12±0,37 (1,93-2,31) | 0,96 | 2,25±0,37 (2,09-2,41) | 0,94 | 2,25±0,30 (1,87-2,63) | 0,89 | 2,15±0,39 (1,66-2,64) |
Примечание. Здесь и в табл. 3: M - средняя; σ - среднее квадратичное отклонение;*Ме - медиана (50 % перцентиль); W - Shapiro-Wilk; **p<0,05 - уровень значимости, соответствующий данному критерию W (при p<0,05 параметр имеет отклонение от нормального распределения); 1нижний (LQ) и верхний (UQ) квартили - 25 % перцентиль и 75 % перцентиль, 2Нижний (LQ) и верхний (UQ) квартили - 5 % перцентиль и 95 % перцентиль, 3узкий диапазон референсных значений, 95 % доверительный интервал, 4Широкий диапазон референсных значений, 99 % доверительный интервал, #(p<0,05) - значимость различий показателей пациентов с показателями условно здоровых людей; ≠ (p<0,05) - значимость различий показателей пациентов до и после лечения, ##(p<0,05) - значимость различий по отношению к показателям у пациентов с ранней стадией ВМД.
| Показатель (референсные значения метода) | Контрольная группа | Подгруппа ОГ-1 | Подгруппа ОГ-2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M±σ Ме* (LQ-UQ) 1 | M±2σ (LQ-UQ) 2 | |||||||||
| до лечения | после лечения | до лечения | после лечения | |||||||
| W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | W | M±σ/95% доверительный интервал Ме* (LQ-UQ) 1 | |||
| VEGF (до 691 мЕ/мл) | 216,6* | 55,80-555,00 | 0,95 | 336,20* (74,20-979,90) | 0,87 | 305,70* 71,70-648,80 | 0,95 | 416,06±283,47 (64,07-768,04) | 0,90 | 328,02±178,76 (106,05-249,08) |
| IL-1β 0,0-11,0 пг/мл | 6,10* 5,10-8,40 | 4,00-10,80 | 0,95 | 6,30* (3,70-7,10) | 0,87 | 4,50*#≠ (4,00-7,30) | 0,93 | 6,50* (3,70-7,80) | >0,05 | 4,00*# (4,0-5,30) |
| IL-6 0,0-10,0 пг/мл | 5,76±1,33 (5,21-6,31) | 5,01-6,50 | 0,93 | 6,07±1,11 (5,52-6,53) | 0,76** | 6,25±1,86 (5,25-7,25) | 0,95 | 6,10±1,81 (3,84-8,35) | >0,05 | 5,62±1,58 (3,64-7,59) |
| TNFα 0,0-6,0 пг/мл | 5,55±2,35 (4,58-6,52) | 4,23-6,86 | 0,95 | 5,19±1,35 (4,52-5,86) | 0,98 | 6,15±1,28 (5,47-6,84) | 0,96 | 6,56±1,61 (4,54-8,57) | 00,05 | 7,36±1,98 (4,89-9,82) |
Выводы
|
 |
 |
1. У всех обследуемых пациентов с ВМД до начала лечения регистрировалось снижение светочувствительности сетчатки, уменьшение слезопродукции, увеличение средней толщины сетчатки в макулярной области и величины локального дефекта поля зрения, а также нарушения углеводного, азотистого, липидного обмена, билиарной системы, наиболее выраженные в поздней стадии развития заболевания. Содержание маркеров воспаления (СОЭ, СРБ, провоспалительные цитокины, фибриноген), а также показатели антиоксидантной активности у пациентов как с ранней, так и с поздней стадиями не выходили за рамки широкого нормативного диапазона у условно здоровых пожилых людей, но имели тенденцию к повышению.
2. Терапия пациентов с использованием месячного курса витаминно-минерального комплекса БАД Офтолик® (в соответствии с инструкцией) сопровождалась умеренным повышением остроты зрения, увеличением светочувствительности сетчатки, уменьшением локальных дефектов в поле зрения на ранних стадиях заболевания и тенденцией к улучшению при поздних стадиях.
3. Через 3 месяца после курса лечения значения показателей, характеризующих зрительные функции, снижались у всех пациентов, у некоторых пациентов возвращаясь к исходным (до начала терапии).
4. Полученные результаты диктуют необходимость назначения пациентам с ВМД на разных стадиях развития заболевания многократного курса применения БАД "Офтолик®" (2-3 раза в год) после согласования с лечащим врачом. Дополнительно необходимо проведение корректирующей терапии в случае выявления нарушений со стороны углеводного, азотистого, липидного обмена, билиарной.
5. Для повышения эффективности лечения планируется провести исследования по применению БАД "Офтолик®" в комплексе с препаратами на основе биологически активных веществ из морских гидробионтов Тихого океана.
Список источников |
 |
 1. Егоров Е.А. Патогенетические подходы к лечению возрастной макулярной дегенерации // Клиническая офтальмология. - 2017. - Т. 4. - С. 235-238.
1. Егоров Е.А. Патогенетические подходы к лечению возрастной макулярной дегенерации // Клиническая офтальмология. - 2017. - Т. 4. - С. 235-238. 2. Киселева Т.Н. Ишемия сетчатки: возможные подходы к медикаментозной коррекции URL: https: // eyepress.ru/article/oftolik-rasshirenie-lineyki-zashchita-i-podderzhka-ot-rogovitsy-do-setchatki-sat (дата обращения 20.04.2024).
2. Киселева Т.Н. Ишемия сетчатки: возможные подходы к медикаментозной коррекции URL: https: // eyepress.ru/article/oftolik-rasshirenie-lineyki-zashchita-i-podderzhka-ot-rogovitsy-do-setchatki-sat (дата обращения 20.04.2024). 3. Коняев Д.А. Полиморбидный и офтальмологический статус пациентов с возрастной макулярной дегенерацией среднего и пожилого возраста // Современные проблемы здравоохранения и медицинской статистики. - 2020. - Т. 3. - С. 428-442. doi: 10.24411/2312-2935-2020-00084.
3. Коняев Д.А. Полиморбидный и офтальмологический статус пациентов с возрастной макулярной дегенерацией среднего и пожилого возраста // Современные проблемы здравоохранения и медицинской статистики. - 2020. - Т. 3. - С. 428-442. doi: 10.24411/2312-2935-2020-00084. 4. Макулярная дегенерация возрастная. Клинические рекомендации. Министерство здравоохранения Российской Федерации. - 2021.
4. Макулярная дегенерация возрастная. Клинические рекомендации. Министерство здравоохранения Российской Федерации. - 2021. 5. Нероев В.В., Балацкая Н.В., Нероева Н.В., Кармокова А.Г., Рябина М.В., Куликова И.Г. Скрининг цитокинов в сыворотке крови и слезной жидкости при влажной и атрофической формах возрасной макулярной дегенерации // Медицинская иммунология. - 2022. - Т. 4, № 1. - С. 157-170. doi: 10.15789/1563-0625-SOC-2351.
5. Нероев В.В., Балацкая Н.В., Нероева Н.В., Кармокова А.Г., Рябина М.В., Куликова И.Г. Скрининг цитокинов в сыворотке крови и слезной жидкости при влажной и атрофической формах возрасной макулярной дегенерации // Медицинская иммунология. - 2022. - Т. 4, № 1. - С. 157-170. doi: 10.15789/1563-0625-SOC-2351. 6. Соколов В.О., Морозова Н.В., Флоренцева С.С., Назарова Е.Ю., Щерба М.А., Соколов В.В. Опыт применения витаминноминерального комплекса у пациентов с сухой формой возрастной макулодистрофии // Клиническая офтальмология. - 2016. - Т. 16, № 4. - С. 211-214. do1:10.21689/2311-7729-2016-16-4-211-214.
6. Соколов В.О., Морозова Н.В., Флоренцева С.С., Назарова Е.Ю., Щерба М.А., Соколов В.В. Опыт применения витаминноминерального комплекса у пациентов с сухой формой возрастной макулодистрофии // Клиническая офтальмология. - 2016. - Т. 16, № 4. - С. 211-214. do1:10.21689/2311-7729-2016-16-4-211-214. 7. Степанова И.С., Алдашева Н.А., Утельбаева З.Т., Бердишева А.А., Исмаилова С.К., Рахимова М.Д., Мактабекова А.А., Куламанова Б.А. Витаминно-минеральные комплексы с каротиноидами и антиоксидантами в медикаментозной терапии неэкссудативной формы возрастной макулярной дегенерации // World Science. - 2016. - № 8. - С. 48-51.
7. Степанова И.С., Алдашева Н.А., Утельбаева З.Т., Бердишева А.А., Исмаилова С.К., Рахимова М.Д., Мактабекова А.А., Куламанова Б.А. Витаминно-минеральные комплексы с каротиноидами и антиоксидантами в медикаментозной терапии неэкссудативной формы возрастной макулярной дегенерации // World Science. - 2016. - № 8. - С. 48-51. 8. Филоненко Е.В., Серова Л.Г. Фотодинамическая терапия в клинической практике // Biomedical Photonics. - 2016. - Т. 5, № 2. - С. 26-37.
8. Филоненко Е.В., Серова Л.Г. Фотодинамическая терапия в клинической практике // Biomedical Photonics. - 2016. - Т. 5, № 2. - С. 26-37. 9. Эфендеева М.Х., Будзинская М.В., Кадышев В.В., Зинченко Р.А., Савочкина О.А., Пупышева А.Д. Молекулярно-генетические аспекты возрастной макулярной дегенерации и глаукомы // Вестник офтальмологии. - 2019. - Т. 135, № 3. - С. 121-127. doi: 10.17116/OFTALMA2019135031121.
9. Эфендеева М.Х., Будзинская М.В., Кадышев В.В., Зинченко Р.А., Савочкина О.А., Пупышева А.Д. Молекулярно-генетические аспекты возрастной макулярной дегенерации и глаукомы // Вестник офтальмологии. - 2019. - Т. 135, № 3. - С. 121-127. doi: 10.17116/OFTALMA2019135031121. 10. Fleckenstein M., Keenan T.D.L., Guymer, R.H., Chakravarthy U., Schmitz-Valckenberg S., Klaver C.C., Wong W.T., Chew E.Y. Age-related macular degeneration // Nat Rev Dis Primers. - 2021. - № 6; 7 (1). - Р. 32. doi: 0.1038/s41572-021-00272-3.
10. Fleckenstein M., Keenan T.D.L., Guymer, R.H., Chakravarthy U., Schmitz-Valckenberg S., Klaver C.C., Wong W.T., Chew E.Y. Age-related macular degeneration // Nat Rev Dis Primers. - 2021. - № 6; 7 (1). - Р. 32. doi: 0.1038/s41572-021-00272-3. 11. Krinsky N.I., Landrum J.T., Bone R.A. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye // Annual Review of Nutrition. - 2003. - Vol. 23. - P. 171-201. doi: 10.1146/annurev.nutr.23.011702.073307.
11. Krinsky N.I., Landrum J.T., Bone R.A. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye // Annual Review of Nutrition. - 2003. - Vol. 23. - P. 171-201. doi: 10.1146/annurev.nutr.23.011702.073307. 12. Scripsema N.K., Hu D.N., Rosen R. Zeaxanthin in the clinical management of eye disease // Journal of Ophthalmology. 2015. Vol. 12, № 24. P. 865179. doi.org/10.1155/2015/865179.
12. Scripsema N.K., Hu D.N., Rosen R. Zeaxanthin in the clinical management of eye disease // Journal of Ophthalmology. 2015. Vol. 12, № 24. P. 865179. doi.org/10.1155/2015/865179. 13. Wong J.H.C., Ma J.Y.W., Jobling A.I., Brandli A., Greferath U., Fletcher E.L., Vessey K.A. Exploring the pathogenesis of age-related macular degeneration: A review of the interplay between retinal pigment epithelium dysfunction and the innate immune system // Frontiers in Neuroscience. - 2021. - Vol. 16. - P. 1-21. doi: 10.3389/fnins.2022.1009599.
13. Wong J.H.C., Ma J.Y.W., Jobling A.I., Brandli A., Greferath U., Fletcher E.L., Vessey K.A. Exploring the pathogenesis of age-related macular degeneration: A review of the interplay between retinal pigment epithelium dysfunction and the innate immune system // Frontiers in Neuroscience. - 2021. - Vol. 16. - P. 1-21. doi: 10.3389/fnins.2022.1009599.
Телефон: (4212) 76-13-96
«Дальневосточный медицинский журнал»

