2013 год № 2
Управление качеством медицинской помощи
2Дальневосточный государственный медицинский университет, г Хабаровск
Резюме:
Ключевые слова:
2Far Eastern state medical university, Khabarovsk
Summary:
Key words:
Введение |
 |
 |
Частота хирургических инфекций в общей структуре хирургических заболеваний, по некоторым данным отечественной литературы, сохраняется на уровне 35-45%, причем доля нозокомиальной инфекции составляет 12-22%, а летальность достигает 25% [1]. Проведение рациональной анти-микробной терапии (АМТ) невозможно без знаний о современной этиологической структуре инфекционных заболеваний и антибиотикорезистентности их возбудителей. Возросший уровень резистентности возбудителей раневых инфекций следует учитывать при планировании программ эмпирической АМТ в стационаре [2].
Динамическое наблюдение за потреблением антибиотиков в стационарах косвенно отражает выполнение стандартов медицинской помощи, что делает возможным в некоторой степени сдержать негативные процессы применения антимикробных препаратов (АМП) [5]. В то же время изучение потребления антибактериальных средств в лечебно-профилактических учреждениях (ЛПУ) стационарного профиля, является важным профилактики развития антибиотикорезистентности [3].
Цель исследования:
Провести анализ структуры и свойств возбудителей раневых инфекций и определить препараты для проведения стартовой эмпирической антимикробные терапии.
Задачи исследования:
- Изучить в динамике структуру возбудителей раневых инфекций в многопрофильном хирургическом стационаре.
- Определить показатели резистентности к антимикробным лидирующих возбудителей.
- Провести фармакоэпидемиологический анализ потребления антимикробных препаратов в хирургических отделениях многопрофильного стационара и соотнести полученные данные с показателями антибиотикорезистентности микроорганизмов.
Материалы и методы. |
 |
 |
Было проведена ретроспективная сплошная выкопировка результативных исследований из журналов бактериологической лаборатории за период с 2006 по 2012 гг. (2006 г. n=236, 2009 г. n=240, 2012 г. n=279) по идентификации возбудителей и показателей их резистентности к антимикробным препаратам полученных из раневого отделяемого пациентов находящихся на лечении в многопрофильном хирургическом стационаре.
Идентификацию бактерий проводили согласно нормативным документам, регламентирующим работу бактериологических лабораторий. Определение чувствительности микроорганизмов к антимикробным препаратам осуществлялась диско-диффузионным методом, интерпретацию показателей чувствительности осуществлялась в соответствии с МУК 4.2.1890-04 и рекомендациями CLSI-2008 [4].
Проведен анализ использования АМП в отделениях КГБУЗ "Городская клиническая больница № 10" за период с 2003 - 2012 гг.
Для количественного описания потребление АМП использовалась рекомендуемая ВОЗ анатомо-терапевтическо-химическая классификация и система "условных суточных доз" (Defined Daily Doses (DDD) [5]. Количество DDDs использованных антибиотиков выражалось в виде количества DDDs на 100 койко-дней (DID). Величина DDD для каждого конкретного препарата были взяты из информации центра потребления лекарственных средств ВОЗ [6]. Информация о количестве койко-дней проведенных больными в лечебно-профилактическом учреждении, получена из официальных ежегодных отчетов ЛПУ.
Статистическая обработка результатов выполнялась посредством методов описательной статистики с использованием программ "MS Office EXCEL 2003" и использованием метода χ2 , уровень значимости различий принят как р<0,05.
Результаты и обсуждение |
 |
 |
Среди бактерий, составляющих микробный пейзаж содержимого ран, доминировали микроорганизмы семейства Enterobacteriaceae spp. В динамике за 6 лет отмечается достоверный рост семейства Enterobacteriaceae spp. с 51,27 % (n=121) в 2006 г. до 71,68 % (n=200) в 2012 г. (р<0,05) (Рис. 1).
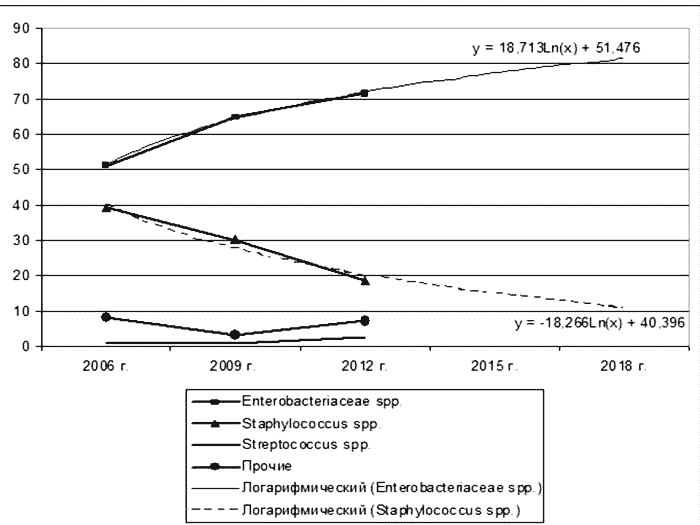
Рис. 1. Структура выделенных микроорганизмов из ран в многопрофильном хирургическом стационаре, в 2006 - 2012 гг., в прогнозе до 2018 г.
Удельный вес Staphylococcus spp. в 2006 г. составил 39,41% (n=93), который в динамике достоверно сократился до 18,64% (n=52) в 2012 г. (р<0,05). Доля микроорганизмов выделенных из ран семейства Streptococcus spp. сохраняется на стабильном уровне и составил в 2012 г. 2,51 % (n=7).
При построении прогнозной модели до 2018 г., предполагается дальнейшее увеличение удельного веса микроорганизмов семейства Enterobacteriaceae, при сокращении удельного веса грамположительных микроорганизмов. В то же время обращает на себя внимание относительный низкий удельный вес неферментообразующих грамотрицательных микроорганизмов, имеющий тенденцию к снижению.
Среди микроорганизмов семейства Enterobacteriaceae лидирующие позиции занимают Escherichia coli, Klebsiella pneumonia, Klebsiella oxytoca (Табл. 1).
| 2006 г. | 2009 г. | 2012 г. | ||||
|---|---|---|---|---|---|---|
| n | % | n | % | n | % | |
| E. coli | 78 | 33,05 | 98 | 40,83 | 116 | 41,58 |
| St. aureus | 63 | 26,69 | 60 | 25,00 | 52 | 18,64 |
| Kl. оxytoca | 15 | 6,36 | 13 | 5,42 | 45 | 16,13 |
| Kl. pneumonia | 17 | 7,20 | 26 | 10,83 | 23 | 8,24 |
| Pr. mirabilis | 9 | 3,81 | 4 | 1,67 | 8 | 2,87 |
| Enterobacter cloacae | 2 | 0,85 | 15 | 6,25 | 8 | 2,87 |
| Str. pyogenus | 3 | 1,27 | 3 | 1,25 | 7 | 2,51 |
| St. epidermidis | 30 | 12,71 | 13 | 5,42 | 0 | 0,00 |
| Прочие | 19 | 8,05 | 8 | 3,33 | 20 | 7,17 |
| Всего | 236 | 240 | 279 | |||
Удельный вес Escherichia coli в 2006 г. составлял 33,05%, а в 2012 г. увеличился до 41,58 % (р<0,05), Klebsiella pneumonia соответственно 7,2 % и 8,24 % (р>0,05), Klebsiella oxytoca 6,36 % и 16,3 % (р<0,05). Наибольшие темпы прироста за исследуемый временной интервал отмечены у Klebsiella oxytoca, удельный вес которой увеличился более чем в 2 раза.
В структуре выделенных микроорганизмов остается практически неизменным доля Proteus mirabilis, Enterobacter cloacae, (p>0,05).
Доля Pseudomonas aeruginosae остается без достоверной динамики и составляет в 2006 г. 1,27 % (n=3), а в 2012 г. 1,08% (n=3) (p>0,05).
Среди грамположительных микроорганизмов отмечается достоверное (р<0,05) снижение, практически в два раза, выделения Staphylococcus aureus с 26,69 % до 18,64 %. Аналогичная ситуация отмечается Str. рyogenus, St.epidermidis удельный вес которого сократился с 12,71 % до 0 % (p>0,05).
Показатели резистентности E. сoli к антимикробным препаратам, 2006-2012 гг., демонстрируют высокие уровни резистентности к группе β-лактамных антибиотиков, так для аминопинициллинов данный показатель составляет 98,5 %, для цефалоспоринов III поколения колеблется от 38,5% к цефотаксиму до 41,6 % к цефтазидиму (Табл. 2).
| Ампициллин | Оксациллин | Амоксиклав | Цефуроксим | Цефотаксим | Цефтазидим | Сульперазон | |
|---|---|---|---|---|---|---|---|
| E. Coli | 98,5 | - | 25,7 | 48,1 | 38,5 | 41,6 | 15,5 |
| Klebsiella oxytoca | 100 | - | 9,1 | 50,0 | 44,4 | 40,1 | 11,1 |
| Klebsiella pneumonia | 100 | - | 27,1 | 73,5 | 76,9 | 54,3 | 24,3 |
| St. aureus | - | 61,53 | - | - | - | - | - |
| Меропенем | Ципрофлосацин | Левофлоксацин | Линкомицин | Эритромицин | Гентамицин | Амикацин | Ванкомицин | Доксициклин | |
|---|---|---|---|---|---|---|---|---|---|
| E. Coli | 3,1 | 25,1 | 42,5 | - | - | 64,2 | 45,7 | - | 66 |
| Klebsiella oxytoca | 3,3 | 69,6 | 75,4 | - | - | 80,1 | 53,8 | - | 38,1 |
| Klebsiella pneumonia | 7,9 | 83,2 | 72,2 | - | - | 64,7 | 28,6 | - | 50,0 |
| St. aureus | 73,6 | 45,3 | 60,0 | 84,4 | 72,7 | 66,7 | 0 | 45,4 |
Обращает на себя внимание низкие показатели уровня резистентности к защищенным пенициллинам, который составляет 25,7 % и к защищенным цефалоспоринам III поколения сульперазону 15,5 %, что вероятно обусловлено продукцией E. сoli, β-лактамаз расширенного спектра действия, при которых отмечается резистентность к цефалоспоринам I-IV поколений и сохраняется чувствительность к защищенным аминопенициллинам. Низкие уровни резистентности отмечены к меропенему - 3,1 %.
У Klebsiella oxytoca наименьшие показатели резистентности отмечены к защищенным аминопенициллинам 9,1 %, сульперазону 11,1 %, меропенему 3,3 %, и высокие уровни резистентности к цефалоспоринам III поколений, а также к аминогликазидам и грамотрицательным фторхинолонам.
Уровни резистентности Klebsiella pneumonia к защищенным аминопенициллина составил 27,1 %, что кардинально отличается от показателей Klebsiella oxytoca, возможно это показатель продукции Klebsiella pneumonia хромосомных β-лактамаз класса С грамотрицательных бактерий. Высокие уровни резистентности отмечены к аминогликазидам, грамотрицательным фторхинолонам, грамотрицательным цефалоспоринам III поколения. Низкие уровни резистентности выявлены к карбапенемам 7,9 %.
За пять лет произошел рост практически в 2 раза количества метициллинорезистентных штаммов Staphylococcus aureus (MRSA) и в 2012 г. их количество выделенных из ран составило 61,53 %.
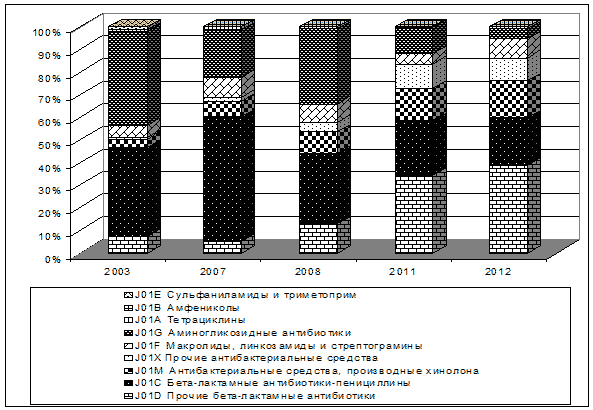
Рис. 2. Потребление антимикробных препаратов по группам в 2003 - 2012 гг. в хирургическом отделении (% от DDD на 100 койко-дней).
В то же время возросло потребление группы J01D прочие бета-лактамные антибиотики с 7,47% в 2003 г. до 38,55 % в 2012 г. (р<0,05), J01M антибактериальные средства, производные хинолона с 3,69 % до 16,69 % (р<0,05).
Анализ потребления антимикробных препаратов выявил достоверные изменения структуры их потребления в профильных отделениях. Так в хирургическом отделении за 10 лет, было выявлено достоверное сокращение потребления группы J01G аминогликозидные антибиотики с 41,85 % в 2003 г.до 4,5 % в 2012 г. (р<0,05), J01С бета-лактамные антибиотики-пенициллины с 39,31 % в 2003 г. до 21,12 % в 2012 г. (р<0,05) (Рис. 2).
При проведении сравнительного анализа потребления АМП в DDD на 100 койко-дней по международным непатентованным наименованиям (МНН) с 2003 г. отмечается достоверное снижение потребления ампициллина с 27,18 до 3,29 DDD на 100 койко-дней (р<0,05), гентамицина с 30,32 до 0,35 DDD на 100 койко-дней (р<0,05), пенициллина (р>0,05) (Табл. 3).
| Код ATX | МНН | 2003 | 2007 | 2008 | 2011 | 2012 |
|---|---|---|---|---|---|---|
| J01DB04 | Cefazolin | 2,75 | 2,68 | 3,61 | 10,01 | 5,77 |
| J01DD01 | Cefotaxime | 2,30 | 2,23 | 3,11 | 6,56 | 5,02 |
| J01CA01 | Ampicillin | 27,18 | 44,89 | 8,00 | 7,97 | 3,29 |
| J01XD01 | Metronidazole | 0,00 | 1,83 | 2,59 | 5,13 | 3,28 |
| J01MA02 | Ciprofloxacin | 2,98 | 4,05 | 3,92 | 4,80 | 3,22 |
| J01FF02 | Lincomycin | 3,94 | 8,75 | 4,93 | 2,28 | 2,63 |
| J01CE01 | Benzylpenicillin | 4,35 | 8,31 | 8,15 | 0,00 | 2,19 |
| J01DD04 | Ceftriaxone | 0,48 | 0,15 | 0,51 | 0,35 | 1,43 |
| J01CA04 | Amoxicillin | 0,00 | 1,37 | 1,80 | 3,77 | 1,32 |
| J01MA01 | Ofloxacin | 0,00 | 2,60 | 1,01 | 2,18 | 1,18 |
| J01GB06 | Amikacin | 0,00 | 3,35 | 4,05 | 2,03 | 1,10 |
| J01GB03 | Gentamicin | 30,32 | 16,67 | 13,61 | 3,62 | 0,35 |
| J01AA02 | Doxycycline | 0,00 | 1,23 | 0,51 | 0,00 | 0,26 |
| J01DD62 | Cefoperazone, combinations | 0,36 | 0,04 | 0,13 | 0,06 | 0,16 |
| J01DH02 | Meropenem | 0,02 | 0,00 | 0,00 | 0,01 | 0,05 |
| J01CR02 | Amoxicillin and enzyme inhibitor | 0,00 | 0,14 | 0,66 | 0,05 | 0,01 |
| J01DD02 | Ceftazidime | 0,11 | 0,00 | 0,00 | 0,00 | 0,00 |
| Прочие | 5,99 | 1,60 | 2,75 | 0,38 | 0,97 | |
| Всего | 80,80 | 99,89 | 59,33 | 49,20 | 32,24 |
В то же время значительно возросло потребление цефотаксима с 2,3 до 5,02 DDD на 100 койко-дней (р<0,05), цефазолина с 2,75 до 5,77 DDD на 100 койко-дней (р>0,05). Таким образом, в ЛПУ стационарного профиля за 10 лет практически полностью изменились подходы к проведению стартовой эмпирической антибактериальной терапии. Наиболее часто используемая схема в 2003 г. комбинация ампициллин с гентамицином ± метронидазол заменились на цефотаксим ± метронидазол.
Нужно отметить, что от селективного воздействия возросших объемов потребления цефалоспоринов III поколения произошло формирование высоких уровней резистентности к данной группе АМП штаммов семейства Enterobacteriaceae. В этой связи учитывая дальнейшее возрастание удельного веса данных возбудителей в раневой инфекции необходимо пересмотреть стартовую антимикробную терапию с учетом показателей резистентности к АМП лидирующих микроорганизмов.
Заключение |
 |
 |
- Устойчивые тенденции в увеличении потребления цефалоспоринов третьего поколения приводит к росту резитентности к ним у микроорганизмов семейства Enterobacteriaceae.
- При построении прогностической модели отмечается дальнейшее увеличение удельного веса микроорганизмов семейства Enterobacteriaceae выделенных из ран, при сокращении количества грамположительных микроорганизмов.
- Для предотвращения роста резистентости микроорганизмов необходимо как можно раньше переходить с эмпирической антимикробной терапии, на этиотропную с учетом чувствительности к антимикробным препаратам. В связи этим необходимо оснастить бактериологическую лабораторию бактериальным анализатором.
- По результатам микробиологического мониторинга наиболее эффективными антимикробными препаратами для лечения инфекционных заболеваний следует считать группу защищенных аминопенициллинов, цефоперазон с сульбактамом, меропенем или комбинацию данных препаратов с ванкомицином.
Список литературы |
 |
 1. Блатун Л.А. Местное медикаментозное лечение ран. Проблемы и новые возможности их решения // Consilium medicum. Хирургия. - 2007. - Т.9, №1. - С.54-67.
1. Блатун Л.А. Местное медикаментозное лечение ран. Проблемы и новые возможности их решения // Consilium medicum. Хирургия. - 2007. - Т.9, №1. - С.54-67. 2. Козлов Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль // Клиническая микробиология и антимикробная химиотерапия. - 2000. - Т.2, №1. - С. 16-31.
2. Козлов Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль // Клиническая микробиология и антимикробная химиотерапия. - 2000. - Т.2, №1. - С. 16-31. 3. Петров В.И. Прикладная фармакоэкономика: Учебное пособие для вузов. - М.: ГЕОТАР-Медиа, 2005. - 336 с.
3. Петров В.И. Прикладная фармакоэкономика: Учебное пособие для вузов. - М.: ГЕОТАР-Медиа, 2005. - 336 с. 4. Семина Н.А. Определение чувствительности микроорганизмов к антибактериальным препаратам: методические рекомендации. // Клиническая микробиология и антимикробная химиотерапия. - 2004. - Т.6, №4. - С. 306-359.
4. Семина Н.А. Определение чувствительности микроорганизмов к антибактериальным препаратам: методические рекомендации. // Клиническая микробиология и антимикробная химиотерапия. - 2004. - Т.6, №4. - С. 306-359. 5. Яковлева Л.В., Матяшова Н.А., Филиппенко Ю.В. Фармакоэпидемиологическая оценка потребления пенициллиновых антибиотиков с использованием ATC/DDD-методологии // Рациональная фармакотерапия. - 2010. - № 4. - С. 37-39.
5. Яковлева Л.В., Матяшова Н.А., Филиппенко Ю.В. Фармакоэпидемиологическая оценка потребления пенициллиновых антибиотиков с использованием ATC/DDD-методологии // Рациональная фармакотерапия. - 2010. - № 4. - С. 37-39. 6. About ATC/DDD system. Oslo: World Health Organization Collaborating Center for Drug Statistics Methodology. - Режим доступа: http://www. whocc.no/atcddd (дата обращения 22.01.2013).
6. About ATC/DDD system. Oslo: World Health Organization Collaborating Center for Drug Statistics Methodology. - Режим доступа: http://www. whocc.no/atcddd (дата обращения 22.01.2013).
Телефон: (4212) 30-53-11
«Вестник общественного здоровья и здравоохранения Дальнего Востока России»

