2022 год № 1
Проблемы управления в здравоохранении
Резюме:
Ключевые слова:
Summary:
Key words:
Введение
|
 |
 |
Эффективность и безопасность фармакотерапевтической помощи, построение алгоритма принятия решений при возникновении рисков требуют способов правильной организации клинической практики в медицинских организациях, основанной на использовании информационных технологий для мониторинга рационального использования ресурсов, качества и объёмов медицинской помощи, гарантированных государством.
Целью исследования является контент-анализ нормативно-правового сопровождения организации системы обязательной регистрации побочных эффектов лекарственных препаратов и сбор информации о таких событиях для постоянного совершенствования качества клинической практики при новой коронавирусной инфекции COVID-19.
Обсуждение результатов
|
 |
 |
В основе управления фармаконадзора факторами риска в лечении при новой коронавирусной инфекции COVID-19 лежит механизм обратной связи (Рис.1) как основы клинического управления.
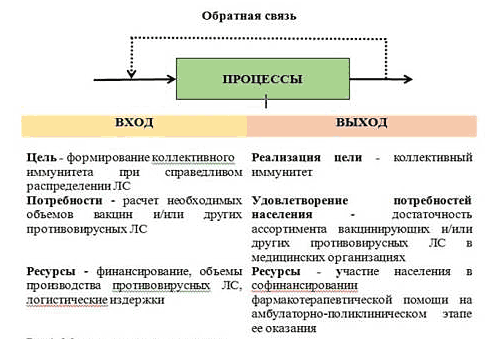
Рис. 1. Модель управления рисками
В государстве, гарантирующем населению предоставление определённого объёма медицинской помощи бесплатно с целью достижения желательного результата необходима система управления - таргетного воздействия на процессы для изменения их происхождения или оптимизации.
Одной из задач современной системы здравоохранения в условиях вызова новой коронавирусной инфекцией COVID-19 является выявление и минимизация рисков в процессе оказания медицинской помощи, и прежде всего - фармакотерапевтической помощи. Необходима организация системы обязательной регистрации побочных эффектов лекарственных препаратов и сбор информации о таких событиях для постоянного совершенствования качества клинической практики [3].
Анализ представляемой субъектами обращения лекарственных средств информации о побочных действиях лекарственных средств, нежелательных реакциях, серьёзных нежелательных реакциях, непредвиденных осуществляется Федеральной службой по надзору в сфере здравоохранения - службой фармаконадзора.
Фармаконадзор осуществляется соответствующим уполномоченным Федеральным органом исполнительной власти в установленном им порядке с учётом нормативно правовой базы в т.ч. и при новой коронавирусной инфекции COVID-19 (Табл. 1).
| № | Нормативно-правовые документы |
|---|---|
| 1. | Федеральный закон от 12.04.2010 №61-ФЗ "Об обращении лекарственных средств" |
| 2. | Постановление Правительства Российской Федерации от 30.06.2004 №323 "Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения и социального развития" |
| 3. | Правила надлежащей практики фармаконадзора (GVP) Евразийского экономического союза, утвержденные Советом Евразийской Экономической Комиссии от 03.11.2016 №87 |
| 4. | Приказ Росздравнадзора "Об утверждении Порядка осуществления фармаконадзора" от 15.02.2017 №1071 |
| 5. | Правила надлежащей клинической практики (GCP) ЕАЭС, утвержденные Советом ЕЭК 03.11.2016 №79 |
| 6. | Приказ Минздравсоцразвития РФ от 26.08.2010 №758н "Об утверждении Порядка приостановления применения лекарственного препарата для медицинского применения" |
| 7. | Национальный стандарт "Надлежащая клиническая практика. ГОСТ Р 52379-2005", утвержденный приказом Ростехрегулирования от 27.09.2005 №232-с |
Субъекты обращения лекарственных средств в порядке, установленном уполномоченным федеральным органом исполнительной власти, обязаны сообщать в уполномоченный федеральный орган исполнительной власти о побочных действиях (ПД), нежелательных реакциях (НР), серьёзных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека либо животного при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов в Российской Федерации [1].
Деятельность по фармаконадзору в медицинской организации регламентируется внутренними приказами.
Субъекты обращения лекарственных средств (медицинские организации) обязаны в срок не более 3 рабочих дней предоставлять информацию в Росздравнадзор на летальные или угрожающие жизни нежелательные реакции, произошедшие в данном учреждении. В течение 15 календарных дней:
1. серьезные НР;
2. НР при злоупотреблении препаратом, намеренной передозировке, воздействии, связанном с профессиональной деятельностью, в случаях использования для умышленного причинения вреда жизни и здоровью;
3. отсутствие эффективности ЛП для заболеваний, представляющих непосредственную угрозу жизни, вакцин, ЛП для предотвращения беременности, когда отсутствие клинического эффекта не вызвано индивидуальными особенностями пациента и/или спецификой его заболевания, выявленных в России;
4. угрозе жизни и здоровью вследствие передачи инфекций через ЛП [3].
Случаи индивидуальной непереносимости, явившиеся основанием для выписки ЛП по торговым наименованиям в рамках программ льготного лекарственного обеспечения, подлежат направлению врачебными комиссиями, в порядке, определенном приказом Минздрава России от 05 мая 2012 №502н "Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации" в течение 5 рабочих дней с даты выписки соответствующего лекарственного препарата.
Согласно приказу №1071 "Об утверждении порядка осуществления фармаконадзора" от 15.02.2017 регистрация обращения субъектами лекарственных средств, осуществляется через базу данных "Фармаконадзор 2.0" - автоматизированной информационной системы (АИС) Росздравнадзора http://external.roszdravnadzor.ru.
Согласно проекту изменений приказа №1071 "Об утверждении порядка осуществления фармаконадзора" от 15.02.2017 сообщения при невозможности их подачи через АИС Росздравнадзора держателями регистрационных удостоверений отправляются по электронной почте pharm@roszdravnadzor.cov.ru; юридическими лицами, на имя которых выданы разрешения на проведение клинических исследований, по электронной почте - clinic@roszdravnadzor.cov.ru и субъектами обращения лекарственных средств (медицинскими организациями) по электронной почте npr@roszdravnadzor.cov.ru.
Регистрация субъектов обращения лекарственных средств в АИС Росздравнадзора с целью подачи сообщений осуществляется по заявлению пользователя, формируемому на официальном сайте Росздравнадзора в сети "Интернет" по адресу http;//external.roszdravnadzor.ru.
В соответствии с п.4 Постановления Правительства Российской Федерации от 03.04.2020 №441 "Об особенностях обращения лекарственных препаратов для медицинского применения, которые предназначены для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и для организации оказания медицинской помощи лицам, пострадавшим в результате чрезвычайных ситуаций, предупреждения чрезвычайных ситуаций, профилактики и лечения заболеваний, представляющих опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов" допускается представление в разделе клинической документации предусмотренного сводного краткого отчёта об имеющихся на момент подачи заявления (подпункт "т" пункта 3 настоящего документа). Подпункт "т" пункта 3 настоящего документа - раздел клинической документации, включает в себя отчеты о результатах клинических исследований лекарственного препарата, в том числе: отчеты об исследованиях биодоступности и биоэквивалентности, исследованиях, устанавливающих корреляцию результатов, полученных в условиях in vitro и in vivo; отчеты о фармакокинетических исследованиях; отчеты о фармакодинамических исследованиях; отчеты о клинических исследованиях эффективности и безопасности, проведенных в Российской Федерации; отчет о пострегистрационном опыте применения (при наличии). В соответствии с п.7 Министерство при осуществлении государственной регистрации ЛП в случаях, указанных в п.4 настоящего документа, устанавливает при необходимости одно или несколько следующих условий:
1. введение ограничений по применению ЛП для его безопасного применения;
2. уведомление Федеральной службы по надзору в сфере здравоохранения о каждом факте применения ЛП;
3. обязательность проведения пострегистрационных клинических исследований, результаты которых являются основанием для оценки отношения ожидаемой пользы к возможному риску применения ЛП при подтверждении его государственной регистрации;
4. обязательность посерийного выборочного контроля качества лекарственных средств в соответствии с законодательством Российской Федерации;
5. требования к маркировке ЛП;
6. представление в Федеральную службу по надзору в сфере здравоохранения, в том числе с использованием сайтов в информационно-телекоммуникационной сети "Интернет" и мобильных приложений, сообщений о побочных действиях, нежелательных реакциях, серьезных нежелательных и непредвиденных нежелательных реакциях при применении лекарственного препарата, об особенностях его взаимодействия с другими лекарственными препаратами, индивидуальной непереносимости, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека или влияющих на изменение отношения ожидаемой пользы к возможному риску применения лекарственного препарата и выявленных на всех этапах обращения.
Лекарственные препараты зарегистрированные в соответствии с Постановлением Правительства Российской Федерации от 03.04.2020 №441 (Табл. 2) проходят учёт каждого факта применения при новой коронавирусной инфекции COVID-19 в Единой государственной информационной системе в сфере здравоохранения (http://external.roszdravnadzor.ru), о каждом факте развития нежелательной реакции или отсутствии терапевтического эффекта предложено сообщать субъектам обращения лекарственных средств, включая медицинские организации в Росздравнадзор. Последовательность действий медицинских организаций имеет установленный порядок (Рис. 3) для поддержки принятия управленческих решений, принятия управленческих решений и исполнения управленческих решений.
| № | МНН | ТН |
|---|---|---|
| 1. | ФАВИПИРАВИР | АВИФАВИР АРЕПЛИВИР КОРОНАВИР КОВИДОЛЕК ФАВИПИРАВИР |
| 2. | ЛЕВИЛИМАБ | ИЛСИРА |
| 3. | РЕМДЕСИВИР | ВЕКЛУРИ РЕМДЕФОРМ |
| 4. | Иммуноглобулин человека против COVID-19 | КОВИД-глобулин |
| 5. | Тирозил-D-аланил-глицил-фенилаланил-лейцил-аргинин | ЛЕЙТРАГИН |
| 6. | Вакцина для профилактикиновой короновирусной инфекции COVID-19 | Гам-КОВИД-Вак ЭпиВакКорона КовиВак Спутник Лайт |
Поддержка принятия решений при управлении рисками фармакотерапии в лечении новой коронавирусной инфекции COVID-19 осуществляется на основе регламентированных алгоритмов (Рис. 2 и Рис. 3) и специально созданных программных средств поддержки принятия решений - Единая государственная информационная система в сфере здравоохранения (http://external.roszdravnadzor.ru).
5 РАБОЧИХ ДНЕЙ "Карту регистрации больного с осложнениями после иммунизации туберкулезной вакциной" в ФГБУ НМИЦ Фтизиопульмонологии и инфекционных заболеваний
12 ЧАСОВ
- уведомление Роспотребнадзора (чрезвычайное донесение);
- уведомление Росздравнадзора (электронное извещение о нежелательной реакции)
2 ЧАСА
- уведомление Роспотребнадзора (по телефону);
- организация расследованияиммунологической комиссией;
-решение вопроса о приостановлении применения вакцины и/или противовирусного ЛП в организации
НЕМЕДЛЕННО - ПЕРВАЯ ПОМОЩЬ! Уведомление руководителей медицинской организации
Рис. 2. Последовательность действий медицинской организации

Рис. 3. Учёт нежелательных реакций после вакцинации.
*ПППИ - побочные проявления после иммунизации
Согласно двухфакторной теории Герцберга, мотивировать исполнение решений может только выполнение значимой и сложной задачи - формирование коллективного иммунитета (достаточность вакцинирующих ЛП) и сохранение для населения определенного объёма бесплатной медицинской помощи, гарантированной обществу государством при новой коронавирусной инфекции COVID-19 противовирусными лекарственными средствами.
Контролю подлежит исполнение управленческих решений. Используя каналы обратной связи с использованием компьютерных технологий через АИС, происходит сбор и обработка информации, даётся оценка и принимаются оперативные решения в соответствии с Приказ Росздравнадзора "Об утверждении Порядка осуществления фармаконадзора" от 15.02.2017 №1071 и Приказа Минздрава России от 14.11.2018 №777н "Об утверждении Порядка приостановления применения лекарственного препарата для медицинского применения".
Заключение
|
 |
 |
Таким образом, деятельность медицинской организации по фармаконадзору должна соответствовать приказу Росздравнадзора "Об утверждении Порядка осуществления фармаконадзора" от 15.02.2017 №1071; отказ фиксации нежелательных реакций, выявленных пациентами не допустим; медицинским организациям и органам управления здравоохранением необходимо уделить внимание организации расследований ПППИ с учетом Методических рекомендаций Минздрава России (Письмо Министерства здравоохранения РФ от 30 октября 2021 г. N 30-4/И/2-17927 О направлении актуализированных временных методических рекомендаций: "Порядок проведения вакцинации взрослого населения против COVID-19"); для повышения активности медицинских работников в области фармаконадзора организовать обучение и подготовить информационные материалы совместно с территориальными управлениями Росздравнадзора; использовать активно инструменты репортирования информации и через мобильные приложения; контроль организации фармаконадзора в медицинских организациях осуществлять с использованием проверочных листовок контрольно-надзорных мероприятий в соответствии с постановлением Правительства России от 13.02.2017 №177 "Об утверждении общих требований к разработке и утверждению проверочных листов (списков контрольных вопросов)".
Список литературы |
 |
 1. Об утверждении Порядка осуществления фармаконадзора: приказ Росздравнадзора от 15.02.2017 №1071 // СПС "Консультант Плюс"
1. Об утверждении Порядка осуществления фармаконадзора: приказ Росздравнадзора от 15.02.2017 №1071 // СПС "Консультант Плюс"  2. Венедиктов Д.Д. Системный кризис здравоохранения / Д.Д. Венедиктов// Экономические стратегии. - 2011. - №7-8. - с. 102-111.
2. Венедиктов Д.Д. Системный кризис здравоохранения / Д.Д. Венедиктов// Экономические стратегии. - 2011. - №7-8. - с. 102-111.  3. Стародубов В.И. Клиническое управление: теория и практика / В.И. Стародубов, Т.К. Луговкина. - А. И. Николина, В. В. Николина. - М. "Медицина", 2003. - 191 с.
3. Стародубов В.И. Клиническое управление: теория и практика / В.И. Стародубов, Т.К. Луговкина. - А. И. Николина, В. В. Николина. - М. "Медицина", 2003. - 191 с.
 |
Главное меню |
 |
Заглавие |
 |
Введение |
 |
Обсуждение результатов |
 |
Заключение |
 |
Список литературы |
Текстовый Файл  |
|
Телефон: (4212) 30-53-11
«Вестник общественного здоровья и здравоохранения Дальнего Востока России»