2024 год № 2
Общие вопросы охраны здоровья населения
Резюме:
Ключевые слова:
Summary:
Key words:
Ведение
|
 |
 |
Дисплазия соединительной ткани (ДСТ) является одной из наиболее важных проблем в современной педиатрии, поскольку количество пациентов, сталкивающихся с этим заболеванием, постоянно увеличивается. Под термином ДСТ принято понимать нарушение структуры тканей с уменьшением содержания определенных видов коллагена или нарушением их архитектуры и соотношения, сопровождающееся снижением прочности соединительной ткани органов и систем.
В разных группах детского населения частота встречаемости ДСТ колеблется от 26% до 80% [2, 4, 5]. Высокая распространенность признаков ДСТ была выявлена среди подростков в возрасте 10-14 лет [2, 4, 5, 8]. Распространенность, прогрессирующий характер и неблагоприятный прогноз этого заболевания делают его важной медицинской и социальной проблемой. В ряде исследований подчеркивается полиорганный характер патологии, ассоциированной с ДСТ [3, 9, 10, 12].
Предметом нашего интереса явилось изучение состояния репродуктивной системы у подростков с маркерами дисплазии.
Репродуктивное здоровье - это не только отсутствие заболеваний репродуктивной системы, нарушений ее функций и/или процессов, но и состояние полного физического и социального благополучия, способность к репродукции (рождению детей) и самостоятельному решению вопросов планирования семьи. Исследование данной тематики обусловлено актуальной медико-социальной проблемой, связанной с обеспечением сохранения репродуктивного и трудового потенциала населения в настоящее время и в перспективе.
Исследования, проведенные в данном направлении, в основном охватывают взрослое население, в особенности женщин, и указывают на негативное воздействие ДСТ на состояние репродуктивной системы и выполнение фертильной функции [1, 6, 7, 11]. Однако исследования репродуктивной системы у подростков с ДСТ остаются недостаточно изученными [8, 13].
Материалы и методы
|
 |
 |
С целью изучения клинических особенностей ДСТ в условиях НИИ охраны материнства и детства ХФ СО РАМН было проведено комплексное исследование 228 подростков в возрасте 10-17 лет с ДСТ, из которых 51% составили девочки и 49% - мальчики.
Средний возраст подростков составил 14,2±0,3 года. Контрольную группу составили 75 подростков в возрасте 10-17 лет (средний возраст 13,2±0,2 года) с 1 и 2 группами здоровья без маркеров ДСТ, из них 47 % девочек и 53 % мальчиков.
Выявление фенотипических маркеров ДСТ проводилось по алгоритму специально разработанной тематической карты, включающей 50 наиболее часто встречающихся признаков по фенотипу и результатам комплексного обследования [2, 3].
Диагноз ДСТ устанавливался при: выявлении у подростка 6 и более клинико-инструментальных признаков соединительнотканной дисплазии; вовлечении в патологический процесс 2 и более органов и систем и наличии сегрегации маркеров дисплазии в родословной.
Тяжесть ДСТ определяли по шкале бальной оценки значимости фенотипических и клинико-инструментальных критериев с оценкой суммарного значения баллов [3].
По результатам расчетов подростки с ДСТ были разделены на 3 клинические группы, представленные в Табл. 1.
| Степень тяжести | Сумма баллов | Абсолютное количество, n | Доля, % |
|---|---|---|---|
| Минимальная | <21 | 74 | 32 |
| Средняя | 21-40 | 116 | 51 |
| Тяжелая | >40 | 38 | 17 |
Ультразвуковое исследование органов брюшной полости, мочевыводящих путей и малого таза проводилось на ультразвуковом аппарате ALOKA 1700 (Япония) по общепринятой методике.
Забор крови для определения гормонального статуса брали из локтевой вены в утренние часы на 3-5 день госпитализации натощак.
В данном исследовании были измерены уровни различных гормонов и веществ в сыворотке крови детей. Конкретно, были определены уровни пролактина (ПРЛ), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), тестостерона (Т), эстрадиола (Э), дигидроэпиандростерона (ДГЭА-с) и кортизола (К). Для измерения использовался иммуноферментный метод с использованием наборов реактивов фирмы "АлкорБио" из Санкт-Петербурга, а результаты исследования получали на колориметре "StatFacs-2100" из США.
Рутинное цитогенетическое исследование (G-окраска).
Комплексное обследование было проведено после получения добровольного информированного согласия от родителей и самого подростка, который достиг возраста 15 лет.
Для статистической обработки материала использовались программные средства Statistiсa (версия 6.0) от компании StatSoft Inc. (США) и Microsoft Excel 2003.
Были проведены расчеты общепринятых статистических показателей, включая средние значения величин, их стандартные ошибки и стандартные отклонения. Для оценки достоверности различий между средними значениями величин в различных исследуемых категориях был использован t-критерий Стьюдента. Для определения достоверности различий в частотах аллелей и генотипов между группами были использованы непараметрические показатели. Для сравнения выборок был применен критерий хи-квадрат с поправкой Иейтса, чтобы определить статистическую достоверность этих различий. Различия считались статистически значимыми при значении р менее 0,05.
Обсуждение результатов
|
 |
 |
При анализе тематических жалоб в исследуемой группе девочек альгодисменорея встречалась в 17,5% случаев, гипоменструальный синдром - в 9,1%, полименорея - в 31,8%, длительные кровотечения (более 5 дней) - в 17,3%.
Средний возраст менархе у девочек с ДСТ составил 13,3±0,2 года, причем у 19,2% менархе наступило после 14 лет. У мальчиков 7,8 % были активные жалобы на задержку полового развития.
При обследовании степень развития вторичных половых признаков оказалась в пределах возрастной нормы у 87,5 % подростков, а у 12,5 % наблюдалась задержка полового развития.
По данным ультразвукового исследования, патология гонад была выявлена в 46,1% случаев, с одинаковой частотой в гендерных группах. Структура выявленных нарушений репродуктивных органов по данным УЗИ представлена в Табл. 2.
| Изменения гонад по УЗИ | Препубертат | Пубертат | ||
|---|---|---|---|---|
| Абс. | % | Абс. | % | |
| МАТКА: | 26 | 100 | 20 | 100 |
| Гипоплазия | 18 | 69,2 | 14 | 70 |
| Отсутствие дифференцировки на эндо- и миометрий | 10 | 38,5 | 2 | 10* |
| Антефлексио | 6 | 23 | 6 | 30 |
| Двурогая матка | 0 | 0 | 2 | 10 |
| ЯИЧНИКИ: | 28 | 100 | 39 | 100 |
| Не определяются | 8 | 28,6 | 0 | 0* |
| Гипоплазия | 14 | 50,0 | 27 | 69,2 |
| Высокое положение | 8 | 28,6 | 9 | 23,1 |
| Единичная киста | 0 | 0 | 4 | 10,3 |
| Поликистоз | 0 | 0 | 6 | 15,1 |
| ЯИЧКИ: | 18 | 100 | 13 | 100 |
| Гипоплазия | 10 | 55,6 | 3 | 23,1* |
| Варикоцеле | 5 | 27,8 | 6 | 46,2* |
| Киста придатка | 0 | 0 | 1 | 7,8 |
| Водянка яичка | 1 | 5,6 | 1 | 7,8 |
| ПЕНИС: | 2 | 100 | 2 | 100 |
| Микропенис | 2 | 100 | 2 | 100 |
Примечание: * - р < 0,05 в сравнении с препубертатным периодом развития
У девочек были выявлены гипоплазия матки, аномально высокое положение и поликистоз яичников. У двух девочек была обнаружена врожденная аномалия матки - двурогая матка.
В процессе возрастного развития происходят определенные изменения в структуре выявленной патологии. У девочек в возрасте от 14 до 17 лет обнаруживается дифференциация слоев матки на эндометрий и миометрий, однако увеличивается частота гипоплазии яичников и появления кистозных изменений.
У мальчиков были выявлены задержка полового развития, проявляющаяся в гипоплазии яичек и микрофаллосе, а также варикоцеле и кисты придатка яичка. Возрастная динамика в данной группе исследования показывает, что размеры яичек у мальчиков увеличиваются с определенной задержкой.
Для исключения хромосомных синдромов у подростков с гипоплазией гонад было проведено рутинное цитогенетическое исследование, и во всех случаях не было обнаружено изменений в кариотипе.
Активность гонадотропов гипофиза у подростков с СТД иллюстрирована на Рис. 1.
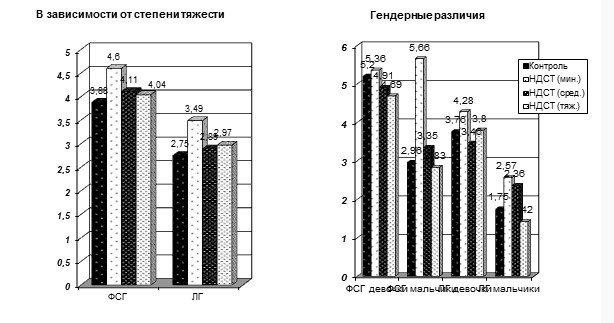
Рис. 1. Уровни фолликуло-стимулирующего гормона (ФСГ) и лейтинизирующего гормона (ЛГ) у подростков с ДСТ различной степени тяжести в разрезе общей популяции и гендерных группах.
Значения ФСГ и ЛГ при минимальной степени ДСТ в общей группе оказались достоверно значительно выше, чем в контрольной группе (p<0,05). С увеличением тяжести диспластических изменений наблюдается тенденция к нормализации уровня ФСГ.
С увеличением степени дисплазии у девочек отмечается снижение уровня ФСГ по сравнению с контрольными значениями, при этом однонаправленных изменений уровня ЛГ не наблюдается.
У мальчиков отмечается резкое увеличение уровня фолликулостимулирующего гормона при минимальной степени ДСТ, с последующим снижением уровня ниже контрольного при тяжелой степени ДСТ.
Таким образом, при низкой степени ДСТ происходит активация гонадотропной функции гипофиза, сопровождающаяся снижением показателей в случае прогрессирования диспластических изменений.
На Рис. 2 представлена возрастная динамика гонадотропных гормонов у подростков с ДСТ в разрезе гендерных групп.
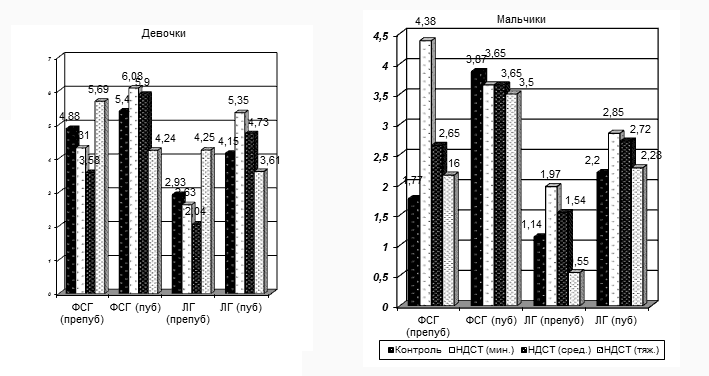
Рис. 2. Возрастная динамика гонадотропных гормонов у подростков с ДСТ в гендерных группах.
Уровень пролактина (ПРЛ) у подростков с НДСТ отображен на Рис. 3.
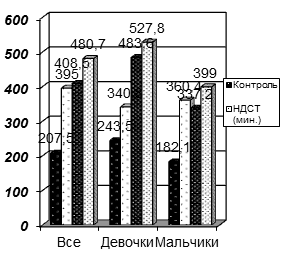
Рис. 3. Уровень пролактина у подростков с НДСТ различной степени тяжести.
Уровень пролактина (ПРЛ) превысил контрольные значения у обеих групп детей (p<0,05). У девочек уровень ПРЛ увеличивался пропорционально степени тяжести диспластических изменений. У мальчиков уровни ПРЛ были значительно выше контроля в 1,8 раза (p<0,05), достигая максимальных значений при тяжелой степени ДСТ.

Рис. 4. Уровень ПРЛ в зависимости от возраста и степени тяжести диспластических изменений в гендерных группах.
Был проведен анализ уровня ПРЛ в зависимости от возраста и степени тяжести диспластических изменений в гендерных группах. Результаты исследования представлены на Рис. 4.
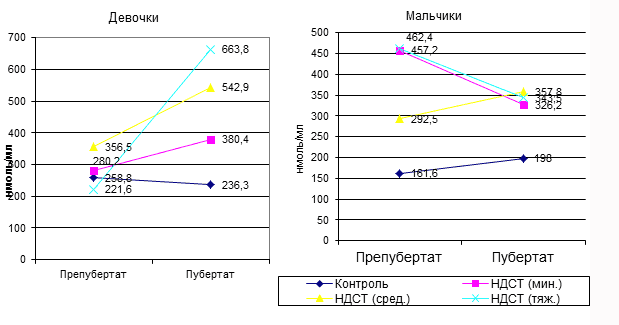
Рис. 5. Возрастная динамика уровней ПРЛ у подростков с ДСТ различной степени тяжести в гендерных группах.
У девочек в возрасте от 14 до 17 лет наблюдается увеличение уровня пролактина при прогрессировании диспластических изменений. Это свидетельствует о повышении напряжения регуляторных механизмов при увеличении тяжести ДСТ.
У мальчиков в пубертатном периоде наблюдается разнонаправленная динамика уровня ПРЛ в зависимости от степени дисплазии. При средней степени дисплазии наблюдается увеличение уровня ПРЛ, в то время как при минимальной и тяжелой степени дисплазии наблюдается снижение этого показателя. Эти изменения клинически проявляются накоплением признаков дисплазии соединительной ткани и отклонениями в работе репродуктивной системы.
Изменение ритма выделения пролактина (ПРЛ) может служить индикатором реакции организма на воздействие окружающей среды, проявляясь как временное или стойкое повышение уровня пролактина в крови.
Изучение показало, что у 14% подростков из группы с избыточным ГП проблема наблюдается преимущественно у девочек (73,2%) в период полового созревания (75,4%), при умеренной (44,2%) и тяжелой (37,2%) степени ДСТ.
Органическое происхождение гипофизарной патологии было исключено после комплексного обследования, включающего МРТ головного мозга, осмотр глазного дна, а также определение уровня пролактина и макропролактина в динамике. Выявлено, что гипофизарная патология является доброкачественной и обусловлена высокими стрессовыми нагрузками на организм подростка с ДСТ.
В результате анализа уровней периферических половых гормонов были обнаружены значимые различия между клиническими группами и контрольной группой. Подробные данные представлены на Рис. 6.
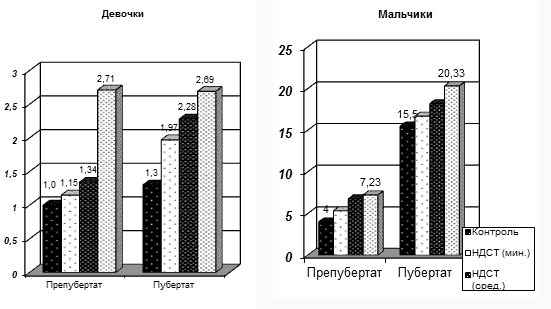
Рис. 6. Возрастная динамика тестостерона у подростков с ДСТ в гендерных группах.
Исследование показало, что уровни тестостерона у подростков обоих полов превышают норму и увеличиваются с увеличением степени тяжести дисплазии (р<0,05). У мальчиков повышенный уровень тестостерона в сочетании с гипогонадизмом может указывать на недостаточную чувствительность рецепторов органов-мишеней к периферическим гормонам.
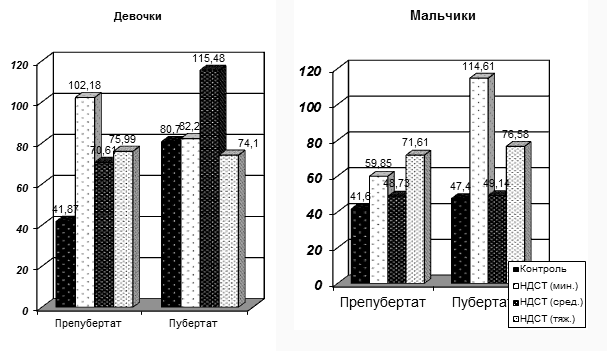
Рис. 7. Возрастная динамика эстрадиола у подростков с ДСТ в гендерных группах.
Обнаружено увеличение уровней эстрадиола в обеих гендерных группах по сравнению с контрольной группой, независимо от степени тяжести.
Были изучены уровни гормонов надпочечников. На Рис. 8 представлена возрастная динамика уровней кортизола и дигидроэпиандростерона у подростков с различными степенями тяжести ДСТ.
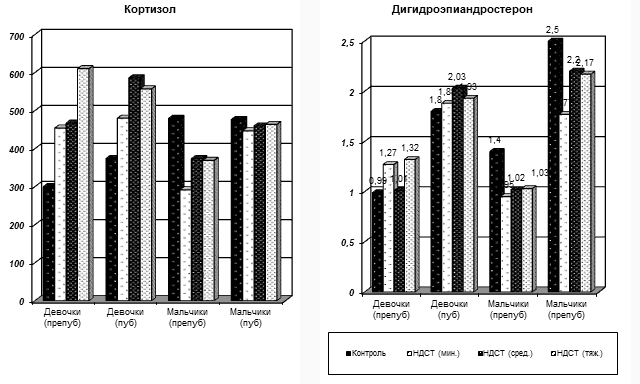
Рис. 8. Возрастная динамика кортизола и дигидроэпиандростерона у подростков с ДСТ различной степени тяжести.
Повышенный уровень тестостерона у девочек, вместе с подтвержденным увеличением кортизола и ДГЭА-с (p<0,05), при наличии гиперпролактинемии у девочек с ДСТ может быть одной из причин нарушения формирования репродуктивной системы и привести к ановуляторным циклам с образованием пролиферативных и кистозных изменений в железистой ткани яичников.
В противоположность девочкам, у мальчиков из исследуемой группы было обнаружено значительное снижение уровней кортизола и ДГЭА-с в препубертатном периоде, независимо от тяжести ДСТ (p<0,05), с наблюдением тенденции сохранения этого снижения в пубертатном периоде.
Заключение
|
 |
 |
Таким образом, подростки, у которых присутствуют маркеры ДСТ различной степени тяжести, составляют группу риска по поводу нарушений формирования репродуктивной системы периферического и центрального генеза.
Характер нейроэндокринных и органных нарушений репродуктивной системы определяется выраженностью диспластических изменений.
В структуре нарушений полового развития у подростков с ДСТ преобладает задержка формирования гонад на фоне повышенного уровня гонадотропных и периферических половых гормонов, повышения уровня пролактина вплоть до доброкачественной гиперпролактинемии, высокой андроген-глюкокортикоидной функциональной активности надпочечников у девочек.
Антистрессовые нейроэндокринные ресурсы у подростков с ДСТ имеют обратную связь со степенью тяжести диспластических изменений. Девочки с маркерами ДСТ обладают более высоким уровнем адаптационного потенциала, в то время как у мальчиков обнаружена субклиническая недостаточность гипофизарно-надпочечниковой системы.
Выявленные изменения подчеркивают важность проведения комплексного клинического и лабораторно-инструментального обследования каждого подростка с маркерами ДСТ, особенно у тех, кто находится в группе высокого риска. Целью такого обследования является ранняя диагностика нарушений и своевременная коррекция для сохранения репродуктивного потенциала у населения.
Список литературы |
 |
 1. Железная А.А., Вустенко В.В., Межова О.К. Значение недифференцированной дисплазии соединительной ткани в акушерско-гинекологической практике// Медико-социальные проблемы семьи.- 2015. - Т. 20(3-4). - С. 55-57.
1. Железная А.А., Вустенко В.В., Межова О.К. Значение недифференцированной дисплазии соединительной ткани в акушерско-гинекологической практике// Медико-социальные проблемы семьи.- 2015. - Т. 20(3-4). - С. 55-57. 2. Иванова И. И., Макарова И. И., Гнусаев С. Ф., Коваль Н. Ю., Иванова А. А. Сравнительная характеристика методов диагностики дисплазии соединительной ткани у детей // Экология человека. - 2016. № 3. - С. 24-29.
2. Иванова И. И., Макарова И. И., Гнусаев С. Ф., Коваль Н. Ю., Иванова А. А. Сравнительная характеристика методов диагностики дисплазии соединительной ткани у детей // Экология человека. - 2016. № 3. - С. 24-29. 3. Кадурина Т.И., Гнусаев С.Ф., Аббакумова Л.Н., и др. Наследственные и многофакторные нарушения соединительной ткани у детей: алгоритмы диагностики, тактика ведения. Проект российских рекомендаций // Медицинский вестник Северного Кавказа. - 2015. - Т.10. - №1 - С. 5-35.
3. Кадурина Т.И., Гнусаев С.Ф., Аббакумова Л.Н., и др. Наследственные и многофакторные нарушения соединительной ткани у детей: алгоритмы диагностики, тактика ведения. Проект российских рекомендаций // Медицинский вестник Северного Кавказа. - 2015. - Т.10. - №1 - С. 5-35.  4. Калаева Г.Ю., Хохлова О.И. , Деев И.А., Самойлова Ю.Г. Распространенность и клиническая характеристика дисплазии соединительной ткани у подростков // Педиатрическая фармакология. - 2017. - Т. 14 № 5. - С. 373-379.
4. Калаева Г.Ю., Хохлова О.И. , Деев И.А., Самойлова Ю.Г. Распространенность и клиническая характеристика дисплазии соединительной ткани у подростков // Педиатрическая фармакология. - 2017. - Т. 14 № 5. - С. 373-379.  5. Калаева Г.Ю., Хохлова О.И., Деев И.А. Способ скрининга дисплазии соединительной ткани у подростков // Бюллетень сибирской медицины. - 2016. - Т.15. - №2 - С. 35-44.
5. Калаева Г.Ю., Хохлова О.И., Деев И.А. Способ скрининга дисплазии соединительной ткани у подростков // Бюллетень сибирской медицины. - 2016. - Т.15. - №2 - С. 35-44.  6. Кан Н.Е., Тютюнник В.Л., Амирасланов Э.Ю. и др. Акушерские осложнения и недифференцированная дисплазия соединительной ткани // Клиническая и экспериментальная хирургия. Журнал им. акад. Б.В. Петровского. - 2015. - № 2. -С. 47-52.
6. Кан Н.Е., Тютюнник В.Л., Амирасланов Э.Ю. и др. Акушерские осложнения и недифференцированная дисплазия соединительной ткани // Клиническая и экспериментальная хирургия. Журнал им. акад. Б.В. Петровского. - 2015. - № 2. -С. 47-52. 7. Кудинова Е. Г. Репродуктивное здоровье женщин с неклассифицируемым фенотипом наследственных нарушений соединительной ткани : автореф. дис. … д-ра мед. наук. М., 2015.
7. Кудинова Е. Г. Репродуктивное здоровье женщин с неклассифицируемым фенотипом наследственных нарушений соединительной ткани : автореф. дис. … д-ра мед. наук. М., 2015. 8. Кудинова Е. Г. Риск репродуктивных нарушений у девочек-подростков с дисплазией соединительной ткани// Репродуктивное здоровье детей и подростков. - 2013. - Т. - 4. - С..31-32.
8. Кудинова Е. Г. Риск репродуктивных нарушений у девочек-подростков с дисплазией соединительной ткани// Репродуктивное здоровье детей и подростков. - 2013. - Т. - 4. - С..31-32. 9. Петрова Е.В., Попова Т.Ф., Грибачева И.А., Тайтубаева Г.К. Роль дисплазии соединительной ткани в возникновении нетравматического субарахноидального кровоизлияния в молодом возрасте// Исследования и практика в медицине. - 2018. - Т. - 5(2). - С. 72-79. DOI: 10.17709/2409-2231-2018-5-2-8.
9. Петрова Е.В., Попова Т.Ф., Грибачева И.А., Тайтубаева Г.К. Роль дисплазии соединительной ткани в возникновении нетравматического субарахноидального кровоизлияния в молодом возрасте// Исследования и практика в медицине. - 2018. - Т. - 5(2). - С. 72-79. DOI: 10.17709/2409-2231-2018-5-2-8. 10. Резниченко Н.А., Золото Е.В., Майлян Э.А., Лесниченко Д.А., Немсадзе И.Г., Прилуцкий А.С., Багрий А.Э., Трунова О.А., Прохоров Е.В. Корреляции цитокинов, регулирующих синтез структурных макромолекул соединительной ткани при недифференцированной дисплазии соединительной ткани у девочек-подростков// Медицинский вестник Юга России.- 2023. - Т. - 14 ( 3). - С.92-100.
10. Резниченко Н.А., Золото Е.В., Майлян Э.А., Лесниченко Д.А., Немсадзе И.Г., Прилуцкий А.С., Багрий А.Э., Трунова О.А., Прохоров Е.В. Корреляции цитокинов, регулирующих синтез структурных макромолекул соединительной ткани при недифференцированной дисплазии соединительной ткани у девочек-подростков// Медицинский вестник Юга России.- 2023. - Т. - 14 ( 3). - С.92-100. 11. Смольнова Т. Ю. Пролапс гениталий и дисплазия соединительной ткани// Клиническая и экспериментальная хирургия - 2015. - Т. - 2. - С.53-64.
11. Смольнова Т. Ю. Пролапс гениталий и дисплазия соединительной ткани// Клиническая и экспериментальная хирургия - 2015. - Т. - 2. - С.53-64. 12. Хайбуллина Д.Х. Особенности неврологического статуса у детей с дорсопатиями, ассоциированными с дисплазией соединительной ткани //. Практическая медицина. - 2017. - Т. - 1. - С. 134-137.
12. Хайбуллина Д.Х. Особенности неврологического статуса у детей с дорсопатиями, ассоциированными с дисплазией соединительной ткани //. Практическая медицина. - 2017. - Т. - 1. - С. 134-137. 13. Яворская М. В., Кравцов Ю. А., Кильдиярова Р. Р. [и др.]. Критерии диагностики синдрома дисплазии соединительной ткани и задержки полового развития у детей и подростков// Уральский медицинский журнал. - 2017. - Т.-8. - С.111-117.
13. Яворская М. В., Кравцов Ю. А., Кильдиярова Р. Р. [и др.]. Критерии диагностики синдрома дисплазии соединительной ткани и задержки полового развития у детей и подростков// Уральский медицинский журнал. - 2017. - Т.-8. - С.111-117.
 |
Главное меню |
 |
Заглавие |
 |
Ведение |
 |
Материалы и методы |
 |
Обсуждение результатов |
 |
Заключение |
 |
Список литературы |
Текстовый Файл  |
|
Телефон: (4212) 30-53-11
«Вестник общественного здоровья и здравоохранения Дальнего Востока России»