2024 год № 3
Из материалов V Дальневосточного международного медицинского конгресса
Резюме:
Ключевые слова:
Summary:
Key words:
Введение
|
 |
 |
Актуальным направлением научного поиска в области фармации остается расширение ассортимента ранозаживляющих, антисептических, противовоспалительных средств в виде современных лекарственных форм (ЛФ) для наружного применения. Это обусловлено потребностью современной медицины в эффективных и безопасных лекарствах, сочетающих специфичность действия при определенных заболеваниях с многофункциональными свойствами, позволяющими одним препаратом корректировать разные типы патологии. Кроме того, к важнейшим характеристикам современных лекарственных средств относятся пролонгированность действия и возможность персонификации дозы [19].
Разработка аппликационных лекарственных форм (АЛФ) является перспективным направлением разработки лекарственных средств. АЛФ продлевают время пребывания лекарственных веществ в месте нанесения или абсорбции, облегчают тесный контакт лекарственной формы с лежащей под ней абсорбирующей поверхностью и, таким образом, улучшают терапевтическую эффективность лекарственного средства. Существуют АЛФ для перорального, буккального, назального, ректального и вагинального путей введения, как для системного, так и для местного воздействия. Преимуществами АЛФ считаются возможность внедрения различных лекарственных веществ в основу, контролируемое высвобождение активного ингредиента, хорошие мукоадгезивные свойства, индифферентность, удобство применения. Большой интерес вызывают биодеградируемые составы, поскольку они не требуют извлечения аппликационной лекарственной формы в конце желаемого интервала дозирования [22].
Наиболее широкое практическое применение среди АЛФ нашли пленки, которые представляют собой полимерные эластичные пластинки различной формы с гладкой плоской поверхностью, отличающиеся размером и толщиной [7]. Данные ЛФ обладают рядом неоспоримых достоинств, которые сделали их привлекательными для использования в различных областях медицинской практики. Особую актуальность они имеют в стоматологии, а также в хирургической практике как "аппликационные раневые покрытия" [22, 28]. Преимущество пленок как ЛФ заключается в том, что они обеспечивают пролонгированное фармакологическое действие, прочно удерживаются на влажных поверхностях (на деснах, слизистых оболочках, раневых поверхностях) без нарушения их целостности и травмирования, удобны в применении и хранении, обеспечивают местное воздействие лекарственных веществ [11].
Известны разработки российских ученых в области создания стоматологических пленок. Например, пленки с бишофитом - природным средством, обладающим противовоспалительным, обезболивающим эффектами и содержащим микро- и макроэлементы [5]; пленки с нафтохиноновым комплексом воробейника краснокорневого, обладающие противовоспалительным, противомикробным, ранозаживляющим эффектами [2, 24]. Хорошо известны пленки "Диплен-Дента" российской компании "Норд-Ост", содержащие различные лекарственные вещества (лидокаин, метронидазол, линкомицин, гентамицин, солкосерил, хлоргексидин и др.) для применения в стоматологии.
Пленки с успехом применяют и в офтальмологии, так как в сравнении с традиционными жидкими лекарственными формами они обеспечивают длительное лечебное воздействие на ткани глаза, обеспечивают точное дозирование действующих веществ и высокую стабильность. Так, известен зарегистрированный лекарственный препарат - глазные пленки "Таурин" для коррекции дистрофии и травм роговицы глаза [8]. Ведутся исследования по разработке офтальмологических пленок с экстрактом алоэ жидким для коррекции воспалительных заболеваний конъюнктивы глаз [21]. Общей тенденцией для разработки офтальмологических пленок является повышение их мукоадгезивных свойств, что достигается применением таких полимеров, как производные целлюлозы, поливинилпирролидона, акрилатов [1].
Пленки могут применяться в дерматологической практике для лечения таких заболеваний, как лишай, псориаз, гнойно-воспалительных процессов, ожогов. Например, пленки с облепиховым маслом для лечения различных заболеваний кожи [27]; пленки с алоэ и актовегином [12], обеспечивающие регенерирующий, противовоспалительный эффекты. Особого внимания заслуживают пленки из биосовместимых компонентов для лечения ран и ожогов. Например, предложенные Саломатиной Е.В. и Апрятиной К.В. пленки на основе хитозана и полилактида позволяют ускорить процесс заживления более чем в два раза по сравнению с естественным процессом [22]. Таким образом, разработка полимерных пленок оформилась в самостоятельное направление фармацевтической технологии, а расширение их ассортимента представляет собой актуальную задачу фармации.
Не теряют своей значимости в медицинском применении хорошо известная лекарственная форма - гели. Они имеют широкие перспективы в качестве аппликационных систем. Особый интерес вызывают гели, создающие при нанесении защитную пленку, предотвращающую вторичное инфицирование, и прочно фиксирующиеся на влажной поверхности, что ускоряет процесс заживления ран [22]. По мнению Базаркиной О.В., Семкиной О.А., гели на основе гидрофильных полимеров в качестве мукоадгезивных лекарственных форм часто используются для локального и длительного действия на поверхностях тканей, таких как слизистые оболочки полости рта, глотки, влагалища и прямой кишки, а также на раневых поверхностях [3]. Большой интерес представляют гели на основе хитозана [18].
На сегодняшний день одной из неинвазивных и удобных для использования лекарственных форм для наружного применения, обеспечивающих целенаправленное и эффективное поступление действующих веществ, являются аэрозоли и спреи.
Аэрозоли - лекарственная форма, представляющая собой раствор, эмульсию или суспензию действующих веществ, находящуюся под давлением пропеллента в герметичной упаковке (аэрозольный баллон), снабженной клапанно-распылительной системой, обеспечивающей высвобождение содержимого в виде дисперсии твердых или жидких частиц в газе [7]. Особую значимость для лечения ран и ожогов имеют пенные аэрозоли, например, хорошо известный препарат Олазоль®, содержащий каротиноиды облепихи крушиновидной, обладающий местноанестезирующим, антибактериальным и ускоряющим эпителизацию действиями [8].
Спреи также относятся к аэрозольным препаратам и имеют ряд отличительных особенностей. Преимущество их применения обусловлено возможностью создания альтернативы растворам: при использовании флаконов с насадкой для распыления обеспечивается равномерное распределение содержимого флакона и микробиологическая стабильность препарата. В отличие от аэрозолей они не требуют специального технологического оборудования, вспомогательных веществ в виде пропеллентов, упаковочного материала в виде аэрозольных баллонов и не оказывают влияния на разрушение озонового слоя атмосферы. Высвобождение содержимого флакона происходит за счет давления воздуха, создаваемого с помощью механического распылителя насосного типа или при сжатии полимерной упаковки [7]. Спреи востребованы в современной медицине для местного применения в ЛОР-практике, стоматологии, анестезиологии, гинекологии, дерматологии и других областях медицины (например, Люголь, Лидокаин, Эпиген-интим, Ламизил и др.), а также для наружного применения как антисептические, противогрибковые, нестероидные противовоспалительные препараты, для лечения алопеции и другие [9].
Особое внимание в настоящее время уделяется разработке пленкообразующих аэродисперсных систем, которые представляют собой жидкие или мягкие лекарственные формы, наносимые путем распыления и образующие пленку путем испарения из полимерной системы растворителя. Системы распыления пленкообразующих веществ обладают большим потенциалом для лечения различных типов ран. Так, исследователи из Института фармации им. А.П. Нелюбина ФГАОУ ВО "Первый МГМУ им. И.М. Сеченова" Минздрава России работают над созданием новых пленкообразующих аэродисперсных систем [29].
Не теряют своей актуальности и традиционные жидкие лекарственные формы для наружного применения. В частности, ряд исследователей работают над совершенствованием и созданием новых композиций в виде лосьонов. Так, например, был предложен лосьон для наружного применения, содержащий салициловый спирт, левомицетин, трихопол, спирулину, стрептоцид, эфирный спирт и витамин С и предназначенный для устранения воспалительных элементов (прыщей), восстановления проблемной кожи [6]. Исследователи из ФГБОУ ВО "Иркутский государственный медицинский университет" Минздрава России изучают перспективы применения лосьона с сухим экстрактом из травы бархатцев отклоненных [20].
Таким образом, разработка новых фармацевтических продуктов для наружного применения представляет собой актуальную задачу, а включение в их состав натуральных компонентов, в частности, биологически активных веществ (БАВ) из лекарственных растений, в том числе дальневосточных, открывает широкие перспективы для развития отечественной фарминдустрии.
Каротиноиды, как группа БАВ давно известна науке [4]. Многочисленные экспериментальные исследования in vitro и in vivo показали, что они проявляют антиканцерогенные и антимутагенные, антиоксидантные и радиопротекторные, иммуномодулирующие и антисклеротические, противовоспалительные и многие другие свойства, в связи с чем перспективны для разработки пищевых и лечебно-профилактических средств [10, 13, 14, 25, 26].
Каротиноиды обнаружены во многих объектах природы: это растения, водоросли, микроорганизмы и некоторые виды рыб. Многие из них служат источниками получения каротиноидов для пищевой и фармацевтической промышленности. Так, ценным каротиноидсодержащим растением является облепиха крушиновидная, из плодов которой получают масло, используемое как средство, стимулирующее репаративные процессы при поражениях кожи и слизистых оболочек различной этиологии (раневые, лучевые, ожоговые, язвенные). Масло облепихи является одним из компонентов упомянутого выше аэрозоля Олазоль® для улучшения регенерации тканей.
Источниками каротиноидов являются такие лекарственные растения как различные виды шиповников, календула лекарственная, рябина обыкновенная и другие растения, имеющие ярко-оранжевую и желтую окраску органов.
Рябина похуашаньская (амурская) - Sorbus pochuashanensis (Hance) Hedl. (Sorbus amurensis Koehne) широко распространена в Приморском и Хабаровском краях, встречается на территории Японии, Кореи, Китая. Она является близкородственным видом для рябины обыкновенной, от которой разрешена заготовка лекарственного растительного сырья - плоды.
Рябина похуашаньская (амурская) изучена мало, поэтому на протяжении ряда лет мы изучаем ее компонентный состав. В настоящей работе приводятся данные по содержанию каротиноидов в плодах дальневосточной рябины, с целью обоснования введения ее в медицинскую практику и разработки на ее основе лекарственных средств.
В задачи исследования входил микроанализ плодов рябины похуашаньской (амурской) для обнаружения локализации каротиноидов, изучение спектров извлечений из сырья и оценка количественного содержания каротиноидов в плодах.
Материалы и методы
|
 |
 |
Объектом исследования явились высушенные в хорошо проветриваемом помещении при комнатной температуре образцы плодов рябины похуашаньской (амурской), собранные в различных районах Хабаровского края в 2020-2023 гг.
Локализацию каротиноидов в тканях эндокарпия плодов изучали в соответствии с методами анализа лекарственного растительного сырья [7]. Образцы для микроскопии готовили в технике давленых препаратов [7].
Количественное содержание каротиноидов определяли на спектрофотометре Shimadzu UV-1700 по методике, приведенной в Государственной Фармакопее РФ для плодов шиповника, в пересчете на β-каротин [7]. Спектры снимали в извлечениях, полученных для количественного определения в диапазоне длин волн от 300 до 400 нм. Статистическая обработка результатов осуществлялась в программе Microsoft Excel 2019.
Обсуждение результатов
|
 |
 |
Данные микроскопического анализа представлены на рисунках 1 и 2. Как видно из рис. 1, клетки паренхимы мезокарпа плодов рябины амурской разнообразны по форме и величине, имеют тонкие оболочки и многочисленные оранжево-желтые хромопласты, содержащие кристаллы каротина. При увеличении объекта в 400 раз (рис. 2) видно, что большинство хромопластов имеют веретеновидную форму. По литературным данным в рябинах могут встречаться и другие формы хромопластов - треугольные, раздвоенные, в виде параллелограммов и так далее. В целом, полученные результаты хорошо согласуются с данными для рябины обыкновенной [17].
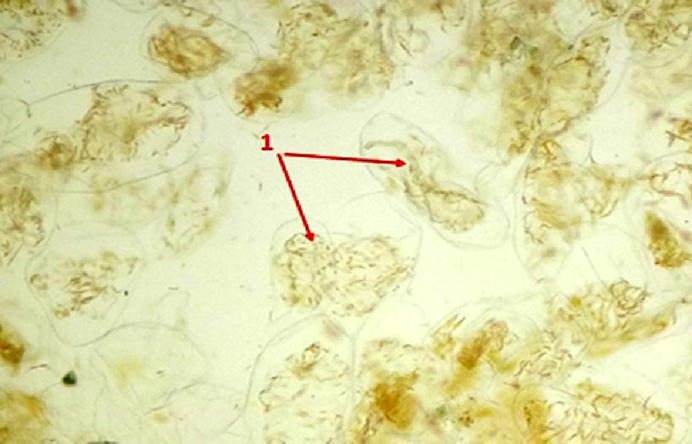
Рис. 1. Фрагмент мезокарпия плодов рябины похуашаньской (амурской). Увел.200. Клетки паренхимы (1) с оранжево-желтыми хромопластами, содержащими кристаллы каротиноидов
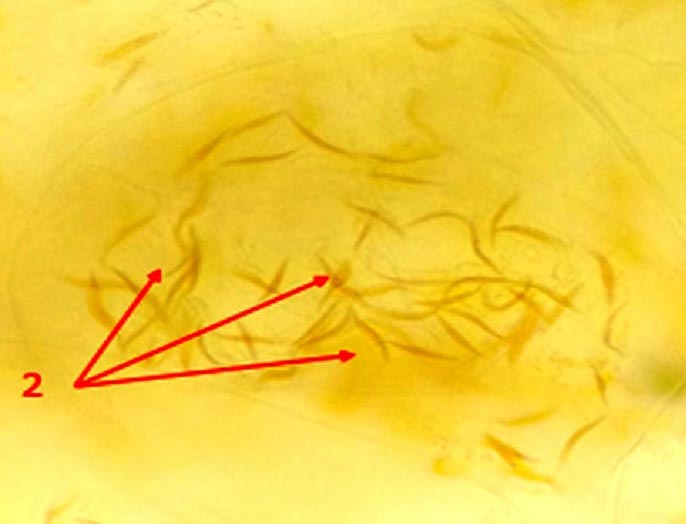
Рис. 2. Увеличенный фрагмент мезокарпия плодов рябины похуашаньской (амурской). Увел.400. Хромопласты (2) с кристаллами каротиноидов
Анализ гексановых спектров извлечений из плодов дальневосточного вида, представленных на рис. 3, показывает, что для всех исследованных образцов присущ общий характер, отличаются они только интенсивностью оптической плотности. Максимумы наблюдаются при 450 нм и 475 нм, также имеется плечо при 425 нм. По литературным данным, аналогичные характеристики в гексане имеет β-каротин [15]. Таким образом, полученные данные позволяют предположить, что β-каротин является преобладающим соединением в каротиноидном комплексе рябины похуашаньской (амурской), кроме того, выбранная методика количественного определения будет отвечать поставленной задаче.
Результаты количественного определения каротиноидов представлены в табл. 1. Как видно из полученных данных, содержание каротиноидов в дальневосточной рябине составляет в среднем 66, 6 мг%, при этом крайние данные различаются между собой в 2,7 раза - от 32 до 87 мг%. Нужно отметить, что эти результаты входят в нормативное содержание каротиноидов, предлагаемое для плодов шиповника, которое составляет не менее 30 мг% [16], и не противоречит данным, полученным для других видов рябин [23]. Таким образом, плоды рябины похуашаньской (амурской) могут служить источником каротиноидов наряду с другими видами лекарственных растений.
Следует отметить, что методика количественного определения проста в использовании, не дает большую ошибку среднего результата, поэтому в дальнейшем планируется провести ее валидационную оценку применительно к сырью рябины похуашаньской (амурской).
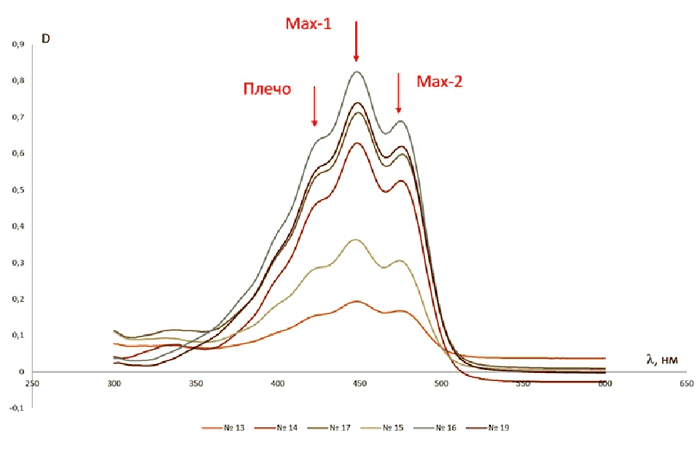
Рис. 3. Спектры гексановых извлечений из образцов плодов рябины похуашаньской (амурской)
| № п/п | Место сбора образца | Содержание каротиноидов, мг% |
|---|---|---|
| 1 (13) | Хабаровский край, хутор Галкино (2020 г.) | 32,27 ± 1,1 |
| 2 (14) | Хабаровский край, г. Хабаровск (пос. им. Горького) (2022 г.) | 37,68 ± 1,4 |
| 3 (15) | Хабаровский край, Вяземский р-н, г. Вяземский (2022 г.) | 74,94 ± 1,8 |
| 4 (16) | Хабаровск, р.п. Хор (2022 г.) | 75,24 ± 1,6 |
| 5 (17) | Хабаровский край, р-н им. Лазо (2022 г.) | 86,11 ± 1,3 |
| 6 (18) | Хабаровский край, г. Хабаровск (2022 г.) | 87,11 ± 1,3 |
| Х ср. | 65,56 ± 1,4 |
Заключение
|
 |
 |
Таким образом, полученные результаты показывают перспективность использования плодов рябины похуашаньской (амурской) в качестве лекарственного растительного сырья - источника каротиноидов, - и возможность создания на их основе современных лекарственных форм для наружного применения.
Список литературы |
 |
 1. Азнабаев М.Т., Азаматова Г.А., Гайсина Г.Я. Глазные лекарственные пленки в профилактике инфекционно-воспалительных осложнений // Саратовский научно-медицинский журнал. - 2018. - Т. 14, № 4. - С. 933-938.
1. Азнабаев М.Т., Азаматова Г.А., Гайсина Г.Я. Глазные лекарственные пленки в профилактике инфекционно-воспалительных осложнений // Саратовский научно-медицинский журнал. - 2018. - Т. 14, № 4. - С. 933-938. 2. Антимикробная активность полимерных шиконинсодержащих пленок в отношении клинически значимых штаммов микроорганизмов / Л. М. Таран, Е. В. Слободенюк, А. Я. Башаров [и др.] // Биофармацевтический журнал. - 2016. - Т. 8, № 3. - С. 18-20.
2. Антимикробная активность полимерных шиконинсодержащих пленок в отношении клинически значимых штаммов микроорганизмов / Л. М. Таран, Е. В. Слободенюк, А. Я. Башаров [и др.] // Биофармацевтический журнал. - 2016. - Т. 8, № 3. - С. 18-20. 3. Базаркина О.В., Семкина О.А., Грибкова Е.И. Разработка новой лекарственной формы с ранозаживляющей и противовоспалительной активностью // Российский научный мир. - 2013. - № 2. - С. 5-16.
3. Базаркина О.В., Семкина О.А., Грибкова Е.И. Разработка новой лекарственной формы с ранозаживляющей и противовоспалительной активностью // Российский научный мир. - 2013. - № 2. - С. 5-16. 4. Бриттон Г. Биохимия природных пигментов. - М.: Мир, 1986. - 442 с.
4. Бриттон Г. Биохимия природных пигментов. - М.: Мир, 1986. - 442 с. 5. Вдовина Г.П., Ганичева Л.М., Меркулова Е.В. Влияние новой лекарственной формы бишофита на скорость кровоснабжения в мягких тканях пародонта у крыс в условиях экспериментального воспаления // Пермский медицинский журнал. - 2006. - Т. 23, № 2. - С. 56-59.
5. Вдовина Г.П., Ганичева Л.М., Меркулова Е.В. Влияние новой лекарственной формы бишофита на скорость кровоснабжения в мягких тканях пародонта у крыс в условиях экспериментального воспаления // Пермский медицинский журнал. - 2006. - Т. 23, № 2. - С. 56-59. 6. Гаджиева А.А. Лосьон для наружного применения // Патент РФ № 2715719, 2019. Бюл. №7.
6. Гаджиева А.А. Лосьон для наружного применения // Патент РФ № 2715719, 2019. Бюл. №7. 7. Государственная Фармакопея Российской Федерации XV издание / [Электронный ресурс Федеральной электронной медицинской библиотеки Министерства здравоохранения Российской Федерации]. - URL: https://pharmacopoeia.regmed.ru/pharmacopoeia/izdanie-15/ (дата обращения: 01.10.2024).
7. Государственная Фармакопея Российской Федерации XV издание / [Электронный ресурс Федеральной электронной медицинской библиотеки Министерства здравоохранения Российской Федерации]. - URL: https://pharmacopoeia.regmed.ru/pharmacopoeia/izdanie-15/ (дата обращения: 01.10.2024). 8. Государственный реестр лекарственных средств. [Электронный ресурс] URL: https://grls.rosminzdrav.ru (дата обращения: 10.10.2024).
8. Государственный реестр лекарственных средств. [Электронный ресурс] URL: https://grls.rosminzdrav.ru (дата обращения: 10.10.2024). 9. Грибкова Е.И., Джавахян Д.Р. Современное состояние и перспективы создания лекарственной формы "спрей" // Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. - 2023. - № 4. - С. 62-68.
9. Грибкова Е.И., Джавахян Д.Р. Современное состояние и перспективы создания лекарственной формы "спрей" // Вестник Воронежского государственного университета. Серия: Химия. Биология. Фармация. - 2023. - № 4. - С. 62-68. 10. Каротиноиды: строение, биологические функции и перспективы применения / Дейнека В. И., Шапошников А. А., Дейнека Л. А., Гусева Т. С. и др. // Актуальные проблемы медицины. 2008. №6 (46). [Электронный ресурс] URL: https://cyberleninka.ru/article/n/karotinoidy-stroenie-biologicheskie-funktsii-i-perspektivy-primeneniya (дата обращения: 02.10.2024).
10. Каротиноиды: строение, биологические функции и перспективы применения / Дейнека В. И., Шапошников А. А., Дейнека Л. А., Гусева Т. С. и др. // Актуальные проблемы медицины. 2008. №6 (46). [Электронный ресурс] URL: https://cyberleninka.ru/article/n/karotinoidy-stroenie-biologicheskie-funktsii-i-perspektivy-primeneniya (дата обращения: 02.10.2024). 11. Кищенко В.М., Верниковский В.В., Привалов И.М., Шевченко А.М. Пленки в российской медицине и косметологии: история развития, классификация, технология // Фармация и фармакология. - 2020. - Т. 8, № 2. - С. 124-132.
11. Кищенко В.М., Верниковский В.В., Привалов И.М., Шевченко А.М. Пленки в российской медицине и косметологии: история развития, классификация, технология // Фармация и фармакология. - 2020. - Т. 8, № 2. - С. 124-132. 12. Кищенко В.М. Разработка состава и стандартизация дерматологических пленок с алоэ и актовегином / В. М. Кищенко // Сб. матер. Междунар. науч. конф. "Молодые ученые - медицине" (20-21 мая 2016). - 2016. - С. 136-139.
12. Кищенко В.М. Разработка состава и стандартизация дерматологических пленок с алоэ и актовегином / В. М. Кищенко // Сб. матер. Междунар. науч. конф. "Молодые ученые - медицине" (20-21 мая 2016). - 2016. - С. 136-139. 13. Коденцова В.М., Рисник Д.В. Каротиноиды: пищевые источники, уровень потребления и клинически эффективные дозы. Медицинский совет. 2023;17(6):299-310. https://doi.org/10.21518/ms2022-046.
13. Коденцова В.М., Рисник Д.В. Каротиноиды: пищевые источники, уровень потребления и клинически эффективные дозы. Медицинский совет. 2023;17(6):299-310. https://doi.org/10.21518/ms2022-046. 14. Колдаев В.М., Кропотов А.В. Каротиноиды в практической медицине. Тихоокеанский медицинский журнал. 2022;(1):65-71. https://doi.org/10.34215/1609-1175-2022-1-65-71
14. Колдаев В.М., Кропотов А.В. Каротиноиды в практической медицине. Тихоокеанский медицинский журнал. 2022;(1):65-71. https://doi.org/10.34215/1609-1175-2022-1-65-71  15. Курегян А.Г., Печинский С.В. Получение каротинодов и их идентификация методами спектроскопии в ИК- и УФ-областях // Вопросы биологическо, медицинской и фармацевтической химии. - 2016. - №1. - С. 22-27.
15. Курегян А.Г., Печинский С.В. Получение каротинодов и их идентификация методами спектроскопии в ИК- и УФ-областях // Вопросы биологическо, медицинской и фармацевтической химии. - 2016. - №1. - С. 22-27.  16. Куркин В.А., Шарова О.В., Афанасьева П.В. Совершенствование методики количественного определения суммы каротиноидов в сырье "Шиповника плоды" // Химия растительного сырья. - 2020. - №3. - С. 131-138. DOI: 10.14258/jcprm.2020036093.
16. Куркин В.А., Шарова О.В., Афанасьева П.В. Совершенствование методики количественного определения суммы каротиноидов в сырье "Шиповника плоды" // Химия растительного сырья. - 2020. - №3. - С. 131-138. DOI: 10.14258/jcprm.2020036093. 17. Никитин А.А. Анатомический атлас полезных и некоторых ядовитых растений / А. А. Никитин, И. А. Панкова ; Акад. наук СССР, Бот. ин-т им. В. Л. Комарова ; [отв. ред. Ал. А. Федоров]. - Ленинград : Наука, Ленинградское отделение, 1982. - 765 с.
17. Никитин А.А. Анатомический атлас полезных и некоторых ядовитых растений / А. А. Никитин, И. А. Панкова ; Акад. наук СССР, Бот. ин-т им. В. Л. Комарова ; [отв. ред. Ал. А. Федоров]. - Ленинград : Наука, Ленинградское отделение, 1982. - 765 с. 18. Обоснование выбора компонентов и их совместимости для разработки ранозаживляющего геля на основе хитозана. / П. А. Федосов, С. И. Провоторова, А. И. Сливкин [и др.] // Международный научно-исследовательский журнал. - 2015. - № 9. - С. 83-85.
18. Обоснование выбора компонентов и их совместимости для разработки ранозаживляющего геля на основе хитозана. / П. А. Федосов, С. И. Провоторова, А. И. Сливкин [и др.] // Международный научно-исследовательский журнал. - 2015. - № 9. - С. 83-85. 19. Пестрикова Н.В., Карпова Е.М., Мазина Н.К. Современные аспекты создания лекарственных форма как предпосылка разработки новых фармакотерапевтических технологий (обзор литературы) // Вятский медицинский вестник. - 2009. - № 2-4. - С. 26-30.
19. Пестрикова Н.В., Карпова Е.М., Мазина Н.К. Современные аспекты создания лекарственных форма как предпосылка разработки новых фармакотерапевтических технологий (обзор литературы) // Вятский медицинский вестник. - 2009. - № 2-4. - С. 26-30. 20. Посохина А.А. Компонентный состав и технология изготовления лечебно-косметического лосьона по уходу за кожей головы на основе извлечения из травы бархатцев отклоненных (Tagetes patula) / А. А. Посохина, Д. А. Снигирева // Актуальные вопросы современной медицины : Материалы VII Дальневосточного медицинского молодежного форума, Хабаровск, 02-14 октября 2023 года. - Хабаровск: Дальневосточный государственный медицинский университет, 2023. - С. 242-245.
20. Посохина А.А. Компонентный состав и технология изготовления лечебно-косметического лосьона по уходу за кожей головы на основе извлечения из травы бархатцев отклоненных (Tagetes patula) / А. А. Посохина, Д. А. Снигирева // Актуальные вопросы современной медицины : Материалы VII Дальневосточного медицинского молодежного форума, Хабаровск, 02-14 октября 2023 года. - Хабаровск: Дальневосточный государственный медицинский университет, 2023. - С. 242-245. 21. Разработка состава и технологии глазных лекарственных пленок с экстрактом алоэ / Ю. В. Шикова, В. А. Лиходед, А. В. Браженко [и др.] // Фармация и фармакология. - 2016. - Т. 4. - № 4. - С. 48-54.
21. Разработка состава и технологии глазных лекарственных пленок с экстрактом алоэ / Ю. В. Шикова, В. А. Лиходед, А. В. Браженко [и др.] // Фармация и фармакология. - 2016. - Т. 4. - № 4. - С. 48-54. 22. Рытченков С.В., Степанова Э.Ф., Рытченкова В.Ю., Поройский С.В. Современное состояние исследований получения аппликационных лекарственных форм // Научный аспект. - 2024. - Т. 22, № 3. - С. 2738-2752.
22. Рытченков С.В., Степанова Э.Ф., Рытченкова В.Ю., Поройский С.В. Современное состояние исследований получения аппликационных лекарственных форм // Научный аспект. - 2024. - Т. 22, № 3. - С. 2738-2752. 23. Скроцкая О.В., Пунегов В.В. Содержание каротиноидов в плодах растений видов и сортов рода Sorbus L. при интродукции в условиях Севера (Республика Коми) // Самарский научный вестник. - 2021. - Т. 10, № 3. - С. 112-116.
23. Скроцкая О.В., Пунегов В.В. Содержание каротиноидов в плодах растений видов и сортов рода Sorbus L. при интродукции в условиях Севера (Республика Коми) // Самарский научный вестник. - 2021. - Т. 10, № 3. - С. 112-116. 24. Таран Л.М., Башаров А.Я., Слободенюк Е.В., Булгаков В.П., Стрельникова Н.В. Полимерная пленка с нафтохиноновым комплексом биологически активных веществ воробейника краснокорневого // Патент РФ № 2595880, 2016. Бюл. № 24.
24. Таран Л.М., Башаров А.Я., Слободенюк Е.В., Булгаков В.П., Стрельникова Н.В. Полимерная пленка с нафтохиноновым комплексом биологически активных веществ воробейника краснокорневого // Патент РФ № 2595880, 2016. Бюл. № 24. 25. Шашкина М.Я., Шашкин П.Н., Сергеев А.В. Каротиноиды как основа для создания лечебно-профилактических средств // Российский биотерапевтический журнал. - 2009. - Т. 8, No 4. - С. 91-98.
25. Шашкина М.Я., Шашкин П.Н., Сергеев А.В. Каротиноиды как основа для создания лечебно-профилактических средств // Российский биотерапевтический журнал. - 2009. - Т. 8, No 4. - С. 91-98. 26. Шашкина М.Я., Шашкин П.Н., Сергеев А.В. Роль каротиноидов в профилактике наиболее распространенных заболеваний // Российский биотерапевтический журнал. - 2010. - Т. 9, № 1. - С. 77-86.
26. Шашкина М.Я., Шашкин П.Н., Сергеев А.В. Роль каротиноидов в профилактике наиболее распространенных заболеваний // Российский биотерапевтический журнал. - 2010. - Т. 9, № 1. - С. 77-86. 27. Шестаков Н.В., Лосенкова С.О., Закалюкина Е.В., Степанова Э.Ф. Ассортимент и характеристики трансмукозальных лекарственных форм (ассортимент лекарственных пленок) // Разработка и регистрация лекарственных средств. - 2017. - № 2(19). - С. 96-101.
27. Шестаков Н.В., Лосенкова С.О., Закалюкина Е.В., Степанова Э.Ф. Ассортимент и характеристики трансмукозальных лекарственных форм (ассортимент лекарственных пленок) // Разработка и регистрация лекарственных средств. - 2017. - № 2(19). - С. 96-101. 28. Юданова Т.Н., Решетов И.В. Современные раневые покрытия: получение и свойства (обзор) // Химико-фармацевтический журнал. - 2006. - Т. 40, № 2. - С. 24-31.
28. Юданова Т.Н., Решетов И.В. Современные раневые покрытия: получение и свойства (обзор) // Химико-фармацевтический журнал. - 2006. - Т. 40, № 2. - С. 24-31. 29. Spray Film-Forming Systems as Promising Topical In Situ Systems: A Review / E. Bakhrushina, M. Shumkova, F. Sergienko, E. Novozhilova, N. Demina // Saudi Pharmaceutical Journal. - 2022. - 31(5). 154-169. DOI:10.1016/j.jsps.2022.11.014
29. Spray Film-Forming Systems as Promising Topical In Situ Systems: A Review / E. Bakhrushina, M. Shumkova, F. Sergienko, E. Novozhilova, N. Demina // Saudi Pharmaceutical Journal. - 2022. - 31(5). 154-169. DOI:10.1016/j.jsps.2022.11.014
Телефон: (4212) 30-53-11
«Вестник общественного здоровья и здравоохранения Дальнего Востока России»

