2025 год № 4
Материалы VI Дальневосточного международного медицинского конгресса
2Луганский государственный университет имени Владимира Даля, Луганск, Россия
Резюме:
Ключевые слова:
2Lugansk State University named after Vladimir Dahl, Lugansk, Russia
Summary:
Key words:
Введение
|
 |
 |
Согласно статистическим данным научных исследований, около 6,5% населения регулярно испытывают боль, а приблизительно 45,0 % становятся жертвами хронического болевого синдрома [1]. Значительное количество побочных эффектов у существующих анальгетиков, таких как гепатотоксичность, гематотоксичность, нефротоксичность, ульцерогенность, кровоизлияния, тромбоцитопения и аллергические реакции, осложняет фармакологическую коррекцию болевого синдрома [2]. Наиболее сильному токсическому воздействию подвержена печень. Лекарственные поражения печени не только осложняют проводимую фармакотерапию сопутствующих заболеваний, но и при длительном течении могут приводить к необратимым изменениям, таким как цирроз и печеночная недостаточность [3, 4].
В настоящее время препараты группы гепатопротекторов являются достаточно популярными средствами. Однако эффективность большинства из них, несмотря на многообещающие результаты экспериментальных исследований, не подтверждена с позиций доказательной медицины [4, 5]. Таким образом, сегодня остро стоит вопрос о разработке, исследовании и внедрении в клиническую практику новых высокоэффективных, безопасных и экономически доступных лекарственных средств с гепатопротекторными свойствами, способных повысить резистентность печени к токсическому повреждению [6].
Одним из перспективных направлений таких исследований может стать комплексное изучение частично гидрированных пиридинов, производных - -цианотиоацетамида, которые обладают широким спектром фармакологической активности [7].
Материалы и методы
|
 |
 |
Основными объектами исследования выступили новые производные частично гидрированных пиридинов на основе - -цианотиоацетамида, синтезированные в научно-исследовательской лаборатории "Химэкс" Луганского государственного университета имени Владимира Даля. Эти соединения, имеющие лабораторные шифры Mar-014, Mar-037, d02-123, TD-0331 и Mar-075 (Рис.1), были отобраны после виртуального биоскрининга с использованием комплекса программ SwissTargetPrediction. Из первоначального массива в 430 соединений именно указанные производные продемонстрировали наиболее выраженную потенциальную активность в качестве гепатопротекторов [8].
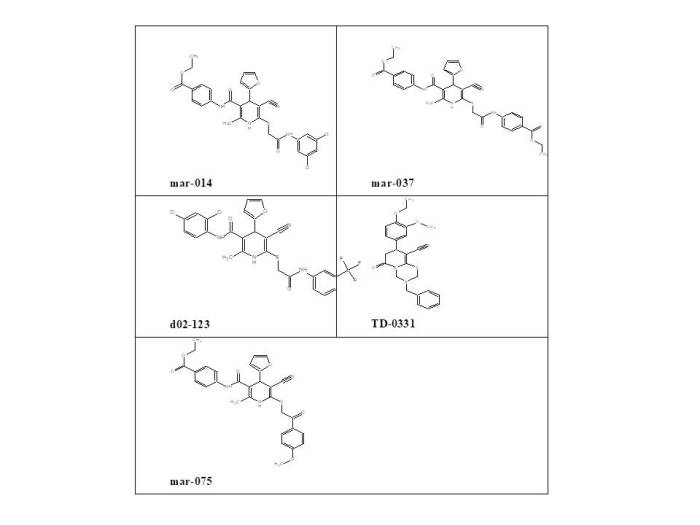
Рис. 1. Структурные формулы новых производных цианотиоацетамида
Экспериментальные исследования проводились в строгом соответствии с международными нормами и требованиями "Руководства по содержанию и использованию лабораторных животных", а также Приказа Минздравсоцразвития России № 708н от 23 августа 2010 года, регламентирующего правила надлежащей лабораторной практики. Все процедуры получили одобрение комиссии по биоэтике ФГБОУ ВО "Луганский государственный медицинский университет имени Святителя Луки" Минздрава России (протокол № 6 от 1 ноября 2024 г.).
Дизайн исследования новых частично гидрированных пиридинов, производных цианотиоацетамида, был реализован с использованием серии экспериментальных моделей на лабораторных крысах. В рамках первой модели острого парацетамолового гепатита эксперимент провели на 80 белых беспородных крысах-самцах массой 250- 300 г. Животных разделили на 8 групп по 10 особей: интактную (№1), контрольную (№2), референтную (№3) и пять опытных (№4- 8). В течение первых трёх суток крысам внутрижелудочно вводили: контрольной группе - физиологический раствор; референтной - тиотриазолин в дозе 10 мг/кг; опытным группам - изучаемые производные в дозе 5 мг/кг. Спустя час после введения веществ всем группам, кроме интактной, вводили парацетамол в дозе 1500 мг/кг в течение двух дней. На пятые сутки животных забивали, осуществляя забор крови из бедренной вены, после чего определяли уровни общего и прямого билирубина, АЛТ, АСТ и щелочной фосфатазы.
Вторая модель была посвящена хроническому парацетамольно-алкогольному гепатиту. В её основу легла экспериментальная модель сочетанного поражения печени, предложенная Ревякиным А.О. и соавт. в 2014 году [9]. Она включала двухнедельный энтеральный приём 1 мл 40° этанола и парацетамола в дозе 500 мг/кг один раз в сутки. Фармакологическую коррекцию с помощью новых производных цианотиоацетамида и препаратов сравнения проводили с 4 по 14 день моделирования. В эксперименте использовали 64 белых беспородных крысы-самца массой 220- 250 г, распределённых на 8 групп по 8 животных: интактную, контрольную, группу сравнения (тиотриазолин, 50 мг/кг) и пять опытных (исследуемые соединения, 5 мг/кг). На 15-е сутки выполняли забой и забор крови с последующим определением биохимических показателей.
Третья модель - хронический каловой перитонит - была воспроизведена на 80 белых беспородных крысах-самках массой 350- 400 г, разделённых на 8 групп по 10 животных. Перитонит индуцировали внутрибрюшинной инъекцией профильтрованной 10- 20% каловой взвеси на изотоническом растворе хлорида натрия. В исследовании выделяли интактную, контрольную группу, группу сравнения (линкомицин, 50 мг/кг) и шесть опытных (производные цианотиоацетамида, 5 мг/кг). Введение веществ начинали через час после моделирования перитонита. В первый день вводили 0,7 мл 10% взвеси, на шестой - 1 мл 20%, на десятый - 20% взвесь из расчёта 1 мл/100 г массы. В течение двух недель регистрировали динамику гибели животных [10].
Четвертая модель, "барбитуровый сон", была выполнена на 64 беспородных крысах-самках массой 290- 330 г, разделённых на 8 групп по 8 особей. Интактная группа оставалась без вмешательств, контрольная получала парацетамол (1500 мг/кг) на 3 и 4 день, группа сравнения - карсил (200 мг/кг) с 1 по 4 день и парацетамол на 3 и 4 день, а пять опытных - изучаемые производные (5 мг/кг) с 1 по 4 день и парацетамол на 3 и 4 день. На пятый день всем животным внутрибрюшинно вводили тиопентал натрия (70 мг/кг) для моделирования барбитурового сна. В течение последующих 24 часов фиксировали время от момента принятия животным "бокового положения" до первой попытки сменить позу [11].
Пятая модель касалась острого рифампициново-изониазидно-пиразинамидного гепатита. В эксперименте использовали 80 белых беспородных крыс-самцов массой 250- 300 г, разделённых на 8 групп по 10 животных: интактную, контрольную, референтную и четыре опытные. Гепатит моделировали введением рифампицина (150 мг/кг), изониазида (240 мг/кг) и пиразинамида (760 мг/кг) один раз в сутки в течение пяти дней. С 6 по 12 день проводили фармакокоррекцию: опытные группы получали производные цианотиоацетамида (5 мг/кг) энтерально, референтная - адеметионин (72 мг/кг) внутрибрюшинно. На 13 день животных забивали, проводили забор крови и определяли биохимические параметры [12].
Наконец, была выполнена оценка острой и хронической пероральной токсичности новых производных. Острую токсичность изучали на 18 крысах-самцах (220- 250 г), распределённых на 6 групп по 3 особи: интактная получала дистиллированную воду, пять опытных - исследуемые соединения в дозе 2000 мг/кг в виде суспензии с крахмалом однократно. Хроническую токсичность оценивали на 80 крысах-самцах (220- 250 г), которых разделили на интактную группу и 9 групп по 8 животных: четыре референтные группы получали индометацин (7 мг/кг), нимесулид (5 мг/кг), ацетилсалициловую кислоту и парацетамол (50 мг/кг) однократно в сутки в течение 14 дней, а пять опытных - исследуемые производные в дозе 5 мг/кг по той же схеме. На 15 день проводили забой, забор крови и определение уровня общего билирубина, АЛТ и щелочной фосфатазы [13].
Статистическую обработку данных проводили с использованием стандартных методов: t-критерия Стьюдента, критерия Уилкоксона и метода Крускала- Уоллиса с последующим анализом по критерию Данна.
Результаты и обсуждение
|
 |
 |
1. Модель острого парацетамолового гепатита.
Крысы, составлявшие контрольную группу в модели острого парацетамолового гепатита, начиная с третьего дня эксперимента демонстрировали выраженную заторможенность. Потребление корма и воды у них сократилось вдвое, а трое животных погибли. В то же время, во всех группах, получавших фармакологическую коррекцию, гибели не наблюдалось. Эти животные сохраняли активность, свободно передвигались по клетке, а их аппетит и потребление воды оставались в пределах нормы.
Биохимические показатели контрольной группы подтвердили тяжесть поражения печени. Уровень общего билирубина превышал значения интактных животных в 2,8 раза, прямого билирубина - в 2,55 раза. Активность АЛаТ и АСаТ была повышена на 59,3% и 63,6% соответственно, а щелочной фосфатазы - на 91,5%, что полностью согласовывалось с угнетенным состоянием животных, отмечаемым визуально.
У крыс референтной и большинства опытных групп биохимические параметры оставались на уровне интактных животных. Исключением стала группа, получавшая образец с шифром Mar-037, где было зафиксировано снижение общего билирубина на 32,58% и прямого - на 54,84%, но при этом активность АЛаТ оказалась повышена на 49,03%. В других опытных группах также отмечались некоторые изменения: в группе d02-123 активность АСаТ была снижена на 27,47% по сравнению с интактной, а в группе Mar-014 - на 25,61%.
Статистическая обработка данных проводилась с использованием непараметрического метода множественных сравнений Крускала-Уоллиса с поправкой Данна. Группы были пронумерованы для расчёта следующим образом: интактная - 1, контрольная - 2, группа сравнения - 3, d02-123 - 4, Mar-014 - 5, Mar-075 - 6, TD-0331 - 7, Mar-037 - 8. Полученные результаты представлены в табл. 1.
| Общий билирубин | Прямой билирубин | АЛТ | АСТ | ЩФ | |
|---|---|---|---|---|---|
| Pair | Р-value | ||||
| x1-x2 | 0.000178* | 0.01318 | 0.07743 | 0.1397 | 0.002632* |
| x1-x3 | 0.0232 | 0.06575 | 0.327 | 0.02408 | 0.3939 |
| x1-x4 | 0.01396 | 0.07522 | 0.727 | 0.005189* | 0.5728 |
| x1-x5 | 0.006384 | 0.08561 | 0.006484 | 0.01912 | 0.4127 |
| x1-x6 | 0.005316* | 0.02507 | 0.1527 | 0.005835* | 0.1815 |
| x1-x7 | 0.004008* | 0.08455 | 0.2797 | 0.08206 | 0.3075 |
| x1-x8 | 0.0008826* | 0.004458* | 0.003974* | 0.003404* | 0.005728* |
| x2-x3 | 0.001964* | 0.00418* | 0.005032* | 0.0001893* | 0.0001132* |
| x2-x4 | 0.004899* | 0.005197* | 0.03444 | 0.00004466* | 0.01453 |
| x2-x5 | 0.01479 | 0.007809 | 0.0003037* | 0.0001334* | 0.0001298* |
| x2-x6 | 0.09856 | 0.0002861 | 0.001394* | 0.00004215* | 0.000014* |
| x2-x7 | 0.01592 | 0.02237 | 0.004417* | 0.0013 | 0.00005619* |
| x2-x8 | 0.00003426* | 0.000007208* | 0.6336 | 0.2021 | 0.001453* |
(*) - различия статистически значимые.
2.В ходе эксперимента по моделированию хронического парацетамольно-алкогольного гепатита было отмечено, что крысы контрольной группы демонстрировали выраженные изменения в поведении. Животные стали агрессивными по отношению друг к другу, между ними возникали драки, в результате чего двум крысам были повреждены хвосты. Помимо этого, у них наблюдалось заметное снижение потребления корма. В то же время в группах, получавших фармакологическую коррекцию, поведение крыс оставалось обычным: они были спокойны, свободно передвигались по клетке, а их аппетит и потребление воды не отличались от показателей крыс интактной группы.
Для определения статистической достоверности выявленных различий был использован t-критерий Стьюдента. Различия считались статистически значимыми при критическом значении t-критерия, равном 2,101, и уровне значимости p < 0,05. Полученные данные представлены в табл. 2.
| Группы | Показатели | ||||
|---|---|---|---|---|---|
| Общий билирубин | Прямой билирубин | АЛТ | АСТ | ЩФ | |
| (Mar-75) | 5,1 | 0,9 | 5 | 2,19 | 11,6 |
| (Mar-014) | 9,96 | 7,02 | 5,2 | 6,42 | 11,5 |
| (Mar-37) | 7,32 | 1,11 | -0,04 | 3,2 | 13,96 |
| (TD-0331) | 10,73 | 4,49 | 3,37 | 2,76 | 18,8 |
| (d02-123) | 9,78 | 5,53 | 2,8 | 11,83 | 11,4 |
| (тиотриазолин) | 8,3 | 4,5 | -0,85 | 5,42 | 10,24 |
При сравнении с интактной группой у животных контрольной группы было зафиксировано достоверное увеличение всех биохимических маркеров функции печени: уровень общего билирубина повысился на 65,3%, прямого билирубина - на 37,8%, а активность АЛТ, АСТ и щелочной фосфатазы (ЩФ) возросла на 38,85%, 51,54% и 163% соответственно. В референтной группе также наблюдался рост активности ферментов: АЛТ на 44,76%, АСТ на 18,11% и ЩФ на 19,4%.
На этом фоне исследуемые соединения продемонстрировали различный защитный эффект. В группе, получавшей соединение Mar-014, показатели общего билирубина, аминотрансфераз и ЩФ статистически не отличались от значений в интактной группе, что свидетельствует о полной нормализации этих параметров. При этом уровень прямого билирубина был даже ниже интактного на 42,7%.
Соединение TD-0331 также показало высокую эффективность: уровни общего и прямого билирубина, а также АЛТ были близки к норме. При этом активность АСТ оставалась повышенной на 35,7%, а уровень ЩФ, напротив, был снижен на 43,1% по сравнению с интактной группой.
Соединение Mar-037 при сравнении с контрольной группой значимо снизило уровень общего билирубина на 75,3%, прямого - на 10,1%, а активность АСТ - на 12%. При этом активность АЛТ и ЩФ у этих животных находилась в пределах нормальных значений.
В группе с соединением Mar-075 также отмечалось положительное влияние: общий билирубин был ниже контрольных значений на 51,6%, прямой - на 11,6%, а активность АСТ - на 18,64%. Однако уровень щелочной фосфатазы оказался резко повышен - на 272,4% относительно контрольной группы.
Наконец, производное d02-123 проявило себя как наиболее эффективное, способствуя полной нормализации всех исследуемых печеночных проб до уровня, сопоставимого с интактными животными.
3.Была разработана экспериментальная модель острого лекарственного гепатита, индуцированного комбинацией рифампицина, изониазида и пиразинамида. Её целью стало воспроизведение максимально выраженного гепатоцеллюлярного типа поражения печени. Для этого применялись высокие дозы изониазида и пиразинамида, составлявшие 1/5 от их LD50, в сочетании со сравнительно малой дозой рифампицина (1/126 от LD50). Подобный подбор дозировок позволил минимизировать самостоятельный холестатический потенциал рифампицина, но при этом использовать его свойство усиливать гепатотоксические эффекты двух других препаратов.
В результате у животных контрольной группы развилась значительная гепатотоксичность. По сравнению с интактными животными, у них наблюдался резкий, более чем трехкратный рост уровня общего билирубина, в то время как прямой билирубин увеличился в 3,73 раза. Активность ферментов также существенно возросла: АЛТ на 92,5%, АСТ на 49,2%, а щелочная фосфатаза на 38,5%. В группе сравнения, напротив, динамика была менее выраженной: прямой билирубин увеличился лишь в 2,6 раза, а показатели общего билирубина и АЛТ остались близки к норме.
На этом фоне была оценена гепатопротекторная активность ряда исследуемых соединений. Так, соединение TD-0331 продемонстрировало выраженный защитный эффект, нормализовав уровни общего и прямого билирубина, АлАТ и щелочной фосфатазы; лишь активность АСТ оставалась несколько повышенной на 22,4%. Производное d02-123 также способствовало полной нормализации всех исследованных печеночных проб.
Крысы, получавшие образцы с шифрами Mar-014, Mar-037 и Mar-075, продемонстрировали относительную нормализацию биохимических показателей. При сравнении с контрольной группой уровень общего билирубина в группах Mar-014 и Mar-075 был в 2,21 раза ниже, а в группе Mar-037 он составил 0,98, что соответствует нормальным значениям. Важно отметить, что концентрации прямого билирубина, трансаминаз и щелочной фосфатазы в крови животных всех этих опытных групп находились в пределах, характерных для интактных животных.
Все полученные результаты были подвергнуты статистической обработке с использованием непараметрического критерия Уилкоксона и представлены в табл. 3.
| Группы | Показатель | ||||
|---|---|---|---|---|---|
| Общий билирубин | Прямой билирубин | АЛТ | АСТ | Щелочная фосфатаза | |
| Контрольная | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк - (p<0.05*) | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк - (p<0.05*) | Np=10 Тф=1 Тк(0.05)=10 Тф<Тк - (p<0.05*) | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк - (p<0.05*) | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк - (p<0.05*) |
| адеметионин | Np=10 Тф=15 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=7 Тк(0.05)=10 Тф<Тк- (p<0.05*) | Np=10 Тф=10 Тк(0.05)=10 Тф=Тк- (p<0.05*) | Np=10 Тф=4 Тк(0.05)=10 Тф<Тк- (p<0.05*) | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк- (p<0.05*) |
| TD-0331 | Np=10 Тф=21 Тк(0.05)=10 Тф>Тк- (p>0.05) | Np=10 Тф=16 Тк(0.05)=10 Тф>Тк- (p>0.05) | Np=10 Тф=14 Тк(0.05)=10 Тф>Тк- (p>0.05) | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк - (p<0.05*) | Np=10 Тф=11 Тк(0.05)=10 Тф>Тк- (p>0.05) |
| d02-123 | Np=10 Тф=20 Тк(0.05)=10 Тф>Тк- (p>0.05) | Np=10 Тф=16 Тк(0.05)=10 Тф>Тк- (p>0.05) | Np=10 Тф=0 Тк(0.05)=10 Тф<Тк- (p>0.05) | Np=10 Тф=4 Тк(0.05)=10 Тф<Тк - (p>0.05) | Np=10 Тф=11 Тк(0.05)=10 Тф>Тк - (p>0.05) |
| Mar-014 | Np=10 Тф=18 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=15; Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=1 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=16 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=20 Тк(0.05)=10 Тф>Тк - (p>0.05) |
| Mar-037 | Np=10 Тф=14 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=13 Тк(0.05)=10 Тф>Тк- (p>0.05) | Np=10 Тф=18 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=7 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=11 Тк(0.05)=10 Тф>Тк - (p>0.05) |
| Mar-075 | Np=10 Тф=14 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=13 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=18 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=7 Тк(0.05)=10 Тф>Тк - (p>0.05) | Np=10 Тф=11 Тк(0.05)=10 Тф>Тк - (p>0.05) |
Примечание: Тк - критическое значение; Тф - фактическое значение; Nр - количество наблюдений; (*) - различия статистически значимые.
4. Модель "барбитурового сна". Крысы интактной группы провели в состоянии "барбитурового сна" в среднем 74,4 минуты, тогда как у животных контрольной группы этот показатель достиг 414,8 минут. При этом пятеро из восьми крыс в контрольной группе оставались в боковом положении до наступления гибели. В группе сравнения продолжительность сна составила 356,8 минут, причём трое животных постоянно лежали, отказываясь от корма и воды.
Среди опытных групп, получавших различные исследуемые образцы, наблюдались следующие результаты: самая короткая длительность сна зафиксирована в группе Mar-037 - 147,8 минут, затем следовали Mar-014 = 152,4 минуты, d02-123 - 228,6 минут, TD-0331 - 247,7 минут и Mar-075 - 250,3 минут.
Спустя шесть часов после введения барбитуратов в интактной группе все крысы сохраняли активность. В контрольной группе, напротив, животные были вялыми, не двигались, не принимали пищу и воду, дыхание было поверхностным, шерсть - взъерошенной. В группе сравнения лишь три крысы демонстрировали активное поведение.
В опытных группах картина различалась: в группе d02-123 все животные вышли из наркоза, трое свободно перемещались по клетке; в группе TD-0331 крысы бодрствовали, но не двигались, трое оставались в положении лёжа; в группе Mar-037 животные проявляли интерес к еде и воде, хотя трое также лежали; в группе Mar-014 семь крыс были довольно активны, медленно передвигались, ели и пили, и лишь одна оставалась лежать; в группе Mar-075 крысы отошли от наркоза, но двое из них сохраняли лежачее положение.
Через двенадцать часов в интактной группе пятеро крыс двигались, ели и пили. В контрольной группе одна крыса погибла, а три находились в тяжёлом терминальном состоянии с поверхностным дыханием и отсутствием движений. В группе сравнения также умерла одна крыса, четверо спокойно сидели и пили воду. В группе d02-123 все животные оставались живы и активны; в группе TD-0331 - все выжили, но по-прежнему не двигались; в группе Mar-075 погибло две крысы, трое сидели; в группе Mar-014 умерла одна крыса, остальные свободно передвигались, ели и пили; в группе Mar-037 все животные были живы, хотя не проявляли активности, четверо находились в сидячем положении.
Наблюдение в течение трёх суток показало, что наибольшее число смертей произошло в контрольной группе - погибло пять крыс. В группе сравнения умерли три особи, в группе Mar-075 - две, а в группе Mar-014 - одна крыса.
5. Модель хронического калового перитонита. После первого введения каловой взвеси у всех подопытных животных наблюдалось значительное ухудшение состояния: они становились заторможенными, малоподвижными, полностью отказывались от корма и воды. Однако в последующие дни их состояние постепенно стабилизировалось - возвращалась активность, нормализовалось дыхание, появлялись аппетит и жажда. Несмотря на эту временную положительную динамику, на третий день эксперимента в группе сравнения была зарегистрирована одна гибель.
К шестому дню у крыс вновь проявились тревожные симптомы. Сначала животные демонстрировали возбужденное и даже агрессивное поведение, но уже через 6 часов оно сменилось резкой вялостью, нарушением дыхания и слабой реакцией на внешние раздражители.
На десятый день картина стала еще более выраженной. С самого утра крысы контрольной группы были крайне возбуждены и агрессивны, однако спустя несколько часов наступила фаза полной апатии. Двигательная активность резко снизилась, сменившись вялостью и заторможенностью. При вскрытии в брюшной полости обнаруживалось от 1,4 до 2,1 мл мутной жидкости, а на поверхности внутренних органов, особенно селезенки, виднелись характерные белые фибринозные наложения. Выжившие животные лежали неподвижно, приняв вынужденную позу на боку с поджатыми задними лапами, стараясь щадить болезненную область живота. Они полностью отказывались от еды и воды, их шерсть была взъерошена, а дыхание - поверхностным. Любое прикосновение к брюшной стенке вызывало у них резкую болезненную реакцию.
Динамика смертности крыс на фоне трехкратного внутрибрюшинного введения каловой взвеси возрастающей концентрации отражена в табл. 4.
| Группа | Час | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 % | 6 % | 12 % | 24 % | 36 % | 48 % | 60 % | 72 % | 84 % | 96 % | |
| Контроль | 0 | 0 | 50 | 87,5 | 100 | 100 | 100 | 100 | 100 | 100 |
| Сравнение | 12,5 | 12,5 | 50 | 87,5 | 100 | 100 | 100 | 100 | 100 | 100 |
| TD-0331 | 0 | 0 | 37,5 | 37,5 | 37,5 | 37,5 | 37,5 | 37,5 | 37,5 | 37,5 |
| Mar-075 | 0 | 0 | 25 | 25 | 50 | 50 | 50 | 50 | 50 | 50 |
| d02-123 | 0 | 0 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| Mar-014 | 0 | 12,5 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 |
| Mar-037 | 0 | 0 | 37,5 | 37,5 | 37,5 | 37,5 | 50 | 50 | 50 | 50 |
Оценка острой и хронической пероральной токсичности новых производных цианотиоацетамида.
На протяжении первых суток после введения соединений за животными велось непрерывное наблюдение. Уже в первый час эксперимента поведение крыс, получавших исследуемые вещества, не отличалось от поведения интактной группы. Животные оставались активными, сохраняли нормальную двигательную активность, признаков судорожной активности отмечено не было. Крысы свободно перемещались по клетке, частота и глубина дыхательных движений у всех групп оставались в пределах нормы. Подобная картина сохранялась на всём протяжении эксперимента. Интерес к корму и воде у подопытных животных оставался таким же, как и у интактной группы, доступ к воде был неограничен. Шерстяной покров у всех крыс сохранял нормальное состояние с начала до завершения исследования. Количество и консистенция фекальных масс, частота мочеиспускания и окраска мочи у животных опытных групп также не отличались от контрольных показателей.
Введение максимальной дозировки (2000 мг/кг) частично гидрированных пиридинов не привело к гибели животных, что позволило отнести данные соединения к 5 классу токсичности, то есть к категории малотоксичных веществ. В соответствии со схемой введения, используемой в Стандарте, значение LD50 для этих соединений составляет более 5000 мг/кг.
При изучении хронической токсичности было выявлено влияние некоторых соединений на биохимические показатели функции печени. Так, уровень общего билирубина по сравнению с интактной группой повысился: при введении парацетама - на 30%, нимесулида - на 35%, соединения Mar-037 - на 48%, а соединения TD-0331 - на 21%. В то же время у крыс, получавших соединения d02-123, Mar-014 и Mar-075, достоверных изменений концентрации билирубина зарегистрировано не было.
Активность щелочной фосфатазы увеличилась в группе с парацетамом на 138,6%, с нимесулидом - на 144,2%, с соединением Mar-037 - на 136,5%, Mar-075 - на 137,4%, Mar-014- на 131,5%. Не отмечалось изменений данного показателя у животных, получавших вещества d02-123 и TD-0331.
Уровень аланинаминотрансферазы (АЛТ) повысился на 41% в группе парацетама, на 46% - в группе нимесулида, на 42% - у соединения Mar-037. Для соединений Mar-075 и Mar-014 также отмечен рост показателя. В то же время концентрация АЛТ осталась неизменной у крыс, получавших вещества d02-123 и Mar-014.
Несмотря на выявленные биохимические сдвиги, в ходе эксперимента по изучению хронической гепатотоксичности новых производных цианотиоацетамида видимых признаков интоксикации зафиксировано не было. Аппетит животных сохранялся, двигательная активность оставалась в норме, агрессивность или конфликтное поведение не наблюдались.
Статистическая обработка данных проводилась с использованием непараметрического метода сравнения Уилкоксона, а все полученные результаты представлены в табл. 5.
| Группы | Показатели |
||
|---|---|---|---|
| Общий билирубин | АЛТ | Щелочная фосфатаза | |
| Индометацин | Np=8 Тф=8 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=7 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=10 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) |
| Парацетамол | Np=8 Тф=1 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) | Np=8 Тф=0 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) | Np=8 Тф=0 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) |
| АСК | Np=8 Тф=8 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=7,5 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=6 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) |
| Нимесулид | Np=8 Тф=0 Тк(0.05)=5 Тф<Тк(0.05)-отличи (p<0.05*) | Np=8 Тф=1 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) | Np=8 Тф=0 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) |
| d02-123 | Np=8 Тф=11 Тк(0.05)=5; Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=11 Тк(0.05)=5; Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=9 Тк(0.05)=5; Тф>Тк(0.05)- (p>0.05) |
| Mar-075 | Np=8 Тф=6 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=7 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=3 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) |
| Mar-014 | Np=8 Тф=10 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=9 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=6 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) |
| Mar-037 | Np=8 Тф=0 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) | Np=8 Тф=0 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) | Np=8 Тф=3 Тк(0.05)=5 Тф<Тк(0.05)- (p<0.05*) |
| TD-0331 | Np=8 Тф=6 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) | Np=8 Тф=5 Тк(0.05)=5 Тф=Тк(0.05)- (p<0.05*) | Np=8 Тф=8 Тк(0.05)=5 Тф>Тк(0.05)- (p>0.05) |
Примечание: Тк - критическое значение; Тф - фактическое значение; Nр - количество наблюдений; (*) - различия статистически значимые.
Заключение
|
 |
 |
Экспериментально подтверждено, что у ряда новых производных 1,4-дигидропиридина (Mar-014, Mar-037, d02-123, TD-0331, d02-149, Mar-075) наряду с анальгетическим и противовоспалительным эффектом обнаружены гепатопротекторные и антитоксические качества. Причем их эффективность в защите печени оказалась выше, чем у широко известных лекарств - Карсила, Адеметионина и Тиотриазолина.
Сведения о финансировании
Настоящее исследование стало возможным благодаря финансовой поддержке в форме государственных заданий. Работа велась по проекту Министерства образования и науки РФ "Новые гетероциклические производные метиленактивных нитрилов, тиоамидов и селенамидов: синтез, свойства и биологическая активность" (код FREE-2023-0002). Параллельно исследования поддерживались Министерством здравоохранения РФ в рамках темы "Поиск новых высокоэффективных и безопасных лекарственных средств среди ранее неизвестных гетероциклических цианотиоацетамидных производных отечественного производства" (код ZUNP-2024-0002).
Заявление о конфликте интересов: авторы данной статьи подтверждают, что у них нет каких-либо конфликтов интересов, которые могли бы повлиять на результаты или выводы, представленные в данной работе.
Вклад авторов. Все авторы участвовали в подготовке данной публикации на всех этапах, включая разработку концепции, проведение исследования, анализ данных и написание рукописи. Вклад всех соавторов является равнозначным.
Список литературы |
 |
 1. Ярославская М. А., Пфаф В. Ф., Николаенко Э. М. Медико-психологический подход в проблеме понимания феномена "боли" // Медицина. - 2017. - № 1. - С. 56- 57.
1. Ярославская М. А., Пфаф В. Ф., Николаенко Э. М. Медико-психологический подход в проблеме понимания феномена "боли" // Медицина. - 2017. - № 1. - С. 56- 57. 2. Буеверов А. О., Буеверова Е. Л. Эволюция представлений о лекарственных поражениях печени // Экспериментальная и клиническая гастроэнтерология. - 2019. - № 163(3). - С. 89- 96. - DOI: 10.31146/1682-8658-ecg-163-3-89-96.
2. Буеверов А. О., Буеверова Е. Л. Эволюция представлений о лекарственных поражениях печени // Экспериментальная и клиническая гастроэнтерология. - 2019. - № 163(3). - С. 89- 96. - DOI: 10.31146/1682-8658-ecg-163-3-89-96.  3. Кочетков А. И., Акимова Е. С., Остроумова О. Д. Патогенетические механизмы лекарственных повреждений печени // Сибирское медицинское обозрение. - 2020. - № 6. - С. 36.
3. Кочетков А. И., Акимова Е. С., Остроумова О. Д. Патогенетические механизмы лекарственных повреждений печени // Сибирское медицинское обозрение. - 2020. - № 6. - С. 36. 4. Симаненков В. И., Лутаенко Е. А., Лищук Н. Б. Выбор универсального гепатопротектора при патологии гепатобилиарного тракта // Справочник поликлинического врача. - 2018. - № 2. - С. 34.
4. Симаненков В. И., Лутаенко Е. А., Лищук Н. Б. Выбор универсального гепатопротектора при патологии гепатобилиарного тракта // Справочник поликлинического врача. - 2018. - № 2. - С. 34. 5. Гальченко О. Е., Морозова В. А., Бабаева А. Р. Современные возможности применения гепатопротекторов в лечении хронических диффузных заболеваний печени // Лекарственный вестник. Фармакотерапия в гастроэнтерологии. - 2015. - № 2(58). - С. 7.
5. Гальченко О. Е., Морозова В. А., Бабаева А. Р. Современные возможности применения гепатопротекторов в лечении хронических диффузных заболеваний печени // Лекарственный вестник. Фармакотерапия в гастроэнтерологии. - 2015. - № 2(58). - С. 7. 6. Исследование новых производных 1,4-дигидропиридина как потенциальных средств с болеутоляющей активностью в тесте орофациальной тригеминальной боли: экспериментальное доклиническое рандомизированное исследование / Е. Ю. Бибик, И. С. Олейник, А. А. Панков [и др.] // Кубанский научный медицинский вестник. - 2023. - № 30(2). - С. 64- 75.
6. Исследование новых производных 1,4-дигидропиридина как потенциальных средств с болеутоляющей активностью в тесте орофациальной тригеминальной боли: экспериментальное доклиническое рандомизированное исследование / Е. Ю. Бибик, И. С. Олейник, А. А. Панков [и др.] // Кубанский научный медицинский вестник. - 2023. - № 30(2). - С. 64- 75. 7. Изучение влияния частично гидрированных пиридинов, производных цианотиоацетамида, на показатели крови крыс с острым тетрациклиновым гепатитом / Е. Ю. Бибик, Б. С. Кривоколыско, Е. П. Петлюк [и др.] // Вестник Волгоградского государственного медицинского университета. - 2019. - № 2(70). - С. 43.
7. Изучение влияния частично гидрированных пиридинов, производных цианотиоацетамида, на показатели крови крыс с острым тетрациклиновым гепатитом / Е. Ю. Бибик, Б. С. Кривоколыско, Е. П. Петлюк [и др.] // Вестник Волгоградского государственного медицинского университета. - 2019. - № 2(70). - С. 43. 8. Кривоколыско Д. С., Доценко В. В., Бибик Е. Ю. Синтез, строение и анальгетическая активность этиловых эфиров 4-({4-(2-фурил)-5-циано-1,4-дигидропиридин-3-ил}карбоксамидо)бензойной кислоты // Журнал общей химии. - 2022. - Т. 92, № 1. - С. 72- 91.
8. Кривоколыско Д. С., Доценко В. В., Бибик Е. Ю. Синтез, строение и анальгетическая активность этиловых эфиров 4-({4-(2-фурил)-5-циано-1,4-дигидропиридин-3-ил}карбоксамидо)бензойной кислоты // Журнал общей химии. - 2022. - Т. 92, № 1. - С. 72- 91. 9. Моделирование лекарственного токсического гепатита на крысах / А. О. Ревякин, Г. Д. Капанадзе, Н. В. Касинская [и др.] // Биомедицина. - 2013. - № 4. - С. 124- 125.
9. Моделирование лекарственного токсического гепатита на крысах / А. О. Ревякин, Г. Д. Капанадзе, Н. В. Касинская [и др.] // Биомедицина. - 2013. - № 4. - С. 124- 125. 10. Влияние частично гидрированных пиридинов, производных цианотиоацетамида, на показатели летальности крыс с каловым перитонитом / Е. Ю. Бибик, Б. С. Кривоколыско, Ю. С. Венидиктова [и др.] // Вятский медицинский вестник. - 2021. - № 2(70). - С. 67- 73. - DOI: 10.24412/2220-7880-2021-2-67-73.
10. Влияние частично гидрированных пиридинов, производных цианотиоацетамида, на показатели летальности крыс с каловым перитонитом / Е. Ю. Бибик, Б. С. Кривоколыско, Ю. С. Венидиктова [и др.] // Вятский медицинский вестник. - 2021. - № 2(70). - С. 67- 73. - DOI: 10.24412/2220-7880-2021-2-67-73. 11. Гепатопротекторное действие нового сбора из растительного сырья в сравнении с препаратом "карсил" (экспериментальное исследование) / Н. Р. Чехани, Л. А. Павлова, С. В. Козин [и др.] // Новые химико-фармацевтические технологии : материалы науч.-практ. конф., Москва, 28 мая 2014 г. / РХТУ им. Д. И. Менделеева ; под ред. Г. В. Авраменко, А. Е. Коваленко. - Москва, 2014. - С. 63- 66.
11. Гепатопротекторное действие нового сбора из растительного сырья в сравнении с препаратом "карсил" (экспериментальное исследование) / Н. Р. Чехани, Л. А. Павлова, С. В. Козин [и др.] // Новые химико-фармацевтические технологии : материалы науч.-практ. конф., Москва, 28 мая 2014 г. / РХТУ им. Д. И. Менделеева ; под ред. Г. В. Авраменко, А. Е. Коваленко. - Москва, 2014. - С. 63- 66. 12. Яковлева Л. В., Геруш О. В., Мищенко О. Я. Гепатопротекторное действие нового растительного средства в условиях экспериментального гепатита, вызванного туберкулостатиками // Universum: медицина и фармакология : электрон. науч. журн. - 2017. - № 3(37). - URL: http://7universum.com/ru/med/archive/item/4420
12. Яковлева Л. В., Геруш О. В., Мищенко О. Я. Гепатопротекторное действие нового растительного средства в условиях экспериментального гепатита, вызванного туберкулостатиками // Universum: медицина и фармакология : электрон. науч. журн. - 2017. - № 3(37). - URL: http://7universum.com/ru/med/archive/item/4420 13. Исследование гепатотоксичности новых производных цианотиоацетамида в хроническом эксперименте / Е. Ю. Бибик, А. С. Саул, С. Г. Кривоколыско [и др.] // Международный научно-исследовательский журнал. - 2024. - № 2(140). - С. 1- 10.
13. Исследование гепатотоксичности новых производных цианотиоацетамида в хроническом эксперименте / Е. Ю. Бибик, А. С. Саул, С. Г. Кривоколыско [и др.] // Международный научно-исследовательский журнал. - 2024. - № 2(140). - С. 1- 10.
Телефон: (4212) 30-53-11
«Вестник общественного здоровья и здравоохранения Дальнего Востока России»

